Modely atomu V devatenctm stolet nastupuje atomismus chemick
























- Slides: 36

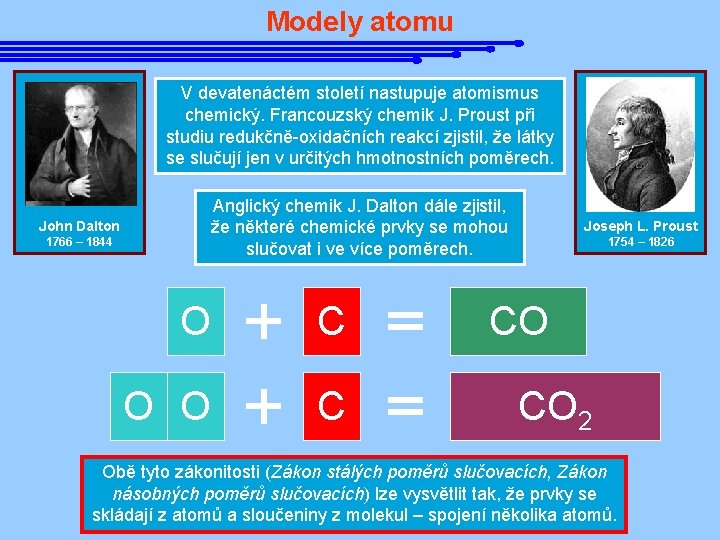
Modely atomu V devatenáctém století nastupuje atomismus chemický. Francouzský chemik J. Proust při studiu redukčně-oxidačních reakcí zjistil, že látky se slučují jen v určitých hmotnostních poměrech. Anglický chemik J. Dalton dále zjistil, že některé chemické prvky se mohou slučovat i ve více poměrech. John Dalton 1766 – 1844 O C O O C Joseph L. Proust 1754 – 1826 CO CO 2 Obě tyto zákonitosti (Zákon stálých poměrů slučovacích, Zákon násobných poměrů slučovacích) lze vysvětlit tak, že prvky se skládají z atomů a sloučeniny z molekul – spojení několika atomů.

Modely atomu Myšlenka, že látka není spojitá, má strukturu a skládá se z atomů pochází z antiky. Propagovali ji filozofové jako Demokritos, Epikuros a další. Demokritos 460 – 370 př. n. l. Pierre Gassendi Isaac Newton 1592 – 1655 1643 – 1727 Na antický atomismus navazovali mnozí filozofové a fyzikové novověku, např. francouzský matematik a astronom Pierre Gassendi nebo Isaac Newton. Pro své domněnky však neměli jediný důkaz.

Modely atomu Hypotézu atomů potvrdily i další objevy. Francouzský fyzik J. L. Gay-Lussac přišel na další zákon chemického slučování. Zjistil, že slučují-li se některé plyny, vstupují do reakce vždy jejich stejné nebo násobné objemy. To se dá vysvětlit tak, že ve stejných objemech různých plynů je stejný počet atomů. Joseph L. Gay-Lussac 1778 – 1850 Ve zbylých případech se objem plynů mění – např. při slučování jednoho dílu chloru a jednoho dílu vodíku vznikají dva díly chlorovodíku. Tuto nejasnost vysvětlil italský fyzik a chemik Avogadro zákonem který říká, že ve stejných objemech různých plynů je při stejném tlaku a teplotě vždy stejný počet molekul. Přitom předpokládal, že některé prvky v plynném stavu nejsou jednoatomové, ale jsou tvořeny molekulami (např. H 2 či Cl 2, které pak dají vzniknout dvěma molekulám HCl). Amadeo Avogadro 1776 – 1856

discovery of electron

Objev elektronu Katodové paprsky

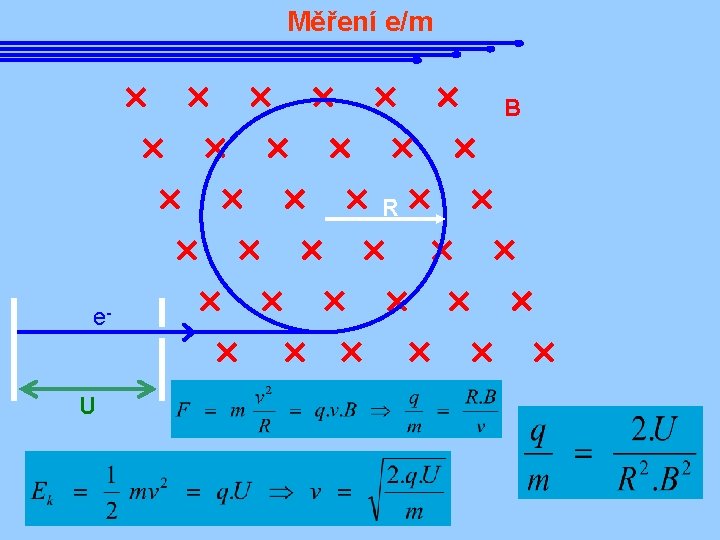
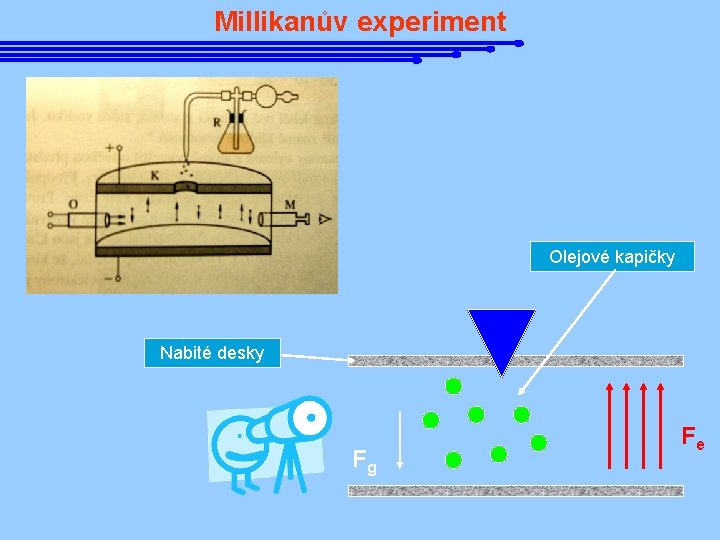
Objev elektronu J. J. Thompson roku 1897 vysvětlil katodové paprsky pomocí proudu nabitých částic, jakýchsi „částeček elektřiny“. Pro tyto částice se ujal název elektron. Ze zakřivení drah elektronů v magnetickém poli určil Thompson měrný náboj elektronu, tj. veličinu e/me. Joseph J. Thompson 1856 - 1940 Americký fyzik R. Millikan prováděl v roce 1910 řadu pokusů k určení hodnoty elektrického náboje elektronu, tzv. elementárního náboje. Spolu s hodnotou e/m pak bylo možné usoudit na hmotnost elektronu. J. J. Thompson je pokládán za objevitele první elementární částice, elektronu. Spolu s Millikanem určili základní vlastnosti této částice – náboj a hmotnost. Robert Millikan 1868 - 1953

Měření e/m B R e- U

Měření e/m

Millikanův experiment Olejové kapičky Nabité desky Fg Fe

Millikanův experiment

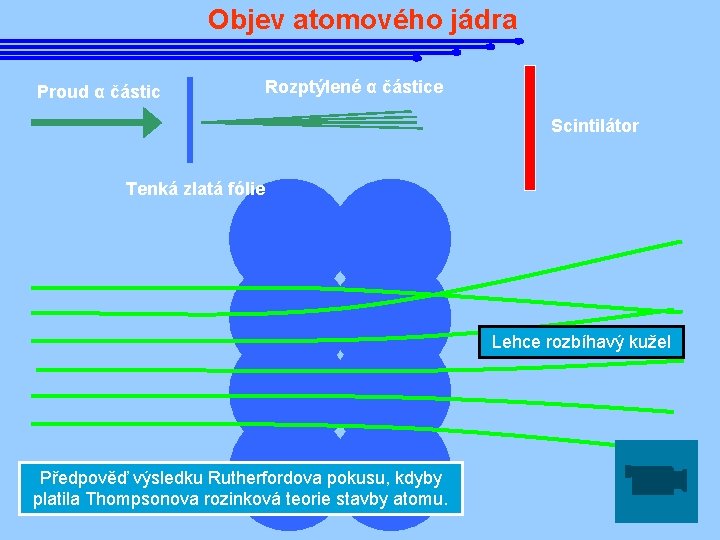
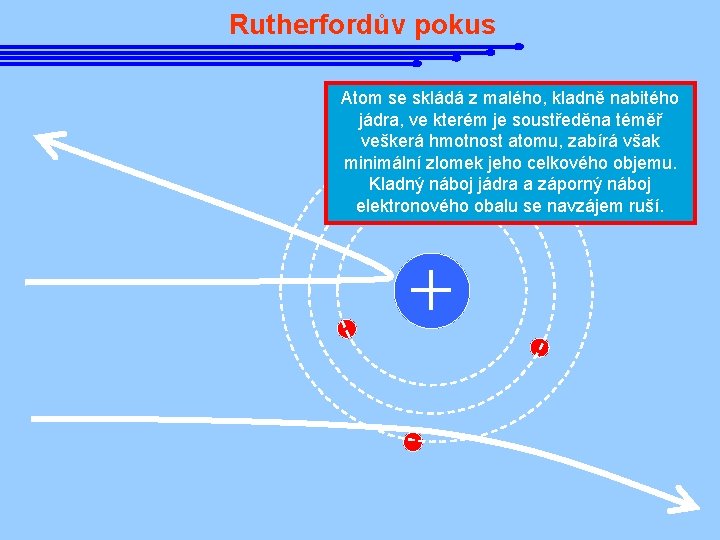
Objev atomového jádra Poznatek, že elektrony vyletují z atomů vyvrátil odvěkou představu o nedělitelnosti a nastolil otázku jejich struktury. J. J. Thompson se domníval, že kladný náboj je rovnoměrně rozložen v celém objemu atomu a elektrony v něm vězí jako rozinky v pudingu. e- Ernest Rutherford 1871 - 1937 e- e- e. Tuto hypotézu vyvrátili roku 1911 E. Rutherford a jeho spolupracovníci ve slavném experimentu rozptylu záření α na tenké zlaté fólii. e- e-

Rutherfordův experiment - aninace Rutherford - animace

Objev atomového jádra Proud α částic Rozptýlené α částice Scintilátor Tenká zlatá fólie Lehce rozbíhavý kužel Předpověď výsledku Rutherfordova pokusu, kdyby platila Thompsonova rozinková teorie stavby atomu.

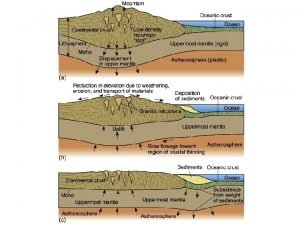
Rutherfordův pokus Atom se skládá z malého, kladně nabitého jádra, ve kterém je soustředěna téměř veškerá hmotnost atomu, zabírá však minimální zlomek jeho celkového objemu. Kladný náboj jádra a záporný náboj elektronového obalu se navzájem ruší.

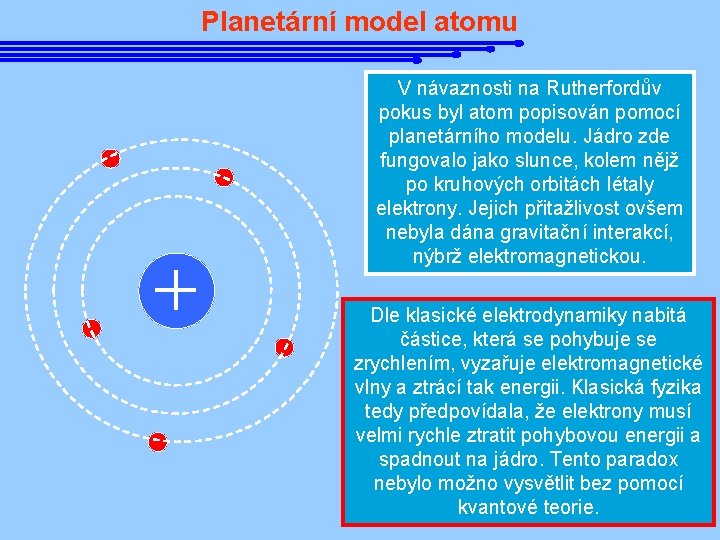
Planetární model atomu V návaznosti na Rutherfordův pokus byl atom popisován pomocí planetárního modelu. Jádro zde fungovalo jako slunce, kolem nějž po kruhových orbitách létaly elektrony. Jejich přitažlivost ovšem nebyla dána gravitační interakcí, nýbrž elektromagnetickou. Dle klasické elektrodynamiky nabitá částice, která se pohybuje se zrychlením, vyzařuje elektromagnetické vlny a ztrácí tak energii. Klasická fyzika tedy předpovídala, že elektrony musí velmi rychle ztratit pohybovou energii a spadnout na jádro. Tento paradox nebylo možno vysvětlit bez pomocí kvantové teorie.

Hlavní nedostatky Rutherfordova modelu atomu

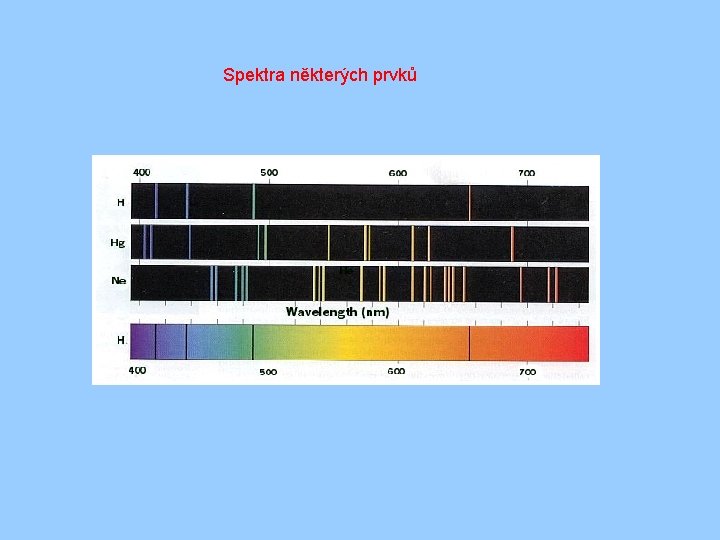
Spektrum záření atomů Spektra atomů - emisní, absorpční § § 1802 – William Wollaston – tmavé čáry ve slunečním spektru 1814 – Joseph Fraunhofer – detailní popis „Fraunhoferových čar“ 1859 – Kirchhoff, Bunsen – čáry odpovídají čarám v absorpčním spektru prvků 1885 – Johann Balmer – studium emisních spekter – hlavně vodíku

Spektra některých prvků

Balmer zjistil, že pro vlnové délky čar ve spektru vodíku platí empirický vztah nebo pro frekvenci Rf = 3, 29. 1015 Hz

Bohrův model atomu - 1913 Niels Bohr 1885 - 1962


Poloměr Bohrovy dráhy není libovolný, ale musí splnit podmínku 2. π. r = = n. λ

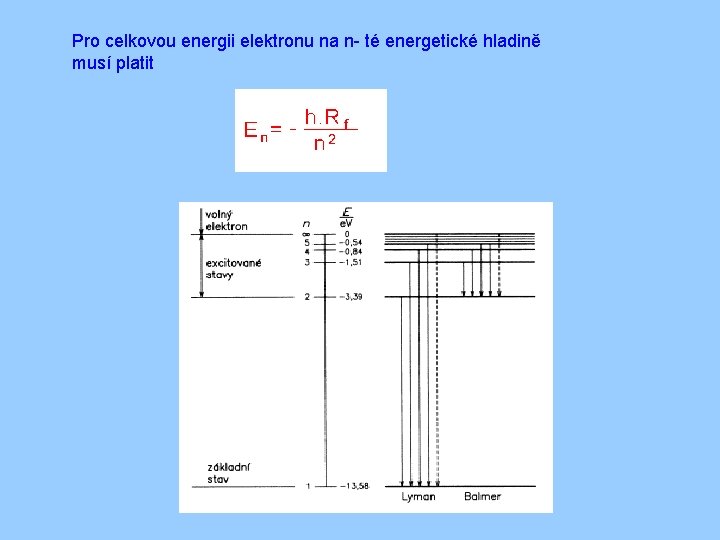
Pro celkovou energii elektronu na n- té energetické hladině musí platit

Bohrův model atomu Další zajímavosti najdete zde Kvantový model atomu - animace

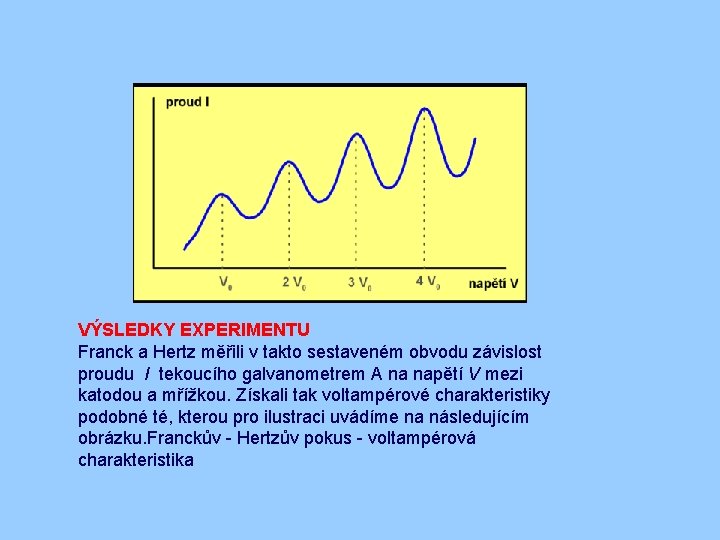
FRANCKŮV - HERTZŮV POKUS ANIMACE Triodu T plnili Franck a Hertz parami různých prvků. Ze žhavené katody K vystupují elektrony a jsou unášeny elektrickým polem ke kladně nabité mřížce M. Potenciálový rozdíl mezi katodou a mřížkou označme symbolem V. Na své cestě se elektrony srážejí s atomy par vyplňujících vnitřní prostor triody, přičemž tyto srážky mohou být jak pružné, tak i nepružné. Slabé brzdicí napětí mezi mřížkou a anodou dále způsobí, že jen elektrony s jistou minimální kinetickou energií dopadnou na anodu a přispějí k proudu tekoucímu galvanometrem A. Elektrony s menší kinetickou energií ke katodě nedospějí a jsou odvedeny mřížkovou větví obvodu.

VÝSLEDKY EXPERIMENTU Franck a Hertz měřili v takto sestaveném obvodu závislost proudu I tekoucího galvanometrem A na napětí V mezi katodou a mřížkou. Získali tak voltampérové charakteristiky podobné té, kterou pro ilustraci uvádíme na následujícím obrázku. Franckův - Hertzův pokus - voltampérová charakteristika


Hlavní kvantové číslo n -Udává celkovou energii elektronu v daném kvantovém stavu -pro atom vodíku = -13, 6 e. V -n = 1, 2, 3, 4, ………… celá čísla - energie elektronu se mění nespojitě - skokem

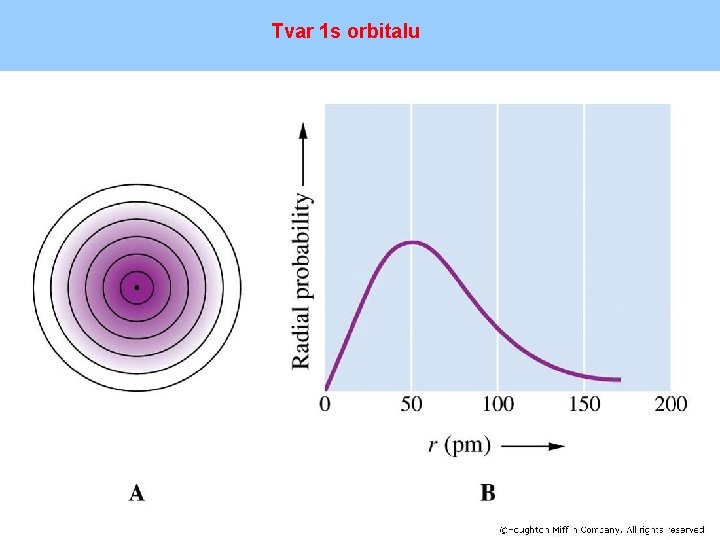
Vedlejší kvantové číslo l -hodnota l určuje dovolené hodnoty velikosti orbitálního momentu hybnosti - nabývá hodnot 0, 1, 2, 3, ……(n-1) - l = 0, 1, 2, 3, 4, … se běžně nahrazují symboly s, p, d, f, g, . . . -udává tvar orbitalu

Magnetické kvantové číslo m - souvisí s kvantováním magnetického momentu elektronu - nabývá hodnot -l …… 0, ……+l celá čísla - udává prostorovou orientaci orbitalu Spinové kvantové číslo s (ms) -souvisí s vlastním momentem hybnosti elektronu -nabývá hodnot +1/2 - 1/2

Pauliho vylučovací princip - žádné dva elektrony v atomu nemohou mít stejná všechna kvantová čísla - v jednom kvantovém stavu (určeném čísly n, l, m) se mohou nacházet maximálně 2 elektrony

Povolené kvantové stavy

Tvar 1 s orbitalu

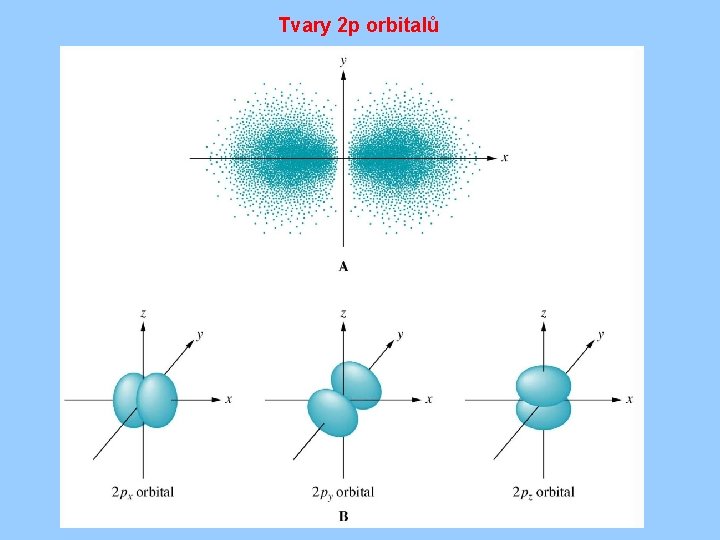
Tvary 2 p orbitalů

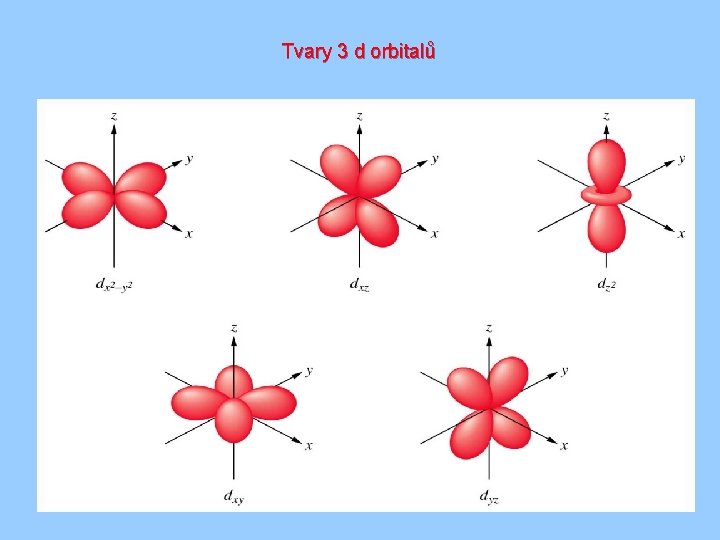
Tvary 3 d orbitalů

Kvantový model atomu - animace
 Mol nasıl bulunur
Mol nasıl bulunur Tektomik
Tektomik Proč se nejprve vystupuje a teprve poté nastupuje
Proč se nejprve vystupuje a teprve poté nastupuje Poq model
Poq model Stacionarity
Stacionarity Modely sociální politiky
Modely sociální politiky Argentiho model
Argentiho model Sweezyho model oligopolu
Sweezyho model oligopolu Modely riadenia ľudských zdrojov
Modely riadenia ľudských zdrojov Plodolist
Plodolist Modely oligopolu
Modely oligopolu Vzorce halogenidov
Vzorce halogenidov Adriana chemick
Adriana chemick Adriana chemick
Adriana chemick Oxokyseliny
Oxokyseliny Vzorce hydroxidov
Vzorce hydroxidov Adriana chemick
Adriana chemick Degenerované orbitaly
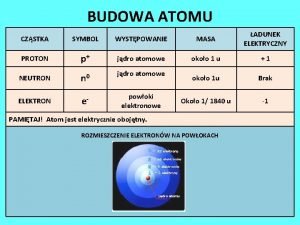
Degenerované orbitaly Budowa atomu
Budowa atomu Serbest yarı asetal hidroksili nedir
Serbest yarı asetal hidroksili nedir Stavba atomu pracovní list
Stavba atomu pracovní list Stavba atomu
Stavba atomu Metoda značených atomů
Metoda značených atomů Promocja elektronowa
Promocja elektronowa Výpočet relativní atomové hmotnosti
Výpočet relativní atomové hmotnosti Model atomu helia
Model atomu helia Atomu grupu sauc par peptīdsaiti
Atomu grupu sauc par peptīdsaiti Chemia odlew agh
Chemia odlew agh Oblicz mase jednego atomu najlzejszego izotopu magnezu
Oblicz mase jednego atomu najlzejszego izotopu magnezu Promocja elektronowa
Promocja elektronowa Masa atomu wodoru
Masa atomu wodoru Model atomu rutherforda
Model atomu rutherforda Homologu rinda
Homologu rinda Vlnově mechanický model atomu
Vlnově mechanický model atomu Türev karbonhidratlar
Türev karbonhidratlar Stavba atomu prezentace
Stavba atomu prezentace Budowa pierwiastka
Budowa pierwiastka