Kvantov mechanick model atomu Kvantov mechanick model atomu










- Slides: 17

Kvantově mechanický model atomu

Kvantově mechanický model atomu: §Snahou modelu je popsat STAV ELEKTRONU v elektronovém obalu. Tím, jednoduše řečeno, myslíme energii elektronů a jejich místo v elektronovém obalu. §Výskyt a energie elektronu spolu úzce souvisí a jsou určeny čtyřmi KVANTOVÝMI ČÍSLY, s kterými se zde seznámíte. §Předchozí modely bylo možno graficky ztvárnit. Tento model je především MODEL MATEMATICKÝ. Je ale potřeba si uvědomit, že ani sebesložitější model atomu nemůže zcela vystihnout vlastnosti elektronu, jedné ze základních částic hmoty.

Schrödingerova rovnice a hustota pravděpodobnosti: §Stav částice (elektronu v atomu) je popisován pomocí VLNOVÉ FUNKCE ψ. Vlnovou funkci lze získat jako řešení Schrödingerovy rovnice. (Erwin Schrödinger (1887 – 1961) rakouský fyzik) §Vlnová funkce nepatří mezi pozorovatelné veličiny. • K pochopení těchto pojmů je třeba znalostí z vyšší matematiky. §Druhá mocnina absolutní hodnoty vlnové funkce │ψ│2 je rovna HUSTOTĚ PRAVDĚPODOBNOSTI výskytu elektronů. • Tento pojem blíže vysvětlíme na atomu vodíku. Kvantově mechanický model atomu tedy začneme popisem atomu vodíku. PROČ? Je nejjednodušší. V elektronovém obalu se vyskytuje pouze 1 elektron. Jeho stav není ovlivňován dalšími elektrony, jak je tomu u složitějších atomů.

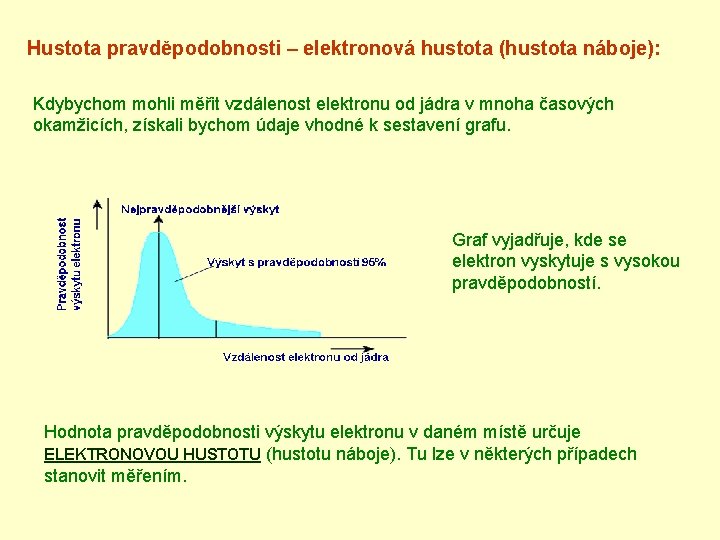
Hustota pravděpodobnosti – elektronová hustota (hustota náboje): Kdybychom mohli měřit vzdálenost elektronu od jádra v mnoha časových okamžicích, získali bychom údaje vhodné k sestavení grafu. Graf vyjadřuje, kde se elektron vyskytuje s vysokou pravděpodobností. Hodnota pravděpodobnosti výskytu elektronu v daném místě určuje ELEKTRONOVOU HUSTOTU (hustotu náboje). Tu lze v některých případech stanovit měřením.

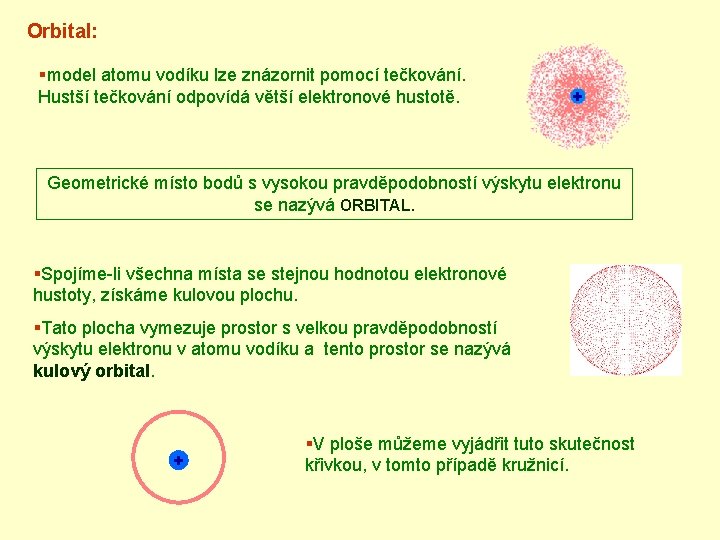
Orbital: §model atomu vodíku lze znázornit pomocí tečkování. Hustší tečkování odpovídá větší elektronové hustotě. Geometrické místo bodů s vysokou pravděpodobností výskytu elektronu se nazývá ORBITAL. §Spojíme-li všechna místa se stejnou hodnotou elektronové hustoty, získáme kulovou plochu. §Tato plocha vymezuje prostor s velkou pravděpodobností výskytu elektronu v atomu vodíku a tento prostor se nazývá kulový orbital. + §V ploše můžeme vyjádřit tuto skutečnost křivkou, v tomto případě kružnicí.

Hlavní kvantové číslo: Energie elektronu v atomu vodíku je závislá pouze na čísle n, které nazýváme HLAVNÍ KVANTOVÉ ČÍSLO. Kvantová čísla se získají jako řešení Schrödingerovy rovnice. Z Stav s nejnižší energií, který je stavem ZÁKLADNÍM, je určen hlavním kvantovým číslem n = 1. y X Právě pro tuto hodnotu n také získáváme kulový orbital. Pro n větší než 1 je atom vodíku ve VZBUZENÉM (excitovaném) stavu.

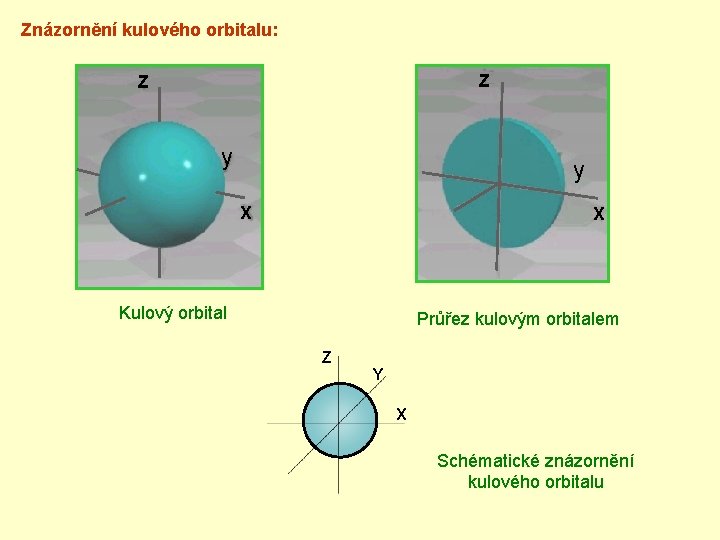
Znázornění kulového orbitalu: Z Z y y X X Kulový orbital Průřez kulovým orbitalem Z Y X Schématické znázornění kulového orbitalu

Vedlejší kvantové číslo: §Pokud bude n vyšší než 1 může mít orbital i jiný než kulový tvar. Například: • Ke stavu s určitou energií, danou hlavním kvantovým číslem n, přísluší vždy určitý počet atomových orbitalů. • To znamená, že znalost n nám pro určení orbitalu nestačí. Proto bylo zavedeno VEDLEJŠÍ KVANTOVÉ ČÍSLO l, které určuje tvar atomového orbitalu. §Toto vedlejší kvantové číslo má zásadní význam pro třídění stavů atomů s větším počtem elektronů, než má atom vodíku.

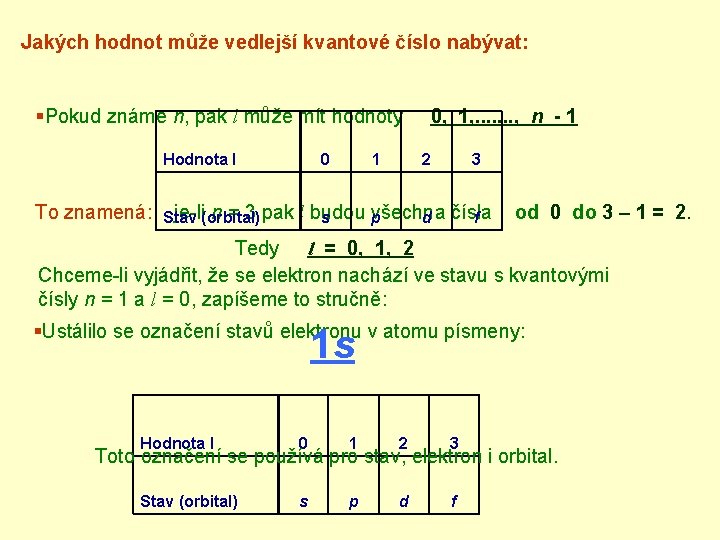
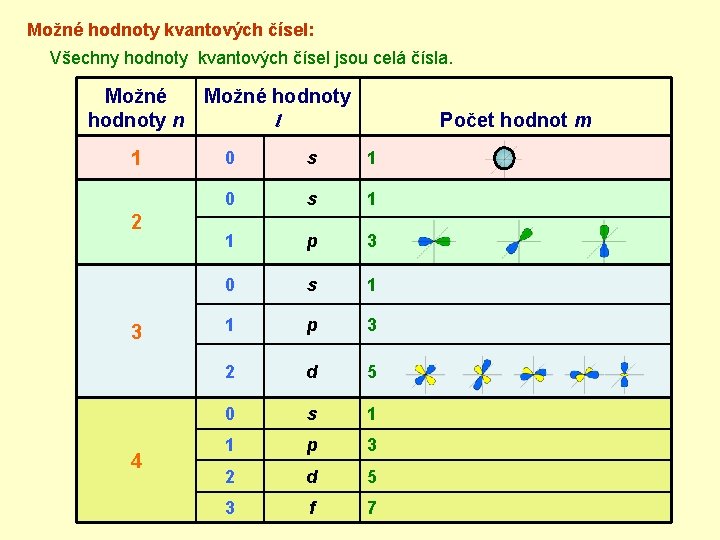
Jakých hodnot může vedlejší kvantové číslo nabývat: §Pokud známe n, pak l může mít hodnoty Hodnota l To znamená: je-li n = 3 pak Stav (orbital) 0 1 0, 1, . . . . , n - 1 2 3 l budou všechna s p d čísla f od 0 do 3 – 1 = 2. Tedy l = 0, 1, 2 Chceme-li vyjádřit, že se elektron nachází ve stavu s kvantovými čísly n = 1 a l = 0, zapíšeme to stručně: §Ustálilo se označení stavů elektronu v atomu písmeny: 1 s Hodnota l 0 1 2 3 Stav (orbital) s p d f Toto označení se používá pro stav, elektron i orbital.

Řešení úlohy: Úloha: Určete všechny možnél = 0, . . . , n - 1 hodnoty l pro stavy s n = 1, 2, 3, 4 (vyplňte tabulku): n 1 l označení písmenem 0 s 2 0, 1 s, p 3 0, 1, 2 s, p, d 4 0, 1, 2, 3 s, p, d, f

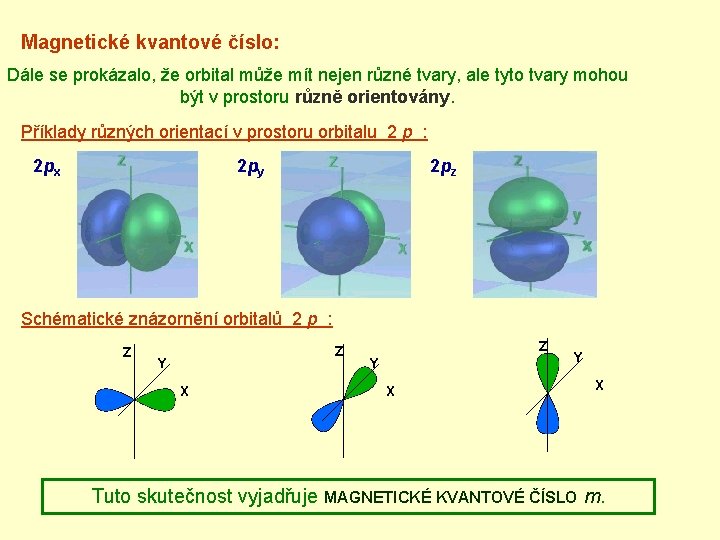
Magnetické kvantové číslo: Dále se prokázalo, že orbital může mít nejen různé tvary, ale tyto tvary mohou být v prostoru různě orientovány. Příklady různých orientací v prostoru orbitalu 2 p : 2 py 2 px 2 pz Schématické znázornění orbitalů 2 p : Z Z Y X Y X Tuto skutečnost vyjadřuje MAGNETICKÉ KVANTOVÉ ČÍSLO m.

Prostorové uspořádání 3 d orbitalů: Schematické znázornění 3 d orbitalů: Z Z X Y X Y

Jakých hodnot může magnetické kvantové číslo nabývat: §Pokud známe l, pak m může mít hodnoty 0, ± 1, ± 2, . . . . , ±l. §To znamená m = –l, . . . , -2, -1, 0, 1, 2, . . . , l. l hodnot 1 hodnota l hodnot Dohromady: 2 l +1 hodnot magnetického čísla §Příklad pro orbital p: (neboli pro l = 1) 2. l + 1 = 2. 1 + 1 = 3 Tedy m bude nabývat tří hodnot a to od –l do l. m = -1, 0, 1

Řešení úlohy: Úloha: Kolik hodnot m přichází v úvahu pro l = 0, 1, 2, 3? (vyplňte tabulku): Počet hodnot čísla m je : 2. l + 1 hodnota l označení písmenem 0 s 1 1 p 3 2 d 5 3 f 7 počet hodnot m

Příklady prostorových uspořádání odpovídajících počtu hodnot m: hodnota l označení písmenem 0 s počet hodnot m 1 1 p 3 2 d 5

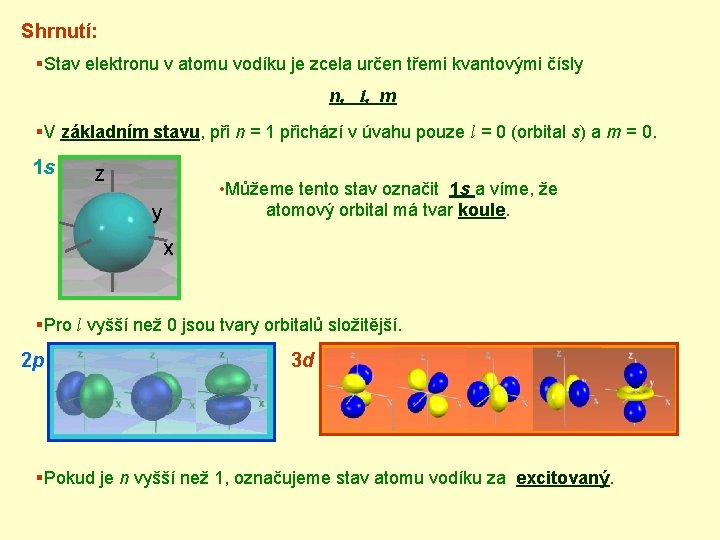
Shrnutí: §Stav elektronu v atomu vodíku je zcela určen třemi kvantovými čísly n, l, m §V základním stavu, při n = 1 přichází v úvahu pouze l = 0 (orbital s) a m = 0. 1 s Z • Můžeme tento stav označit 1 s a víme, že atomový orbital má tvar koule. y X §Pro l vyšší než 0 jsou tvary orbitalů složitější. 2 p 3 d §Pokud je n vyšší než 1, označujeme stav atomu vodíku za excitovaný.

Možné hodnoty kvantových čísel: Všechny hodnoty kvantových čísel jsou celá čísla. Možné hodnoty n 1 2 3 4 Možné hodnoty l Počet hodnot m 0 s 1 1 p 3 2 d 5 3 f 7