LIN KT ION Thuyt tnh in v lin
















![Độ phân cực của các cation Ion Li+ Na+ K+ Rb+ Cs+ R [Å3] Độ phân cực của các cation Ion Li+ Na+ K+ Rb+ Cs+ R [Å3]](https://slidetodoc.com/presentation_image_h/c132831a6a4ebba03f331877fcb19e96/image-25.jpg)
![Độ phân cực của các anion Ion R [Å] F- Cl- Br- I- 1, Độ phân cực của các anion Ion R [Å] F- Cl- Br- I- 1,](https://slidetodoc.com/presentation_image_h/c132831a6a4ebba03f331877fcb19e96/image-26.jpg)














- Slides: 52

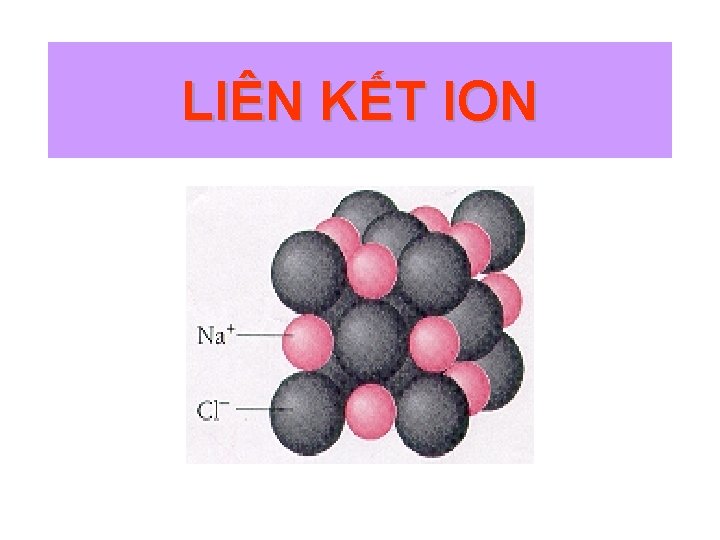
LIÊN KẾT ION

Thuyết tĩnh điện về liên kết ion Tương tác hóa học xảy ra gồm hai giai đoạn: ü Nguyên tử truyền electron cho nhau tạo thành ion ü Các ion trái dấu hút nhau theo lực hút tĩnh điện Na + Cl 2 s 22 p 63 s 1 3 s 23 p 5 Na+ 2 s 22 p 6 + Cl– 3 s 23 p 6 Na. Cl


Một số cơ cấu bền của ion • • ns 2 np 6 F- , Cl- , O 2 - , Na+ , Mg 2+, Al 3+ ns 2 np 6 nd 10 Ag+ , Cu+ , Zn 2+ (n-1)s 2 (n-1)p 6 (n-1)d 10 ns 2 Pb 2+, Bi 3+, Tl+. . (n-1)d 5 Fe 3+

Khả năng tạo liên kết ion của các nguyên tố ØKhả năng tạo lk ion phụ thuộc vào khả năng tạo ion của các ngtố: üCác ngtố có I ↓ → dễ tạo cation (IA, IIA ) üCác ngtố có F mạnh → dễ tạo anion (F- , Cl-, Cl. O 4 -, NO 3 - , SO 42 -) Ø χ ↑ → độ ion ↑

Tính chất của liên kết ion ØKhông định hướng ØKhông bão hòa ØPhân cực rất mạnh

Mạng tinh thể ion v Nguyên tắc sắp xếp các ion đặc khít nhất • Mỗi ion được bao quanh số cực đại các ion trái dấu (số phối trí). • Các ion cùng dấu ở cách xa nhau càng nhiều càng tốt. v Quyết định kiểu cấu trúc tinh thể là

Kiểu lập phương tâm khối số phối trí là 8 Cs. Cl, Cs. Br, Cs. I Kiểu lập phương tâm diện Số phối trí là 6 Na. Cl, Cs. F, Mg. O Kiểu Zn. S – kiểu blende kẽm- Wutzite Số phối trí là 4 Be. O, Zn. O, Ag. I


Năng lượng mạng tinh thể ion MX (tinh thể ion ) →M+(khí) + X- (khí) H=UMX Công thức Kapustinski (lk ion thuần túy) Khi lk có phần cộng hóa trị tương đối lớn thì công thức này không còn chính xác.

Năng lượng mạng tinh thể ↓ Độ bền mạng tinh thể Khả năng hòa tan Nhiệt độ sôi Nhiệt độ nóng chảy

Năng lượng mạng tinh thể Độ bền mạng tinh thể Khả năng hòa tan Nhiệt độ sôi Nhiệt độ nóng chảy

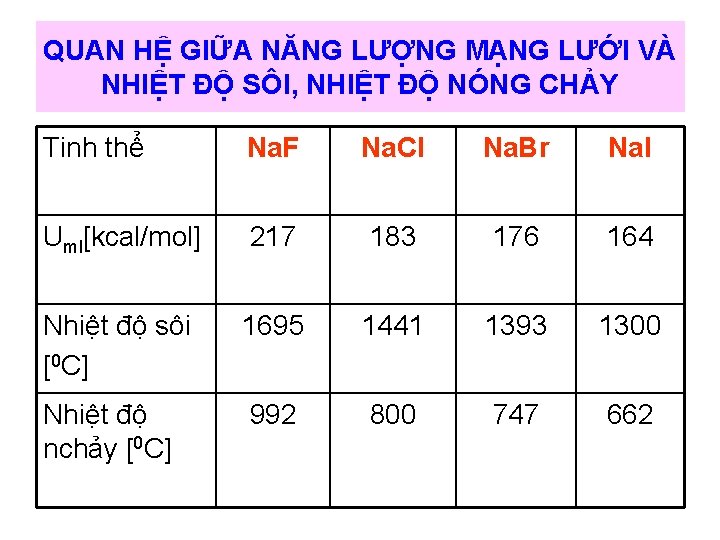
QUAN HỆ GIỮA NĂNG LƯỢNG MẠNG LƯỚI VÀ NHIỆT ĐỘ SÔI, NHIỆT ĐỘ NÓNG CHẢY Tinh thể Na. F Na. Cl Na. Br Na. I Uml[kcal/mol] 217 183 176 164 Nhiệt độ sôi [0 C] 1695 1441 1393 1300 Nhiệt độ nchảy [0 C] 992 800 747 662

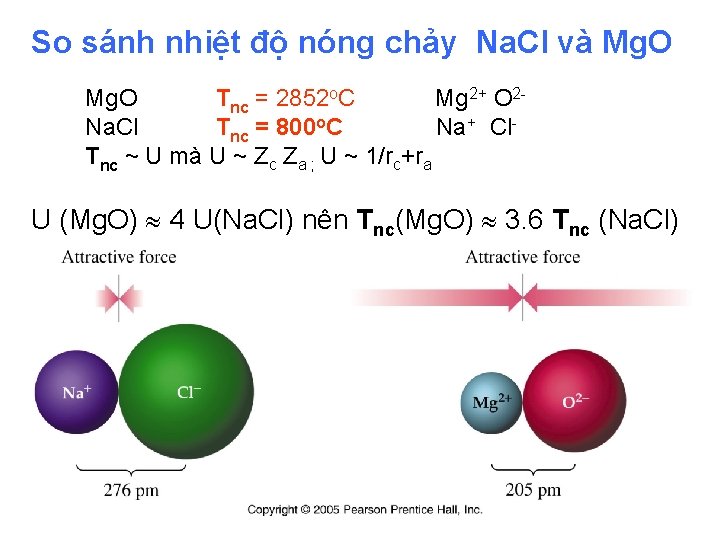
So sánh nhiệt độ nóng chảy Na. Cl và Mg. O Tnc = 2852 o. C Mg 2+ O 2 Na. Cl Tnc = 800 o. C Na+ Cl Tnc ~ U mà U ~ Zc Za ; U ~ 1/rc+ra U (Mg. O) 4 U(Na. Cl) nên T nc(Mg. O) 3. 6 Tnc (Na. Cl)

Đặc điểm của hợp chất ion • Tính dẫn điện kém ở trạng thái rắn nhưng dẫn điện tốt ở trạng thái nóng chảy hay dung dịch. • Nhiệt độ nóng chảy, nhiệt độ sôi khá cao • Tinh thể rắn, giòn. • Dễ tan trong các dung môi phân cực (H 2 O).

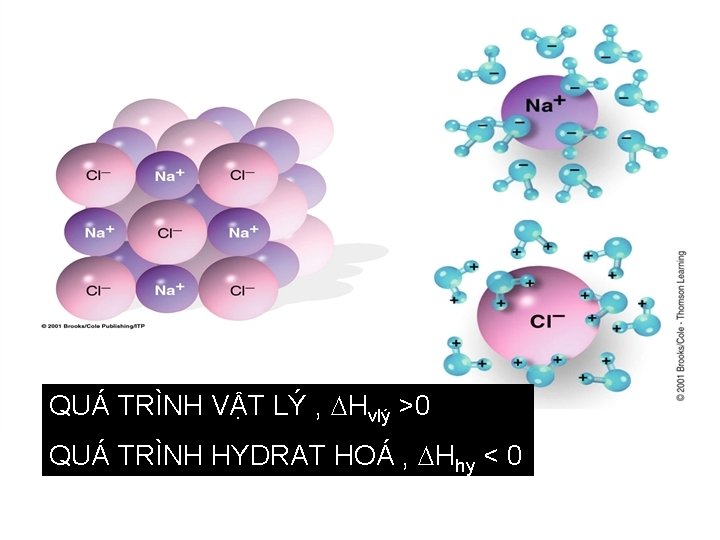
Quá trình hòa tan các chất tinh thể ion trong dm phân cực MX(rắn) +(n+m) H 2 O „ M+. n. H 2 O + X-. m. H 2 O Hhòa tan = Hvlý + Hsol Hvlý >0 Hvlý UMX Hsol <0

QUÁ TRÌNH VẬT LÝ , Hvlý >0 QUÁ TRÌNH HYDRAT HOÁ , Hhy < 0

QUAN HỆ GIỮA NĂNG LƯỢNG MẠNG LƯỚI NĂNG LƯỢNG HYDRAT HOÁ VÀ ĐỘ TAN Tinh thể Li. F Na. F KF Rb. F Cs. F Uml[kcal/mol] 243, 6 213, 0 189, 0 180, 6 171, 6 Uhy[kcal/mol] -245, 2 -217, 8 -192, 7 -186, 9 Độ tan [g/100 g] 0, 26 4, 22 48, 0 Dễ tan

Sự phân cực ion Ø Khái niệm về sự phân cực ion Ø Các yếu tố ảnh hưởng đến sự phân cực ion Ø Ảnh hưởng của sự phân cực ion đến tính chất các hợp chất

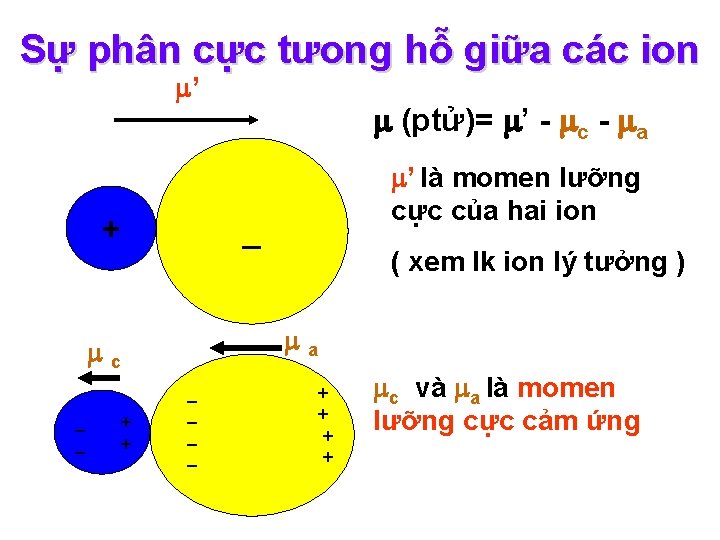
Sự phân cực tưong hỗ giữa các ion ’ + c (ptử)= ’ - c - a _ ’ là momen lưỡng cực của hai ion ( xem lk ion lý tưởng ) a c và a là momen _ + _ + lưỡng cực cảm ứng _ + _ + _ +

Momen lưỡng cực cảm ứng = . E → a = a. Ec >> c = c. Ea - độ phân cực, r 3 → a >> c E – cường độ điện trường của ion gây phân cực. → cation có tác dụng gây phân cực mạnh hơn anion Qúa trình phân cực ion có tính chất một chiều cation gây phân cực anion

sự phân cực ion làm cho đám mây điện tử của cation và anion che phủ nhau một phần nên lk ion bao giờ cũng mang một phần tính cộng hóa trị. → Không có lk ion 100%. + _

CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN SỰ PH N CỰC ION • Độ phân cực • Tác dụng gây phân cực của cation

Các yếu tố ảnh hưởng đến độ phân cực • Bán kính ion càng lớn → tăng F - < Cl - < Br - < I- tăng • Các ion đẳng electron có điện tích càng nhỏ (càng âm) thì tăng. Mg 2+ < Na+ < Ne < F- < O 2 - tăng • Cấu hình electron hóa trị ns 2 np 6 < ns 2 np 6 nd 1→ 9 < ns 2 np 6 nd 10 tăng
![Độ phân cực của các cation Ion Li Na K Rb Cs R Å3 Độ phân cực của các cation Ion Li+ Na+ K+ Rb+ Cs+ R [Å3]](https://slidetodoc.com/presentation_image_h/c132831a6a4ebba03f331877fcb19e96/image-25.jpg)
Độ phân cực của các cation Ion Li+ Na+ K+ Rb+ Cs+ R [Å3] 0, 68 0, 97 1, 33 1, 47 1, 67 [Å3] 0, 029 0, 187 0, 888 1, 499 2, 570 Ion Be 2+ Mg 2+ Ca 2+ Sr 2+ Ba 2+ R [Å] 0, 35 0, 66 0, 99 1, 20 1, 34 [Å3] 0, 008 0, 103 0, 552 1, 020 1, 860
![Độ phân cực của các anion Ion R Å F Cl Br I 1 Độ phân cực của các anion Ion R [Å] F- Cl- Br- I- 1,](https://slidetodoc.com/presentation_image_h/c132831a6a4ebba03f331877fcb19e96/image-26.jpg)
Độ phân cực của các anion Ion R [Å] F- Cl- Br- I- 1, 33 1, 81 1, 96 2, 20 [Å3] 0, 96 3, 57 4, 99 7, 57 Ion O 2 - Se 2 - Te 2 - R [Å] 1, 32 1, 74 1, 91 2, 11 [Å3] 2, 74 8, 94 11, 45 16, 10

Tính cộng hóa trị tăng dần

Các yếu tố ảnh hưởng đến tác dụng phân cực của cation • Thế cation (qui tắc. Fajan) • Cấu hình electron hóa trị ns 2 np 6 < ns 2 np 6 nd 1→ 9 < 18 e+ ns 2< ion kiểu He < ns 2 np 6 nd 10 (các ion có cùng điện tích, bán kính tương đương )

Tính cộng hóa trị tăng dần

Ảnh hưởng của sự phân cực ion đến tính chất của các hợp chất ØĐộ điện ly ØĐộ bền nhiệt ØNhiệt độ sôi và nhiệt độ nóng chảy ØĐộ tan

Độ điện ly Sự phân cực ion tăng Tính cộng hóa trị tăng Tính ion giảm Độ điện ly giảm

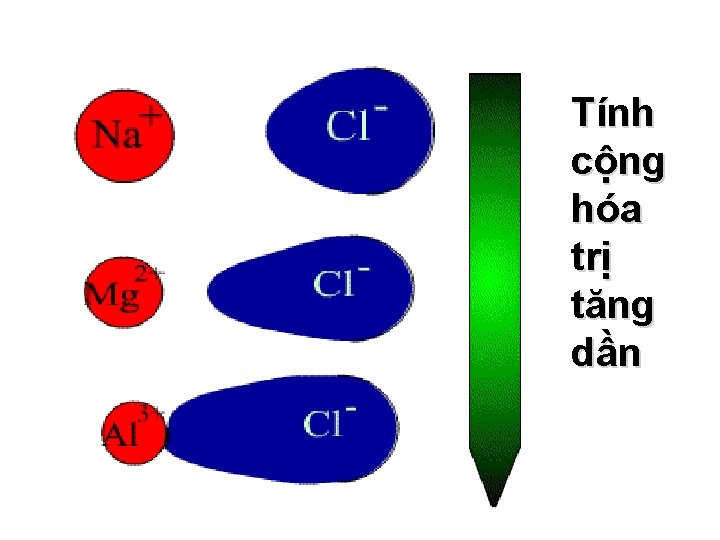
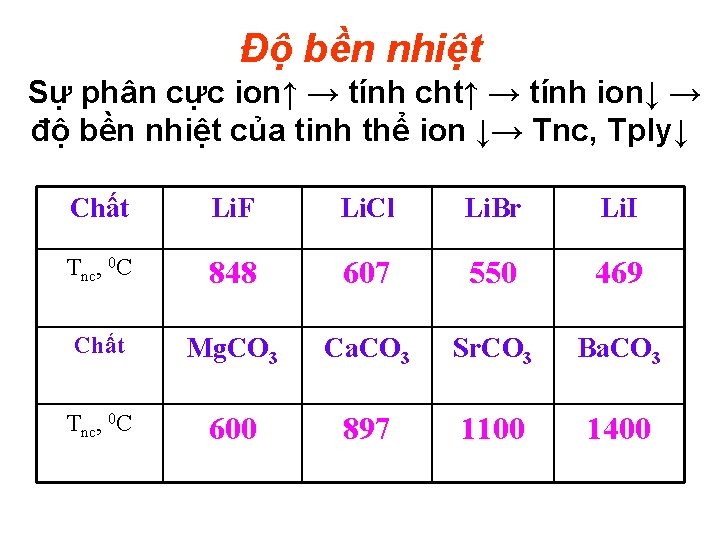
Độ bền nhiệt Sự phân cực ion↑ → tính cht↑ → tính ion↓ → độ bền nhiệt của tinh thể ion ↓→ Tnc, Tply↓ Chất Li. F Li. Cl Li. Br Li. I Tnc, 0 C 848 607 550 469 Chất Mg. CO 3 Ca. CO 3 Sr. CO 3 Ba. CO 3 Tnc, 0 C 600 897 1100 1400

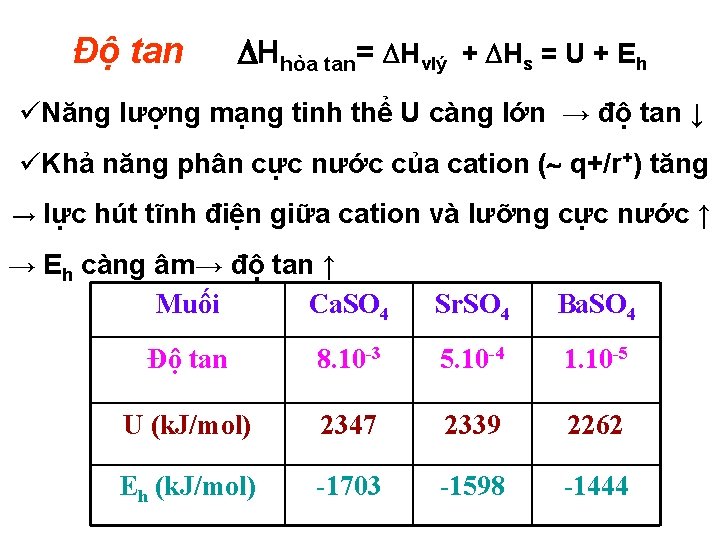
Độ tan Hhòa tan= Hvlý + Hs = U + Eh üNăng lượng mạng tinh thể U càng lớn → độ tan ↓ üKhả năng phân cực nước của cation ( q+/r+) tăng → lực hút tĩnh điện giữa cation và lưỡng cực nước ↑ → Eh càng âm→ độ tan ↑ Muối Ca. SO 4 Sr. SO 4 Ba. SO 4 Độ tan 8. 10 -3 5. 10 -4 1. 10 -5 U (k. J/mol) 2347 2339 2262 Eh (k. J/mol) -1703 -1598 -1444

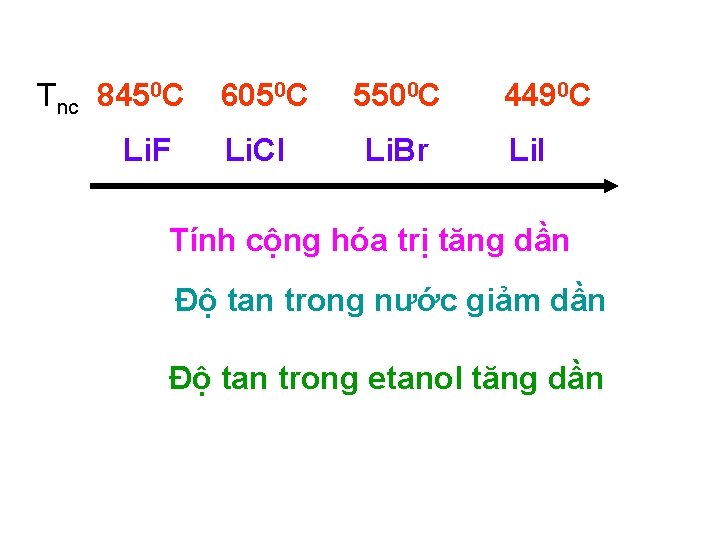
Tnc 8450 C 6050 C 5500 C 4490 C Li. F Li. Cl Li. Br Li. I Tính cộng hóa trị tăng dần Độ tan trong nước giảm dần Độ tan trong etanol tăng dần

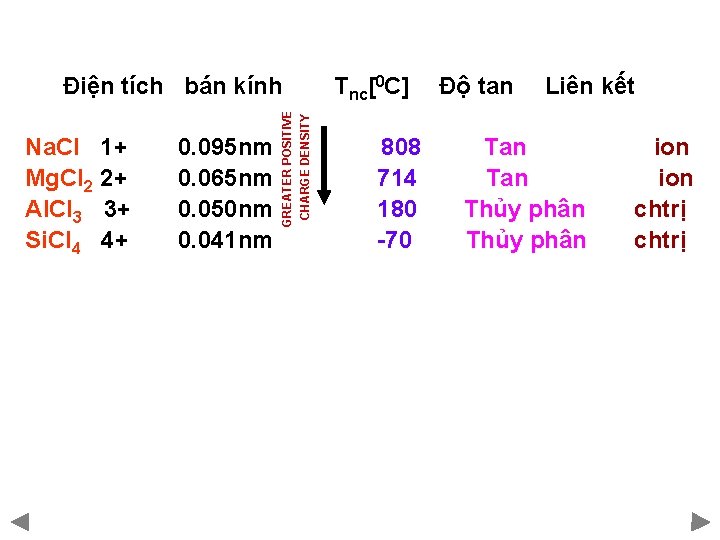
Na. Cl 1+ 0. 095 nm Mg. Cl 2 2+ 0. 065 nm Al. Cl 3 3+ 0. 050 nm Si. Cl 4 4+ 0. 041 nm GREATER POSITIVE CHARGE DENSITY Điện tích bán kính Tnc[0 C] Độ tan Liên kết 808 Tan ion 714 Tan ion 180 Thủy phân chtrị -70 Thủy phân chtrị

• • • Li. Cl Li. Br Li. I r. Cl- 167 pm r. Br- 182 pm r. I- 206 pm Tnc 613 o. C Tnc 547 o. C Tnc 446 o. C

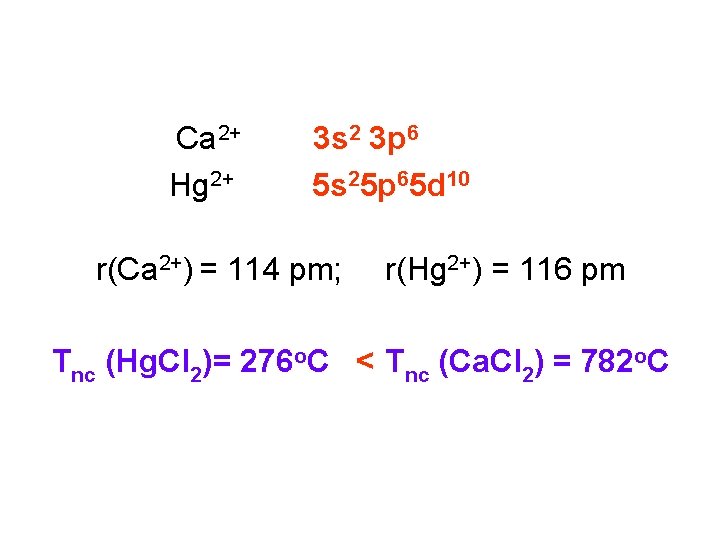
Ca 2+ 3 s 2 3 p 6 Hg 2+ 5 s 25 p 65 d 10 r(Ca 2+) = 114 pm; r(Hg 2+) = 116 pm Tnc (Hg. Cl 2)= 276 o. C < Tnc (Ca. Cl 2) = 782 o. C

• So Sánh Mg. O and Al 2 O 3 (3+, 2 -) Mg. O (2+, 2 -) Tm(Al 2 O 3) = 2054 o. C < Tm (Mg. O) = 2852 o. C

LIÊN KẾT VANDERWAALS Bản chất của lk là tương tác tĩnh điện

Đặc điểm ØLà loại liên kết xuất hiện giữa các phân tử ØCó thể xuất hiện ở những khoảng cách tương đối lớn ØCó năng lượng nhỏ E = 1 ÷ 2 Kcal/mol ØCó tính không chọn lọc và không bão hòa ØCó tính cộng

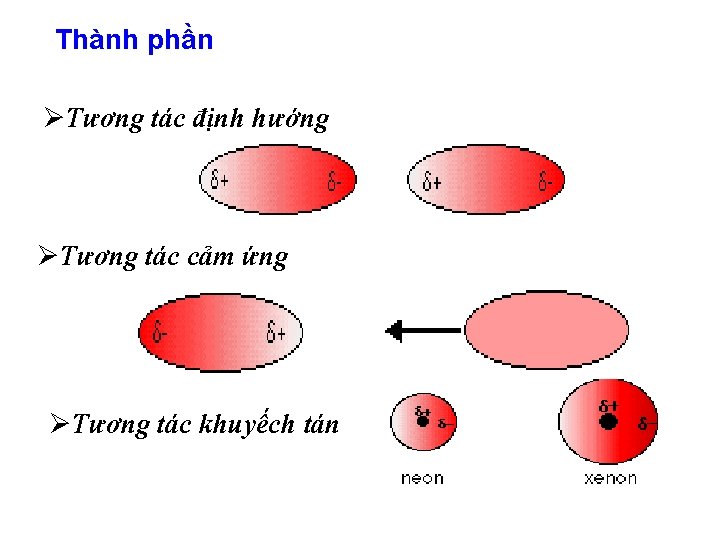
Thành phần ØTương tác định hướng ØTương tác cảm ứng ØTương tác khuyếch tán

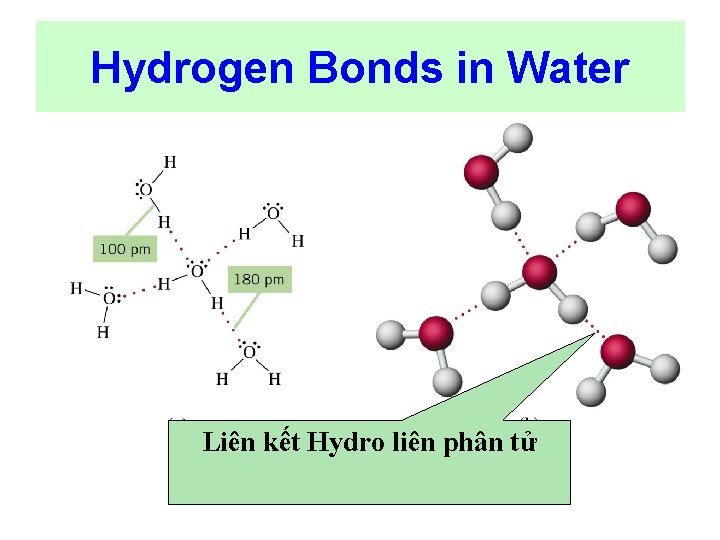
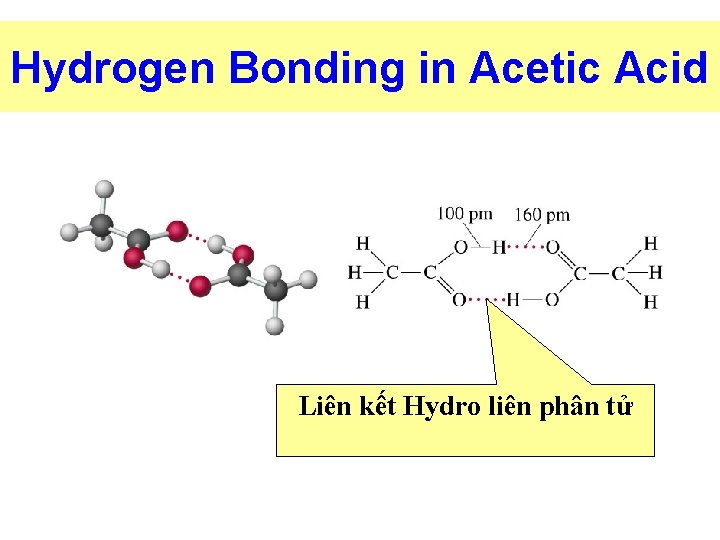
LIÊN KẾT HYDRO Liên kết giữa ng tử H + với ng tử có kích thước nhỏ độ âm điện mạnh như: F, O , N ØLiên kết Hydro liên phân tử. ØLiên kết Hydro nội phân tử

Hydrogen Bonds in Water Liên kết Hydro liên phân tử

Hydrogen Bonding in Acetic Acid Liên kết Hydro liên phân tử

Hydrogen Bonding in Salicylic Acid Liên kết Hydro nội phân tử

Liên kết Hydro thường gặp trong chất lỏng, tinh thể, đôi khi ở trạng thái khí, các hợp chất cao phân tử.


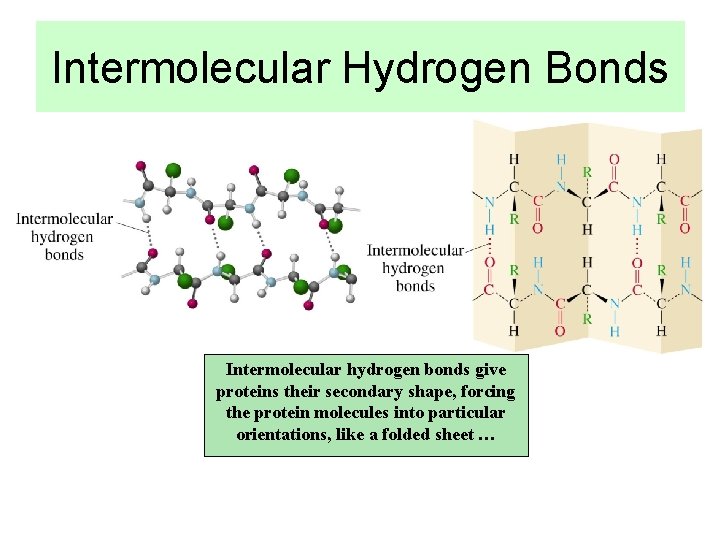
Intermolecular Hydrogen Bonds Intermolecular hydrogen bonds give proteins their secondary shape, forcing the protein molecules into particular orientations, like a folded sheet …

Đặc điểm liên kết Hydro ØLiên kết hydro là loại lk yếu, yếu hơn nhiều so với lk cộng hoá trị nhưng mạnh hơn lk Van der Waals. Ehydro=2÷ 10 Kcal/mol ØLk hydro càng bền khi X và Y có độ âm điện càng lớn, kích thước càng nhỏ. -Y - - H + … X - -

Ảnh hưởng của lk hydro đến tính chất – Tăng nhiệt độ sôi, nhiệt độ nóng chảy của các chất có lk hydro liên phân tử. – Giảm độ acid của dung dịch. – Tăng độ tan khi chất tan tạo lk Hydro với dung môi – Trong sinh học, lk hydro giúp tạo các cấu trúc bậc cao cho glucid, protid…

Liên kết Hydro trong nước đá Liên kết hydro giữa các phân tử nước được sắp xếp tạo nên cấu trúc lục giác mở. cấu trúc xốp của nước đá làm cho nước đá nhẹ hơn nước lỏng.

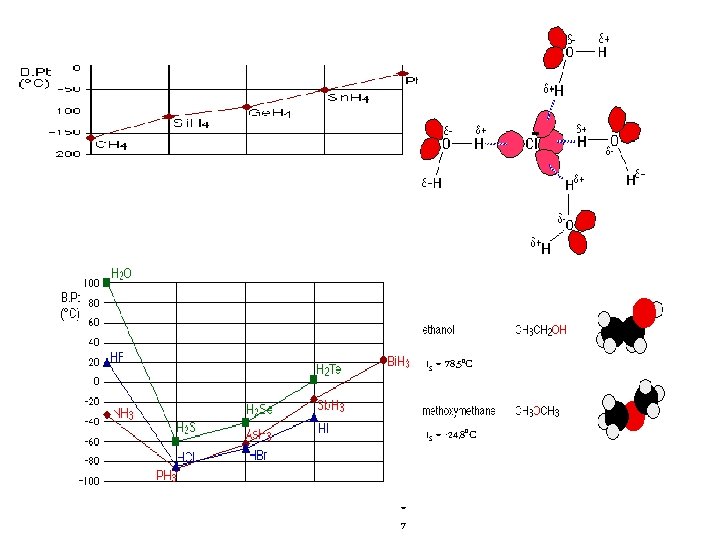
t. S = 78, 50 C t. S = -24, 80 C t S = 7 -
 Intermolecular forces on vapor pressure
Intermolecular forces on vapor pressure C6h12 fuerza intermolecular
C6h12 fuerza intermolecular Fuerzas dipolo dipolo ejemplos
Fuerzas dipolo dipolo ejemplos Que es fuerzas intramoleculares
Que es fuerzas intramoleculares Tnh elearning
Tnh elearning Elearning tnh
Elearning tnh Tnh elearning edu vn
Tnh elearning edu vn Phôn nôi man
Phôn nôi man Kỹ thuật bắn súng tiểu liên ak violet
Kỹ thuật bắn súng tiểu liên ak violet Logo tnh
Logo tnh Tnh elearning
Tnh elearning Tnh elearning
Tnh elearning Tnh elearning
Tnh elearning Tnh elearning
Tnh elearning Tnh elearning
Tnh elearning Trang tnh
Trang tnh Lu xun new year's sacrifice
Lu xun new year's sacrifice Lin donn
Lin donn Meddi munfasil ne demektir
Meddi munfasil ne demektir Chenghua lin
Chenghua lin Xuemin lin
Xuemin lin Weiyang lin
Weiyang lin Kimmy lin
Kimmy lin Ram nam me lin hai dekhat sabme ram
Ram nam me lin hai dekhat sabme ram Chen-hsuan lin
Chen-hsuan lin Lin evola smidt
Lin evola smidt Penforlds
Penforlds Donn lin
Donn lin Field stop vs aperture stop
Field stop vs aperture stop Mary lin elementary
Mary lin elementary Semantic roles
Semantic roles Lin message frame
Lin message frame Lin win ru
Lin win ru Martin donn
Martin donn Cu lin
Cu lin Dr kent lin
Dr kent lin Dr calvin lin
Dr calvin lin Wenqing lin
Wenqing lin Dr vivian lin
Dr vivian lin Dave lin
Dave lin Lin shan lee
Lin shan lee Linprivchecker
Linprivchecker Lin busz
Lin busz Magistrala lin bmw
Magistrala lin bmw Dr lin-fan wang
Dr lin-fan wang Dr karen lin
Dr karen lin Lin da652q
Lin da652q Chen lin finance
Chen lin finance Kevin kelly cmu
Kevin kelly cmu Unlv rebel grad slam
Unlv rebel grad slam V-lin
V-lin Mot lin blinds
Mot lin blinds Lin and dyer
Lin and dyer