Kvantna priroda svjetlosti 14 12 1900 Kvanti energije

















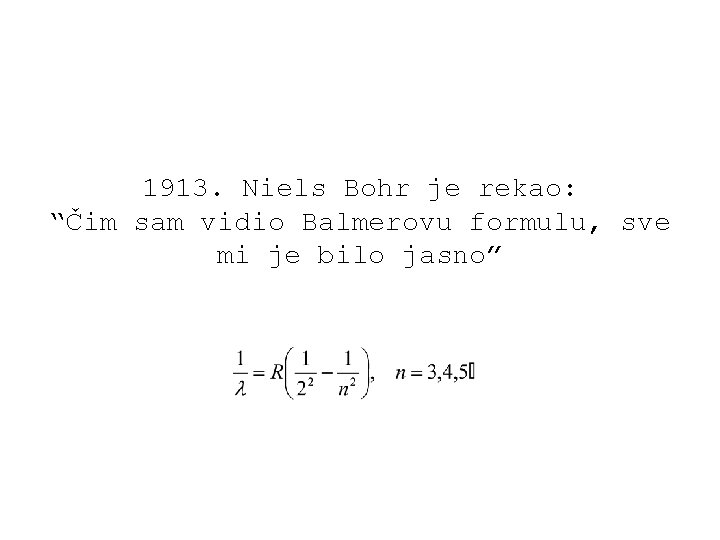
























- Slides: 67

Kvantna priroda svjetlosti

• 14. 12. 1900. Kvanti energije – Max Planck • 1905. Fotoelektrični efekt – Albert Einstein • 1923. Raspršenje fotona na elektronima – A. H. Compton

Problem crnog tijela! Idealno crno tijelo potpuno apsorbira sve upadno zračenje. Idealno crno tijelo ne postoji, ali najbolja aproksimacija je izotermna šupljina s malim otvorom. Kada je izotermna šupljina ugrijana na neku temperaturu T, iz njezina otvora izlazi zračenje kontinuirane raspodjele valnih duljina, od neke minimalne do maksimalne. Krajem pretprošlog stoljeća, nakon što je izmjeren spektar crnog tijela, pokušao se objasniti oblik krivulje spektra za pojedine temperature i dobiti kvantitativna ovisnost energije zračenja o valnoj duljini. Međutim…

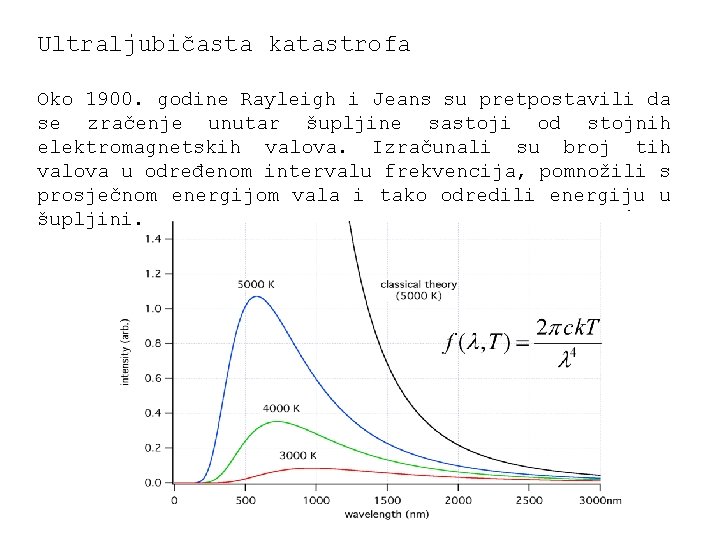
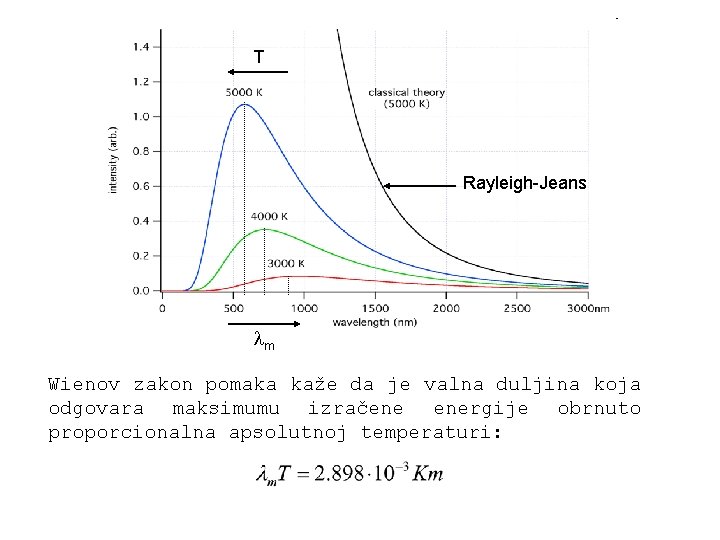
Ultraljubičasta katastrofa Oko 1900. godine Rayleigh i Jeans su pretpostavili da se zračenje unutar šupljine sastoji od stojnih elektromagnetskih valova. Izračunali su broj tih valova u određenom intervalu frekvencija, pomnožili s prosječnom energijom vala i tako odredili energiju u šupljini.

Međutim, nisu svi zakoni klasične fizike bili neuspješni! Stefan-Boltzmannov zakon i Wienov zakon Jožef Štefan (eksperimentalno) i Boltzmann (teorijski) došli do istog rezultatat i odredili izraz za ukupni intenzitet zračenja crnog tijela:

T Rayleigh-Jeans m Wienov zakon pomaka kaže da je valna duljina koja odgovara maksimumu izračene energije obrnuto proporcionalna apsolutnoj temperaturi:

Planckov zakon zračenja za crno tijelo. Kvanti svjetlosti Planckov zakon Važne pretpostavke pri ovom izvodu su da oscilator koji emitira svjetlost može poprimiti samo određene vrijednosti energije, odnosno energija je kvantizirana!!! Oscilator može izračiti cijeli kvant svjetlosti energije, jedan foton čija je energija E=h.

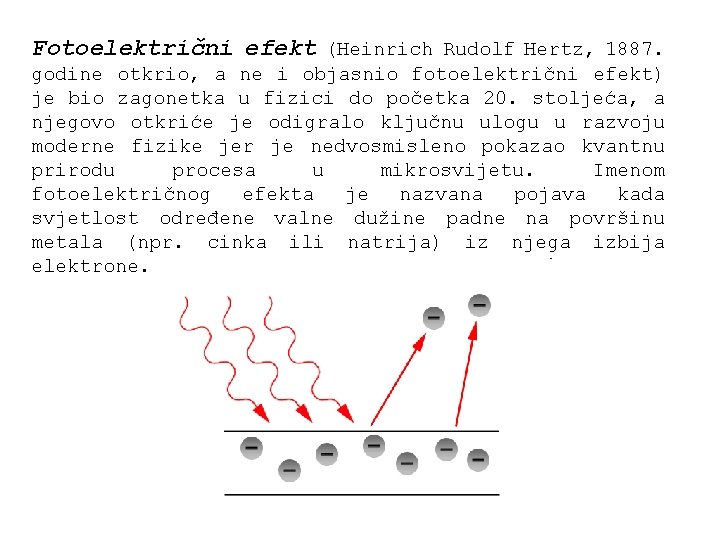
Fotoelektrični efekt (Heinrich Rudolf Hertz, 1887. godine otkrio, a ne i objasnio fotoelektrični efekt) je bio zagonetka u fizici do početka 20. stoljeća, a njegovo otkriće je odigralo ključnu ulogu u razvoju moderne fizike jer je nedvosmisleno pokazao kvantnu prirodu procesa u mikrosvijetu. Imenom fotoelektričnog efekta je nazvana pojava kada svjetlost određene valne dužine padne na površinu metala (npr. cinka ili natrija) iz njega izbija elektrone.

Najvažnija osobina fotoelektričnog efekta je povezana sa ovisnošću fotoelektričnog efekta o valnim dužinama i intenzitetu svjetlosti kojom se osvjetljava metalna ploča: ako je valna dužina manja od neke granice (koja ovisi o vrsti tvari) intenzitet efekta (količina el. naboja koji se pojavljuje na ploči) raste sa povećanjem intenziteta. Međutim, ako valna dužina svjetlosti prelazi tu granicu, fotoelektričnog efekta nestaje, bez obzira koliko intenzivna bila svijetlost. Ovakvo ponašanje nije se moglo objasniti dotadašnjim poznavanjem fizike: teorija o svjetlosti kao valu nije mogla objasniti zašto veća količina energije ne može izazvati fotoelektrični efekt, jer je ta teorija predviđala da iste količine energije moraju imati iste efekte.

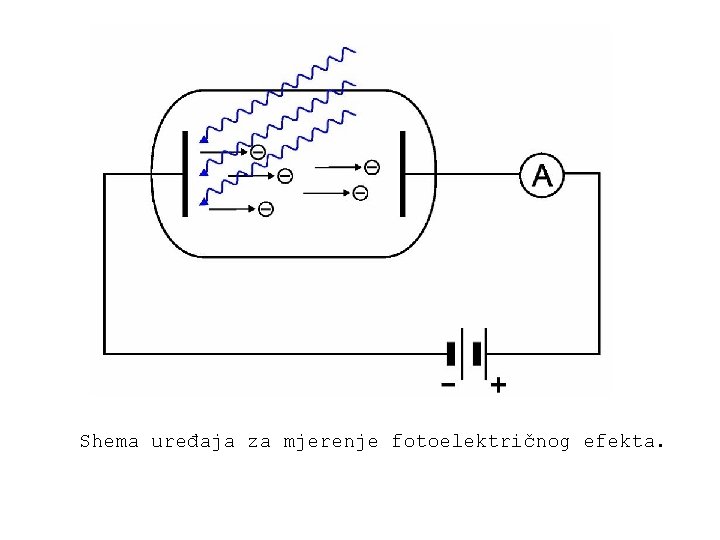
Shema uređaja za mjerenje fotoelektričnog efekta.

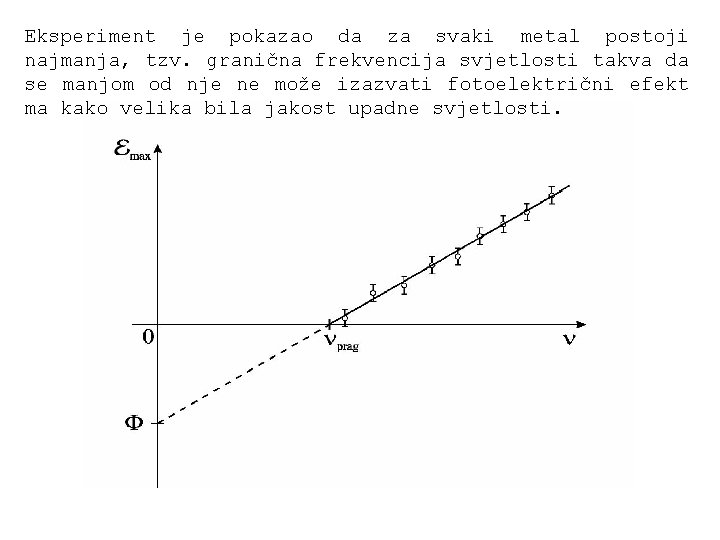
Eksperiment je pokazao da za svaki metal postoji najmanja, tzv. granična frekvencija svjetlosti takva da se manjom od nje ne može izazvati fotoelektrični efekt ma kako velika bila jakost upadne svjetlosti.

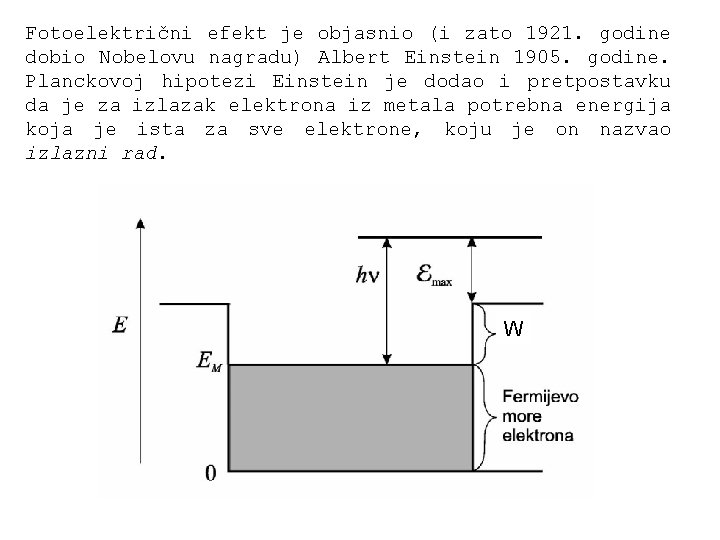
Fotoelektrični efekt je objasnio (i zato 1921. godine dobio Nobelovu nagradu) Albert Einstein 1905. godine. Planckovoj hipotezi Einstein je dodao i pretpostavku da je za izlazak elektrona iz metala potrebna energija koja je ista za sve elektrone, koju je on nazvao izlazni rad. W

Treba dodati da je tome doprinijelo i otkriće da su nosioci električnog naboja u metalu električki negativno nabijeni elektroni. Kombinirajući sva tada moderna znanja i hipoteze Einstein je dao jednadžbu koja opisuje fotoelektrični efekt:

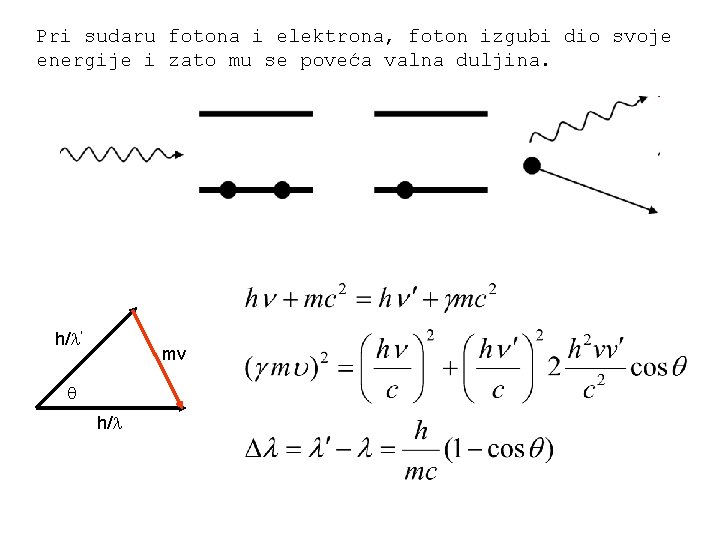
Comptonov efekt Pri raspršenju X-zraka na elektronima u grafitu A. H. Compton opazio je da raspršeno zračenje ima dvije komponente: prva ima valnu duljinu kao upadni snop, a druga malo veću komponentu. Razlika valnih duljina tih dviju komponenti ovisi o kutu raspršenja.

Pri sudaru fotona i elektrona, foton izgubi dio svoje energije i zato mu se poveća valna duljina. h/ ’ mv h/

Kirchhoffov zakon Problem sivog tijela; neka se u posudi čiji zidovi imaju temperaturu T nalazi crno tijelo. Snga koju tijelo predaje posudi u ravnoteži je jednaka nuli te je apsorbirani tok energije jednak emitiranom toku: e = a = u Ako zamjenimo crno tijelo sivim, mijenja se apsorbirani tok: a = (1 - ) u = u Omjer emitiranog toka sivog tijela i crnog tijela pri jednakoj temperaturi zovemo faktorom emisije, . Rekacija za emisionu moć: fst( , T) = fct( , T) Jednakost faktora emisije i faktora apsropcije: ( ) = ( ) zove se Kirchhoffov zakon.

Linijski spektri Atomi razrijeđenih plinova i para metala, pobuđeni električnom strujom ili grijanjem, emitiraju svjetlost sastavljenu od valova određenih valnih duljina. Kažemo da se spektar te svjetlosti sastoji od niza diskretnih spektralnih linija. Najjednostavniji spektar je linijski spektar vodika. Iako se spektar sastoji od mnogo linija u infracrvenom, vidljivom i ultraljubičastom području, one se ipak mogu grupirati u pojedine serije. Prvi je to uočio Johann Balmer, pa se danas linije u vidljivom i ultraljubičastom dijelu spektra zovu njegovim imenom.

Valne duljine se izračunavaju po slijedećim formulama: Lymanova serija: Balmerova serija: Paschenova serija: Brackettova serija:

Klasična fizika ne može objasniti nastanak linijskih spektara atoma; svi pokušaji u tom smislu završili su neuspjehom. Spektre je 1913. objasnio Niels Bohr pomoću kvantne teorije, svojim modelom vodikova atoma.

Modeli atoma. . . • 1897. izmjerena vrijednost e/m za katodne zrake i nađeno da su to negativno nabijene čestice, čija je masa oko 2000 puta manja od najlakšeg atoma, atoma vodika. • 1874. Stoney je došao do zaključka da je minimalni naboj nekog iona oko 10 -19 C. Taj naboj je nazvao elektron. • U to vrijeme je bilo poznato da je promjer atoma oko 10 -10 m, a elektrona oko sto tisuća puta manji (10 -15 m).

Thomsonov model Atom je sferna pozitivna kuglica u kojoj su vrlo sitni elektroni ravnomjerno raspoređeni tako da je takav atom kao cjelina neutralan. Budući da su mase atoma puno veće od mase elektrona, Thomson je pretpostavio da je glavni dio atomske mase pozitivan. Prve sumnje s prvim pokusom; raspršenje elektrona na tankoj metalnoj foliji. Većina elektrona prolazi neotklonjeno kroz foliju.

Rutherfordovo raspršenje 1909. godine Rutherford je promatrao raspršenje čestica na metalnoj foliji. Nakon prolaska kroz metalnu foliju -čestice su detektirane na fluorescentnom zaslonu. Na taj način određena je raspodjela -čestica u ovisnosti o kutu raspršenja .

Rutherfordov model atoma Atom se sastoji od vrlo male jezgre, oko 105 puta manje od atoma, u kojoj je skoncentrirana uglavnom sva masa atoma. Jezgra elementa rednog broja Z ima pozitivan naboj Ze. Oko jezgre na približnoj udaljenosti 10 -10 m kruži Z elektrona. Interakcija s elektronima se zanemaruje, a -čestice se raspršuju na jezgrama zbog odbojne sile.

Nedostaci Rutherfordovog modela atoma Ovim modelom se dobro opisuje raspršenje alfačestica, ali ne i atomski spektri. Ako se elektroni gibaju po zatvorenim krivuljama, a elektron emitira elektromagnetske valove čim mu se mijenja brzina, znači da bi elektroni stalno emitirali, gubili energiju i konačno pali na jezgru! Atom bi emitirao kontinuirani spektar, a ne linijski!
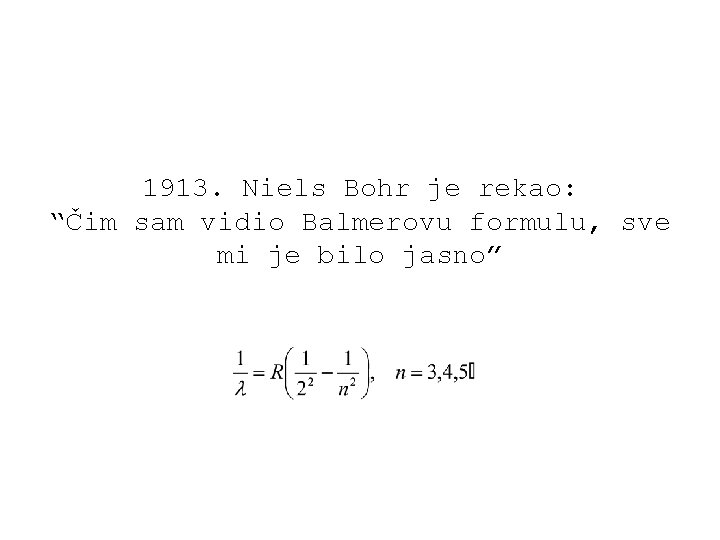
1913. Niels Bohr je rekao: “Čim sam vidio Balmerovu formulu, sve mi je bilo jasno”

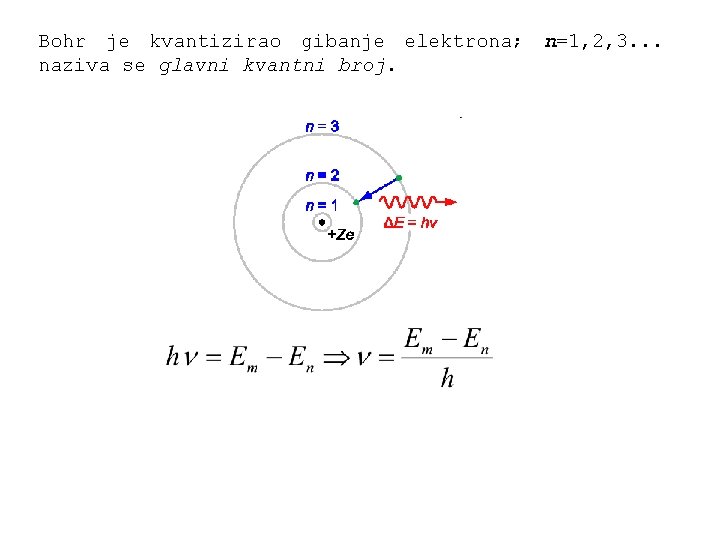
Bohrov model atoma Elektron ne može kružiti oko jezgre po bilo kojim već samo po određenim kvantiziranim stazama. To su stacionarne staze; gibajući se po njima elektron ne gubi energiju emitirajući EM valove. Emisija svjetlosti se događa samo pri skoku elektrona s jedne na drugu stacionarnu stazu. Dopuštene su samo one staze kojima je orbitalni moment količine gibanja cjelobrojni višekratnik reducirane Planckove konstante.

Bohr je kvantizirao gibanje elektrona; n=1, 2, 3. . . naziva se glavni kvantni broj.

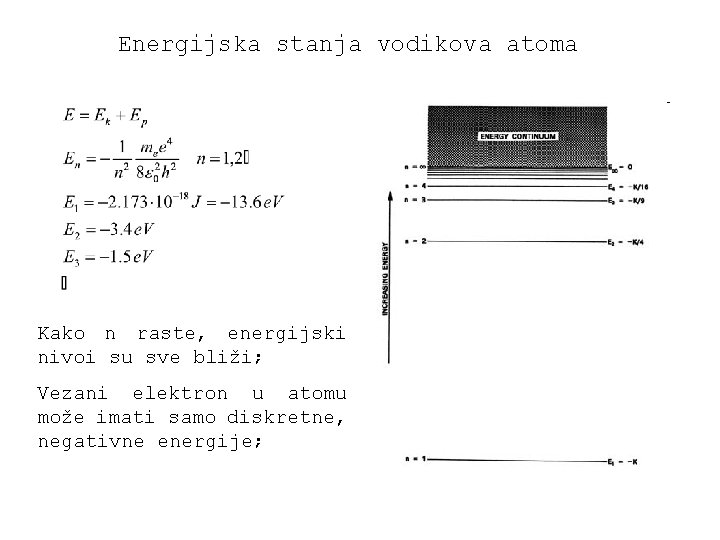
Energijska stanja vodikova atoma

Energijska stanja vodikova atoma

Energijska stanja vodikova atoma Kako n raste, energijski nivoi su sve bliži; Vezani elektron u atomu može imati samo diskretne, negativne energije;

Kada se atom vodika nalazi u osnovnom stanju (n=1), atom ne zrači svjetlost. Ako atom pobudimo, njegov elektron iz osnovnog stanja prelazi u neko više stanje (n=2, 3…). To postižemo zagrijavanjem, električnom strujom, poljem i sl. U pobuđenom stanju atom ostaje vrlo kratko (10 -8 s), a zatim se vraća u osnovno stanje zračeći svjetlost.


Princip korespondencije Kvantna fizika za velike kvantne brojeve reducira se u klasičnu fiziku. Promjena energije među susjednim nivoima za velike kvantne brojeve n vrlo je malena, te energiju možemo smatrati kontinuiranom i primijeniti klasičnu fiziku. Kada je n malen, energija je diskontinuirana veličina i moraju se primijeniti zakoni kvantne fizike. Granice važnosti klasične fizike određene su veličinom Planckove konstante. Za procese u kojima se konstanta h može smatrati vrlo malenom mogu se primijeniti zakoni klasične fizike. Kada veličine postanu istog reda veličine kao i h, mora se primijeniti kvantna fizika.

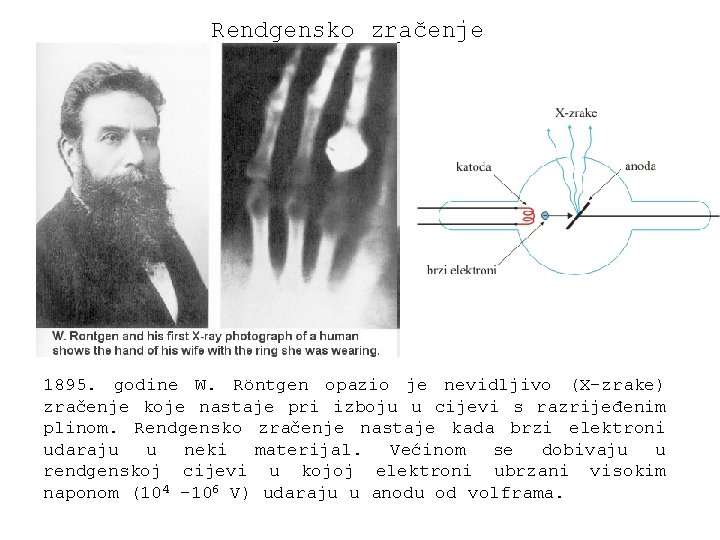
Rendgensko zračenje 1895. godine W. Röntgen opazio je nevidljivo (X-zrake) zračenje koje nastaje pri izboju u cijevi s razrijeđenim plinom. Rendgensko zračenje nastaje kada brzi elektroni udaraju u neki materijal. Većinom se dobivaju u rendgenskoj cijevi u kojoj elektroni ubrzani visokim naponom (104 – 106 V) udaraju u anodu od volframa.

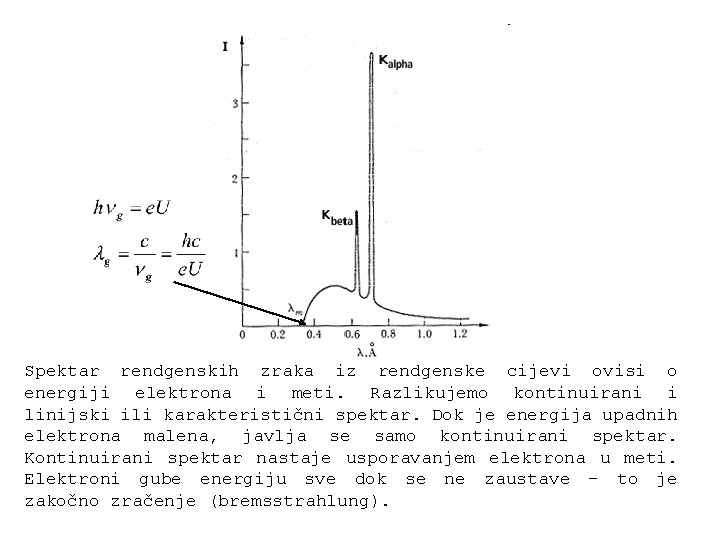
Spektar rendgenskih zraka iz rendgenske cijevi ovisi o energiji elektrona i meti. Razlikujemo kontinuirani i linijski ili karakteristični spektar. Dok je energija upadnih elektrona malena, javlja se samo kontinuirani spektar. Kontinuirani spektar nastaje usporavanjem elektrona u meti. Elektroni gube energiju sve dok se ne zaustave – to je zakočno zračenje (bremsstrahlung).

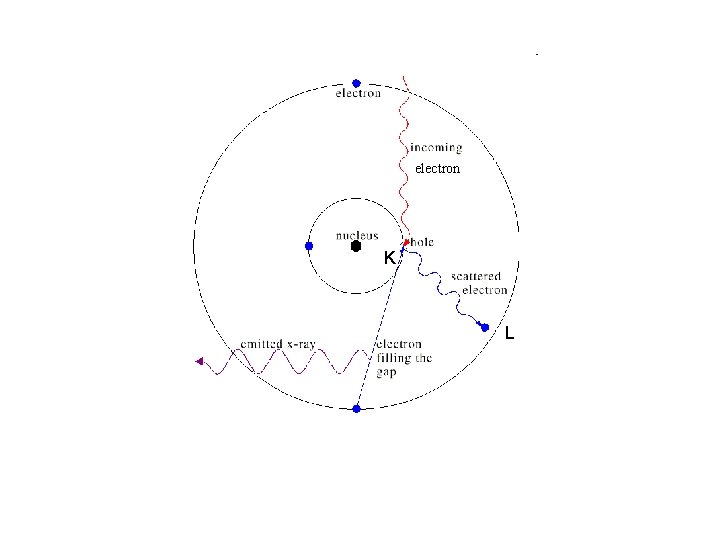
electron K L

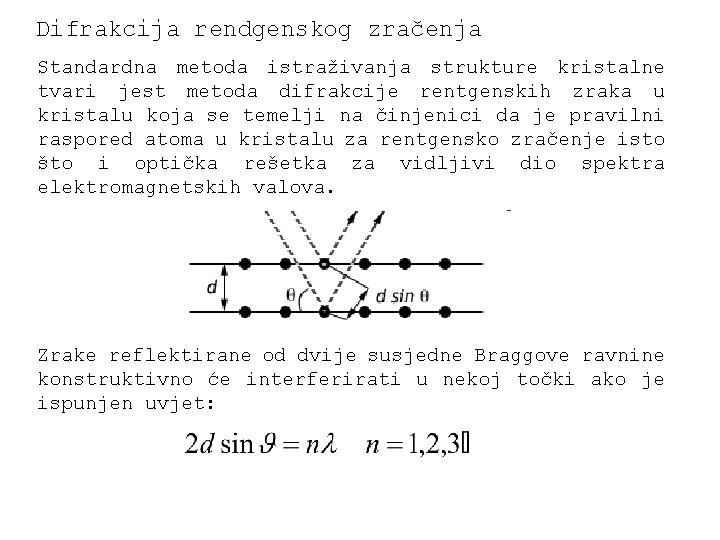
Difrakcija rendgenskog zračenja Standardna metoda istraživanja strukture kristalne tvari jest metoda difrakcije rentgenskih zraka u kristalu koja se temelji na činjenici da je pravilni raspored atoma u kristalu za rentgensko zračenje isto što i optička rešetka za vidljivi dio spektra elektromagnetskih valova. Zrake reflektirane od dvije susjedne Braggove ravnine konstruktivno će interferirati u nekoj točki ako je ispunjen uvjet:



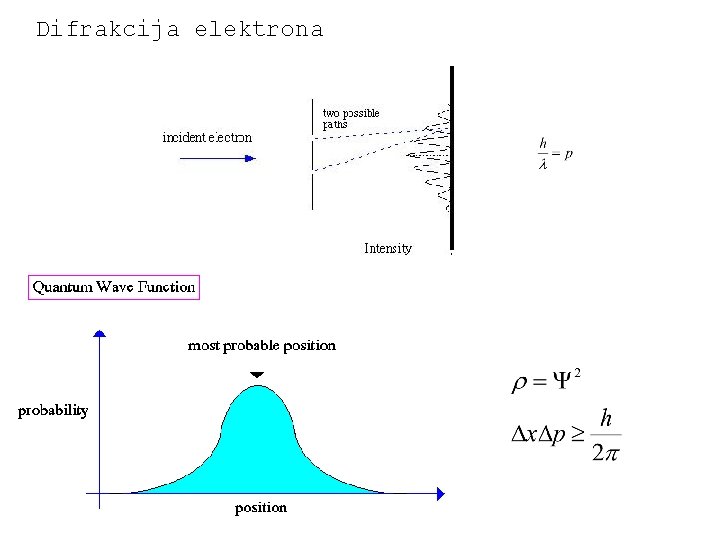
Valna priroda svjetlosti 1924. Louis de Broglie postavio hipotezu prema kojoj svaka čestica koja se giba osim čestičnih ima i valna svojstva.

Difrakcija elektrona

Gustoća vjerojatnosti (da česticu nađemo na pojedinom mjestu) Normiranje Valni broj

Schrödingerova jednadžba

Kvantni brojevi Rješavanje Schrodingerove jednadžbe (r, , )=R(r)Y( , ) nlm=Rnl Ylm Rješenje za vodikov atom (svojstvene vrijednosti): n - glavni kvantni broj; svi elektroni istog kvantnog broja n pripadaju istoj ljusci; n=1 K n=2 L n=3 M

l- orbitalni kvantni broj Bohrov model kružnih putanja ne može objasniti finu strukturu, ni Starkov ni Zeemanov efekt. Sommerfeld je proširio model na eliptički model atoma. Valna mehanika pokazuje, umjesto Bohrovog L=nħ, da je: Gdje orbitalni kvantni broj l može za kvantni broj n poprimiti ove vrijednosti: određeni glavni l=0, 1, 2. . . n-1 Orbitalni kvantni broj određuje moment količine gibanje. l=0 s l=1 p l=2 d Moguća stanja: 1 s, 2 p, 3 s, 3 p, 3 d. . .

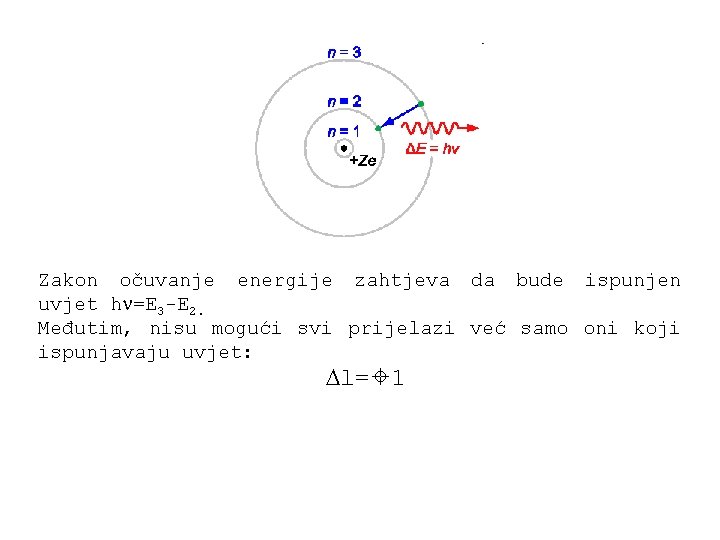
Zakon očuvanje energije zahtjeva da bude ispunjen uvjet h =E 3 -E 2. Međutim, nisu mogući svi prijelazi već samo oni koji ispunjavaju uvjet: l= 1

ml - magnetski kvantni broj Elektron koji se oko jezgre čini zatvorenu strujnu petlju određenog magnetskog momenta. Pretpostavimo da je staza kružnica polumjera r: Ako imamo slijedi: vanjsko magnetsko polje u smjeru z-osi, ml je magnetski kvantni broj. Za određeni l magnetski kvantni broj može poprimiti 2 l+1 cjelobrojnih vrijednosti između –l i l, tj. ml=0, 1, 2, . . . , l

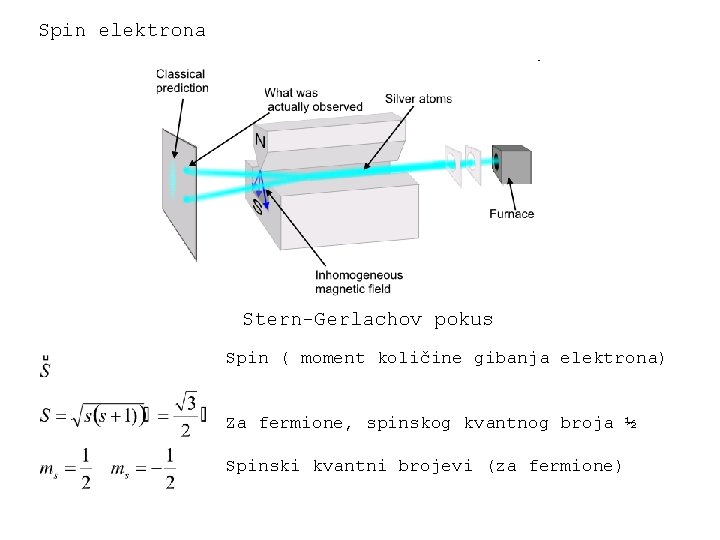
Spin elektrona Stern-Gerlachov pokus Spin ( moment količine gibanja elektrona) Za fermione, spinskog kvantnog broja ½ Spinski kvantni brojevi (za fermione)

Ukupni moment količine gibanje: Russel-Sandersovo vezanje 1. Gibanje elektrona u atomu određeno je četirima kvantnim brojevima. 2. U elektronskom omotaču elektroni su raspoređeni po tzv. Paulijevom principu isključenja. Taj princip kaže da dva elektrona u atomu ne mogu imati sva četiri kvantna broja jednaka.

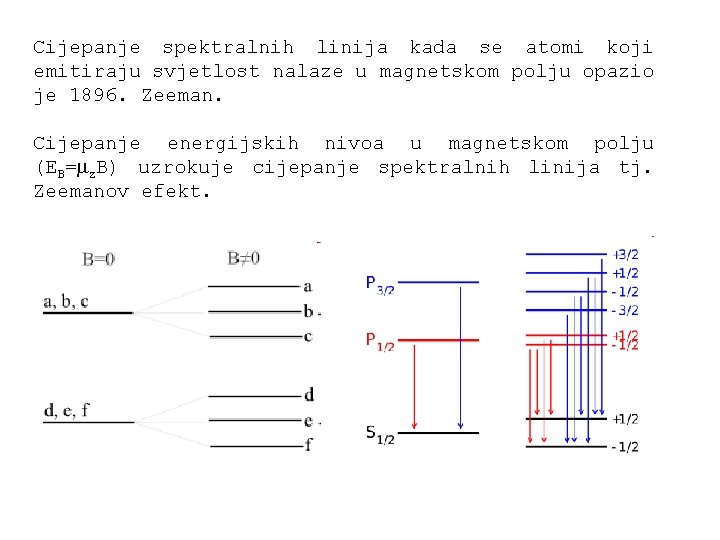
Cijepanje spektralnih linija kada se atomi koji emitiraju svjetlost nalaze u magnetskom polju opazio je 1896. Zeeman. Cijepanje energijskih nivoa u magnetskom polju (EB= z. B) uzrokuje cijepanje spektralnih linija tj. Zeemanov efekt.

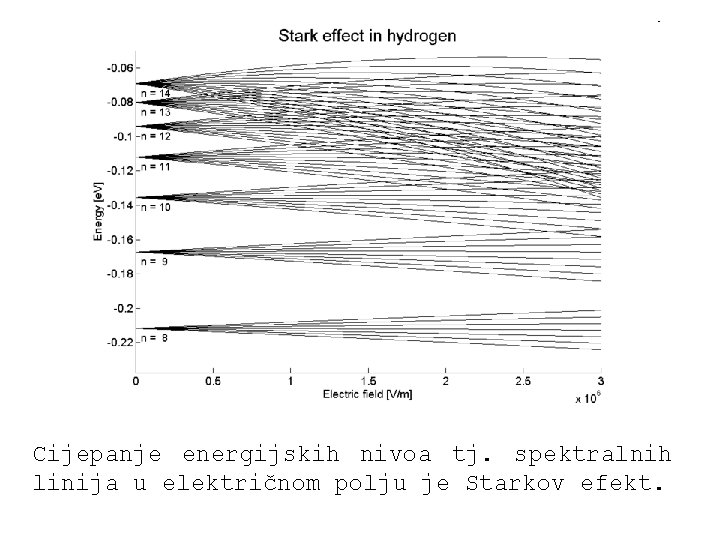
Cijepanje energijskih nivoa tj. spektralnih linija u električnom polju je Starkov efekt.

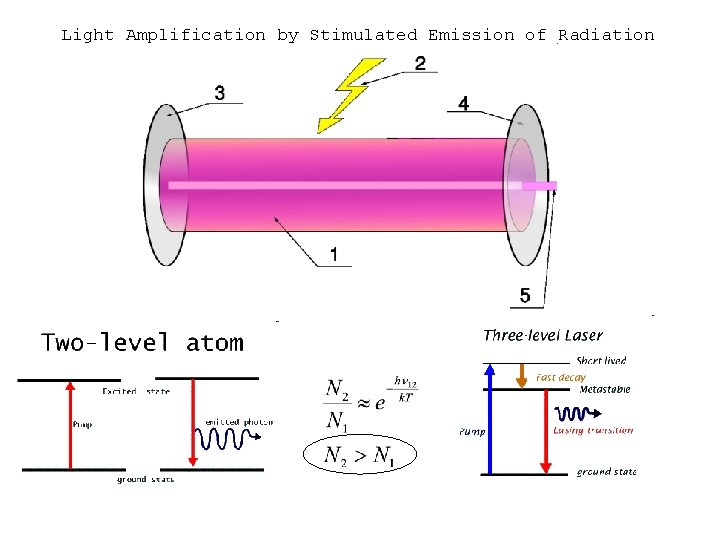
Light Amplification by Stimulated Emission of Radiation

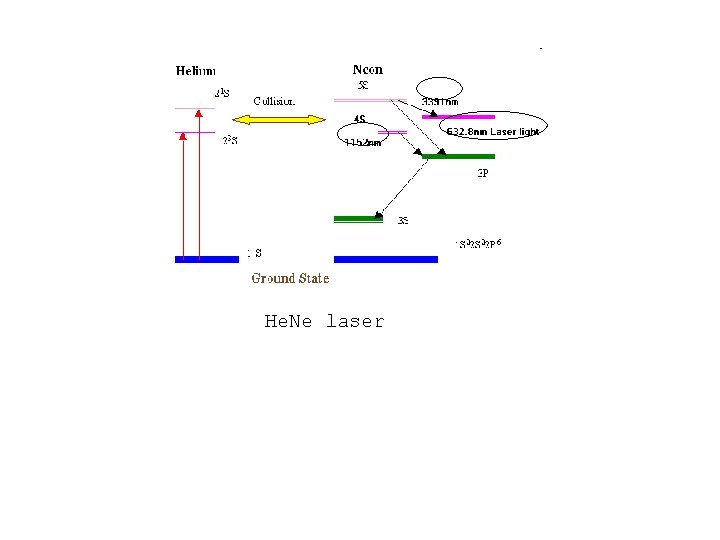
He. Ne laser

• 1913. G. Y. Moseley je proučavajući rendgenske spektre uočio jednostavnu i vrlo važnu ovisnost valne duljine spektralnih linija o rednom broju elementa od kojeg je napravljena meta. Spektri su po svojoj strukturi za sve elemente jednaki, samo se valne duljine pojedinih linija smanjuju s porastom rednoh broja. • Moseley je empirički došao do rezultata za cijelu Kseriju: • Moseleyev zakon kaže da je kvadratni frekvencije linearna funkcija broja Z. korijen

• Svojstva i struktura jezgre • Energija vezanja jezgre • Zakon radioaktivnog raspada • Nuklearne reakcije

• Jezgru atoma otkrio je Raderford 1911. godine u svom eksperimentu raspršenja -čestica na tankim metalnim folijama. • Jezgra atoma sastavljena je od protona i neutrona, a zajednički ih nazivamo nukleonima. • Proton je pozitivno nabijen, a iznos naboja jednak je naboju elektron. Neutron je neutralan. • Protoni i neutroni imaju spinski kvantni broj ½. • Naboj jezgre Ze određen je brojem protona Z, a ukupnu broj protona i neutrona određuje maseni broj jezgre A. • Izotopi imaju jednak broj protona, ali različit broj neutrona, N. • Izobari maju jednak broj nukleona, npr.

• Atomske mase iskazuju se atomskim jedinicama mase: • Masa mirovanja protona i neutrona su: • Polumjer jezgre raste s povećanjem masenog broja: gdje r 0 poprima vrijednosti od 1. 2 fm do 1. 5 fm.

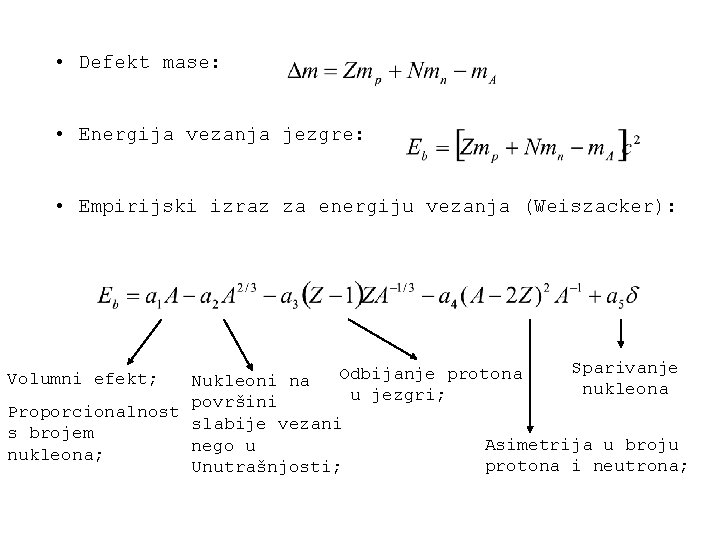
• Defekt mase: • Energija vezanja jezgre: • Empirijski izraz za energiju vezanja (Weiszacker): Sparivanje Odbijanje protona Nukleoni na nukleona u jezgri; površini Proporcionalnost slabije vezani s brojem Asimetrija u broju nego u nukleona; protona i neutrona; Unutrašnjosti; Volumni efekt;

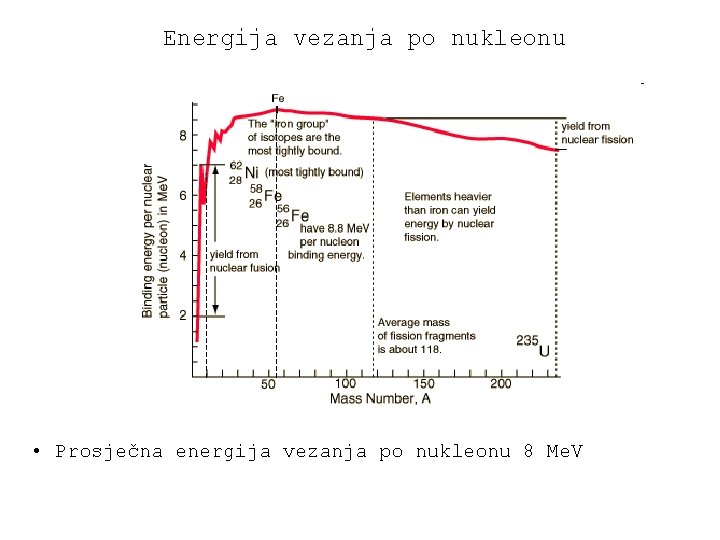
Energija vezanja po nukleonu • Prosječna energija vezanja po nukleonu 8 Me. V

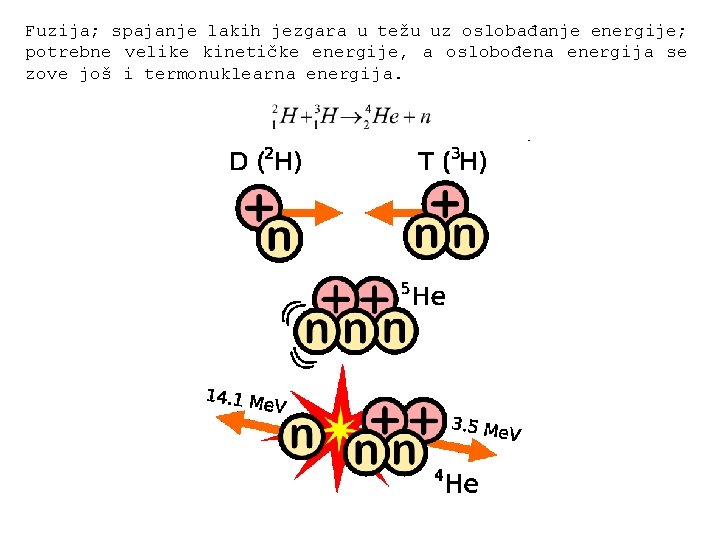
Fuzija; spajanje lakih jezgara u težu uz oslobađanje energije; potrebne velike kinetičke energije, a oslobođena energija se zove još i termonuklearna energija.

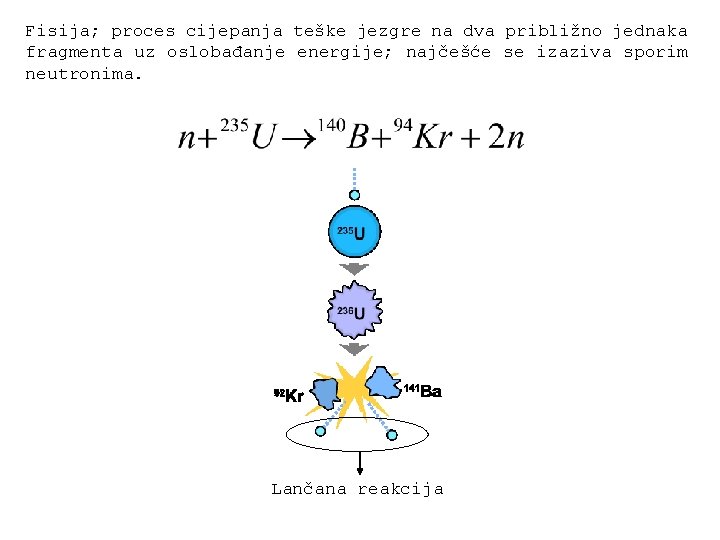
Fisija; proces cijepanja teške jezgre na dva približno jednaka fragmenta uz oslobađanje energije; najčešće se izaziva sporim neutronima. Lančana reakcija

Vjerojatnost nuklearne reakcije iskazuje se udarnim presjekom: N – broj izlaznih čestica N – broj upadnih čestica x – debljina meta n – broj jezgri po jedinici volumena mete

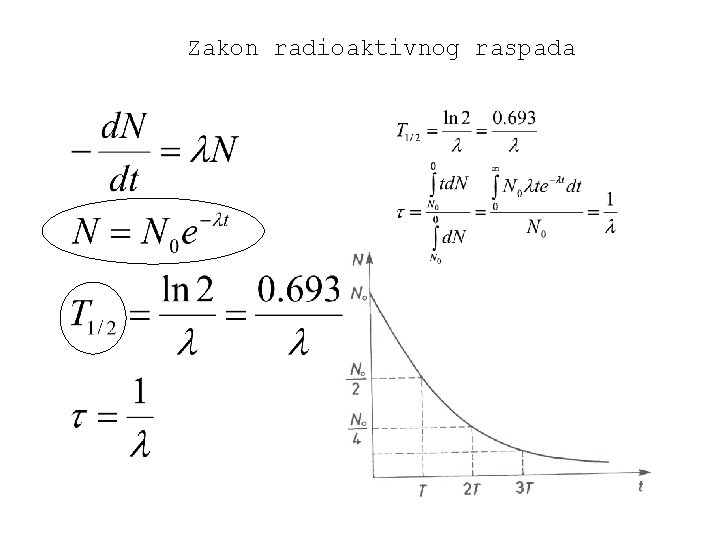
Radioaktivnost • Mnogi izotopi radioaktivni. elemenata sa A>200 prirodno su • -raspad: ; posljedica je djelovanja jake sile; srednji slobodni put mali. • -raspadi; --raspad: ; +-raspad: ; posljedica slabe sile. • -raspad je emisija elektromagnetskog zračenja iz jezgre atoma; energije tog zračenja znatno su veće od energija prijelazima elektrona u atomu.


Zakon radioaktivnog raspada


 Kvantna priroda elektromagnetnog zracenja
Kvantna priroda elektromagnetnog zracenja Kvantna kriptografija
Kvantna kriptografija Kemijske jednadžbe
Kemijske jednadžbe Razlaganje svjetlosti na boje
Razlaganje svjetlosti na boje Krunica svijetla
Krunica svijetla Zraka svjetlosti upada iz zraka pod kutom od 60
Zraka svjetlosti upada iz zraka pod kutom od 60 Piramida lom svjetlosti
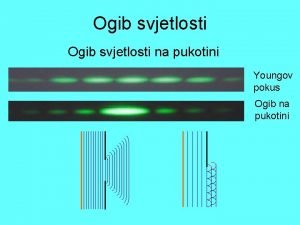
Piramida lom svjetlosti Difrakcija svjetlosti
Difrakcija svjetlosti Konstanta optičke rešetke
Konstanta optičke rešetke Refrakcija svjetlosti
Refrakcija svjetlosti Difuzno odbijanje svjetlosti
Difuzno odbijanje svjetlosti Interferencija svjetlosti na tankim prozirnim slojevima
Interferencija svjetlosti na tankim prozirnim slojevima Snop svjetlosti
Snop svjetlosti Hep obnovljivi izvori energije
Hep obnovljivi izvori energije Neobnovljivi izvori energije slike
Neobnovljivi izvori energije slike Kinetička energija
Kinetička energija Glavni izvori energije
Glavni izvori energije Primarni izvori energije
Primarni izvori energije Neobnovljivi izvori energije slike
Neobnovljivi izvori energije slike Kruzenje tvari u prirodi
Kruzenje tvari u prirodi Zakon o promeni kineticke energije
Zakon o promeni kineticke energije Biodizel srbija
Biodizel srbija Koji su obnovljivi izvori energije
Koji su obnovljivi izvori energije Egzergone reakcije
Egzergone reakcije Nalazište nafte u nizinskoj hrvatskoj
Nalazište nafte u nizinskoj hrvatskoj Neobnovljivi izvori energije
Neobnovljivi izvori energije Koji su oblici energije
Koji su oblici energije Korisni oblici energije
Korisni oblici energije Em spektar
Em spektar Uređaj za kompenzaciju jalove energije cijena
Uređaj za kompenzaciju jalove energije cijena Sprememba notranje energije
Sprememba notranje energije Mere za racionalno i bezbedno koriscenje toplotne energije
Mere za racionalno i bezbedno koriscenje toplotne energije Oblici energije
Oblici energije Kurikulum priroda i društvo
Kurikulum priroda i društvo Priroda jezičnog znaka
Priroda jezičnog znaka Priroda i drustvo za 3 razred testovi zivotne zajednice
Priroda i drustvo za 3 razred testovi zivotne zajednice Priroda reaktanata
Priroda reaktanata Istraživačke vještine priroda i društvo
Istraživačke vještine priroda i društvo Ponavljanje gradiva 4 razreda priroda i društvo
Ponavljanje gradiva 4 razreda priroda i društvo živá a neživá příroda
živá a neživá příroda Kruženje vode u prirodi 6 razred
Kruženje vode u prirodi 6 razred Novi apsolutizam kviz
Novi apsolutizam kviz Priroda i drustvo za 4 razred nacionalni parkovi
Priroda i drustvo za 4 razred nacionalni parkovi Najkrajšie miesta na svete ktoré vytvorila príroda
Najkrajšie miesta na svete ktoré vytvorila príroda Ziva a neziva priroda obrazky
Ziva a neziva priroda obrazky Priroda reaktanata
Priroda reaktanata živá a neživá príroda pracovný list
živá a neživá príroda pracovný list Biljke životinje i ljudi u proljeće
Biljke životinje i ljudi u proljeće Trinom formula
Trinom formula Kviz za 1 razred
Kviz za 1 razred živa priroda 4. razred kviz
živa priroda 4. razred kviz Asocijacije labud
Asocijacije labud Priroda jezičnog znaka
Priroda jezičnog znaka Prirodni i vestacki materijali
Prirodni i vestacki materijali Priroda i društvo 4 razred kviz brežuljkasti zavičaj
Priroda i društvo 4 razred kviz brežuljkasti zavičaj Realism (1848–1900)
Realism (1848–1900) 1900 fashion history
1900 fashion history 1865 to 1900 inventions
1865 to 1900 inventions Språkdebatten 1900
Språkdebatten 1900 Revolutionary leaders 1900-1939
Revolutionary leaders 1900-1939 Drottning soraya afghanistan
Drottning soraya afghanistan 1900/1600
1900/1600 Population of europe 1900
Population of europe 1900 Music 1900 to 2000
Music 1900 to 2000 1850-1890
1850-1890 Scoperte scientifiche dal 1850 al 1900
Scoperte scientifiche dal 1850 al 1900 Living and working conditions in australia 1900
Living and working conditions in australia 1900 Krigslyrikk
Krigslyrikk