Geometrie molekul Lewisovy vzorce poskytuj informaci o tom















- Slides: 34

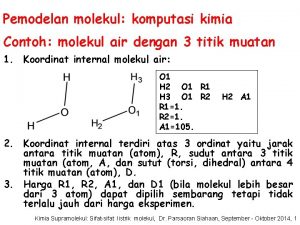
Geometrie molekul • Lewisovy vzorce poskytují informaci o tom které atomy jsou spojeny vazbou a o jakou vazbu se jedná (topologie molekuly). • Geometrické uspořádání molekuly je charakterizováno: Délkou vazeb – přímá vzdálenost mezi jádry dvou atomů spojených vazbou. Úhly vazeb – úhel mezi kteroukoli dvojicí vazeb které zahrnují společný atom.

Geometrie molekul

Teorie chemické vazby a molekulární geometrie • Atomy se v molekule uspořádají do definovaných vzájemných pozic. • Molekulární geometrie = obecný tvar molekuly popisující vzájemné relativní pozice atomových jader. • Teorie chemické vazby a molekulární geometrie: – VSEPR (Valence Shell Electron-Pair Repulsion) = založena na elektrostatickém působení atomů v molekule. – VBT (Valence Bond Theory) = uvažuje kvantové efekty a hybridizaci atomových orbitalů. – MO-LCAO (Molecular Orbitals – Linear Combination of Atomic Orbitals) = vychází z představy o tvorbě nových (molekulárních) orbitalů lineární kombinací atomových orbitalů při vzniku chemické vazby.

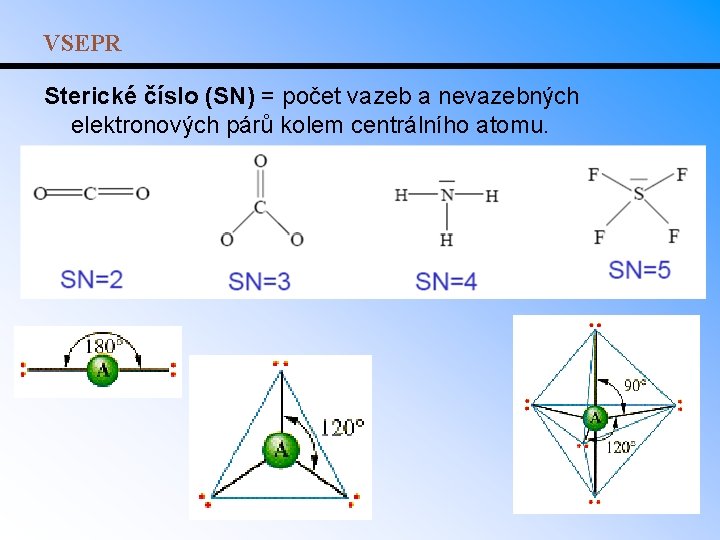
VSEPR • Teorie VSEPR uvažuje pouze repulzi valenčních elektronových párů – jejich prostorové uspořádání odpovídá minimu odpudivé energie. • Elektronový pár se snaží co nejvíce přiblížit k jádru a zároveň být co nejdále od ostatních elektronových párů. • Repulze mezi elektronovými páry klesá v pořadí: - 2 nevazebné elektronové páry - vazba s -interakcí – jednoduchá vazba - jednoduchá vazba – nevazebný pár - 2 jednoduché vazby

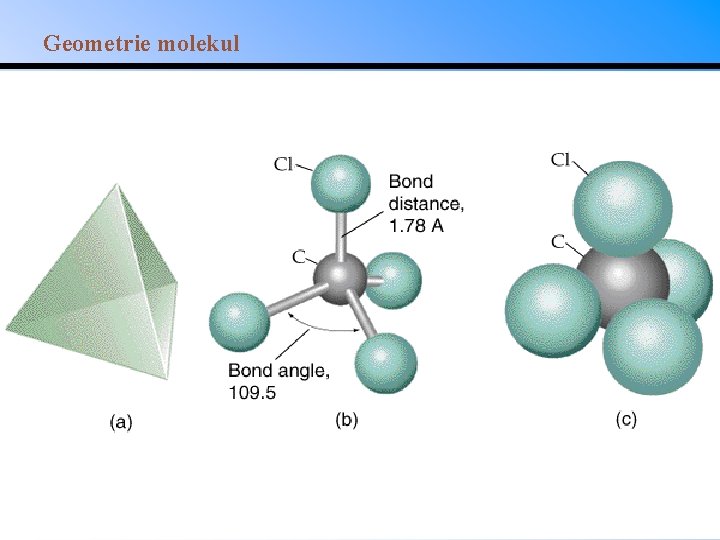
VSEPR Sterické číslo (SN) = počet vazeb a nevazebných elektronových párů kolem centrálního atomu.

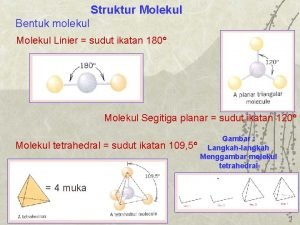
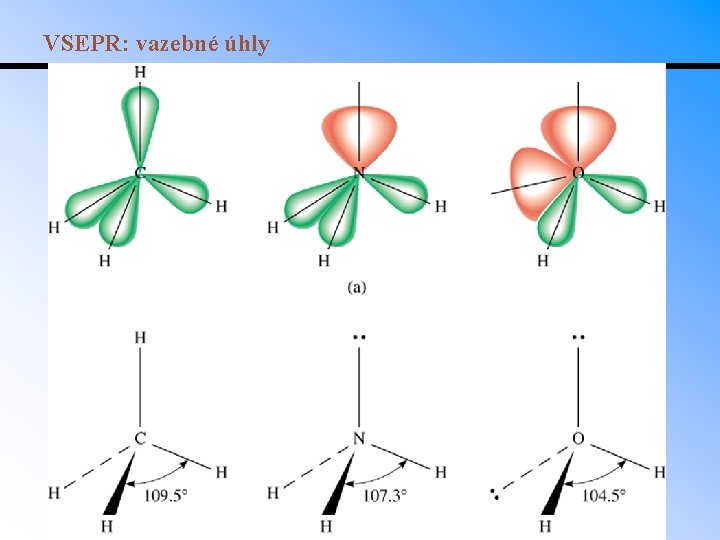
VSEPR: predikce molekulární geometrie • Z Lewisova vzorce plyne počet vazeb a nevazebných el. párů kolem centrálního atomu - sterické číslo, které určuje základní molekulární geometrii. • Volné elektronové páry a násobné vazby ovlivňují geometrii více než jednoduché vazby. Ze základních tvarů pak vznikají tvary odvozené. • Př. : NH 3 má jeden volný elektronový pár. Vazebný úhel mezi atomy H je redukován z hodnoty 109° (úhel v základním tetraedrickém tvaru) na 107°. V molekule H 2 O se dvěma volnými elektronovými páry svírají atomy H úhel pouze 105°. • Podobný efekt mají násobné vazby: H 2 C=O (116° místo 120° mezi atomy H); H 2 C=CH 2 (117° místo 120° mezi atomy H). • Př. : Navrhněte geometrii následujících molekul: – Be. Cl 2, CO 2 - BF 3, COCl 2, O 3, SO 2 – CH 4, PCl 3, H 2 O - PCl 5, SF 4, Cl. F 3 – SF 6, IF 5, Xe. F 4

VSEPR: vazebné úhly



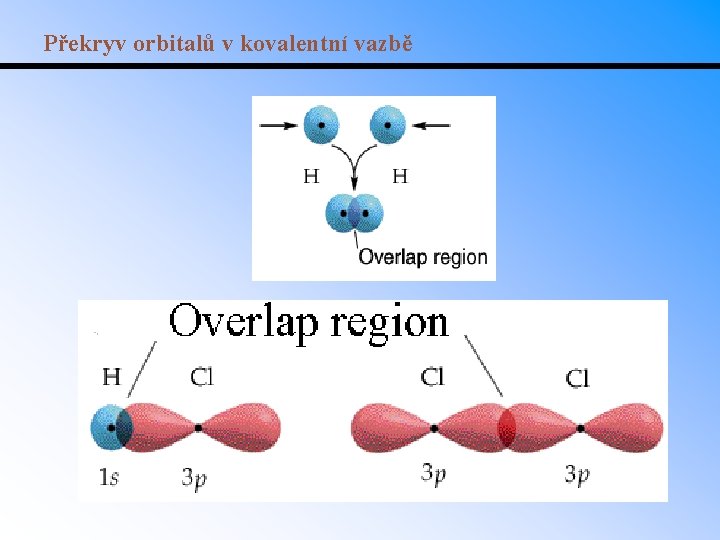
VBT • Teorie VSEPR neposkytuje informaci o tom jak chemická vazba vznikne a proč se vazby liší délkou a energií. • Teorie valenční vazby (Valence Bond Theory, VBT) vysvětluje vznik vazby jako překryv atomových orbitalů a sdílení elektronového páru. • Př. : molekula H 2 vznikne překryvem dvou 1 s orbitalů. Atomové orbitaly podslupky p vytvoří vazbu v F 2. V CH 4 vznikne vazba překryvem 1 s orbitalu vodíku s 2 s a 2 p orbitaly uhlíku. • U atomů spojených vazbou dojde k interferenci jejich vlnových funkcí za vzniku nové (hybridní) vlnové funkce. • Př. : s a p orbitaly kolem atomu uhlíku v CH 4 se mohou stát ekvivalentními hybridy (hybridizace sp 3).

Překryv orbitalů v kovalentní vazbě

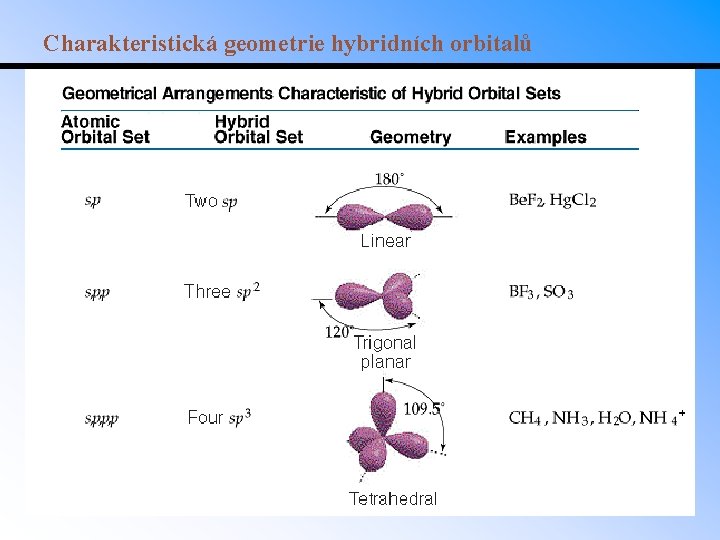
Hybridizace • Př. : Be. F 2 – Be má elektronovou konfiguraci 1 s 22 s 2 – Žádný nepárový elektron není k dispozici do vazby. – Elektron z 2 s orbitalu může přejít do 2 p orbitalu, tím vzniknou dva nepárové elektrony. • Úhel vazby F-Be-F je podle teorie VSEPR 180. VSEPR ovšem pro tuto geometrii neposkytuje vysvětlení. • Problém lze vyřešit kombinací orbitalu 2 s a jednoho z orbitalů 2 p na Be za vzniku dvou hybridních orbitalů. • Takto vzniklé hybridní orbitaly se označují sp. • Úhel mezi dvěma sp hybridními orbitaly je 180. • Pouze jeden z 2 p orbitalů na Be byl využit k hybridizaci, na atomu tedy zůstávají dva nehybridizované p orbitaly.

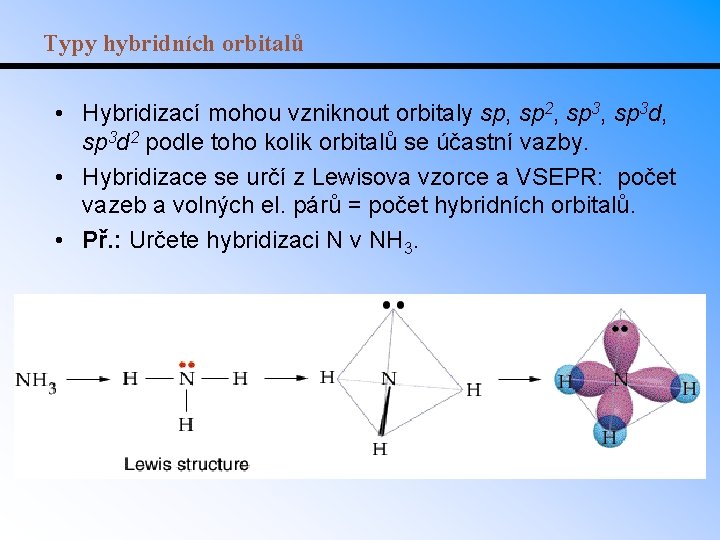
Typy hybridních orbitalů • Hybridizací mohou vzniknout orbitaly sp, sp 2, sp 3 d, sp 3 d 2 podle toho kolik orbitalů se účastní vazby. • Hybridizace se určí z Lewisova vzorce a VSEPR: počet vazeb a volných el. párů = počet hybridních orbitalů. • Př. : Určete hybridizaci N v NH 3.

Charakteristická geometrie hybridních orbitalů

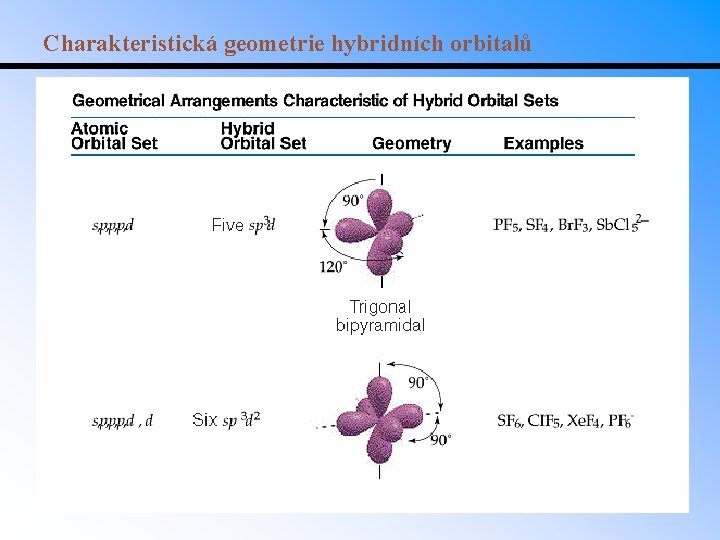
Charakteristická geometrie hybridních orbitalů

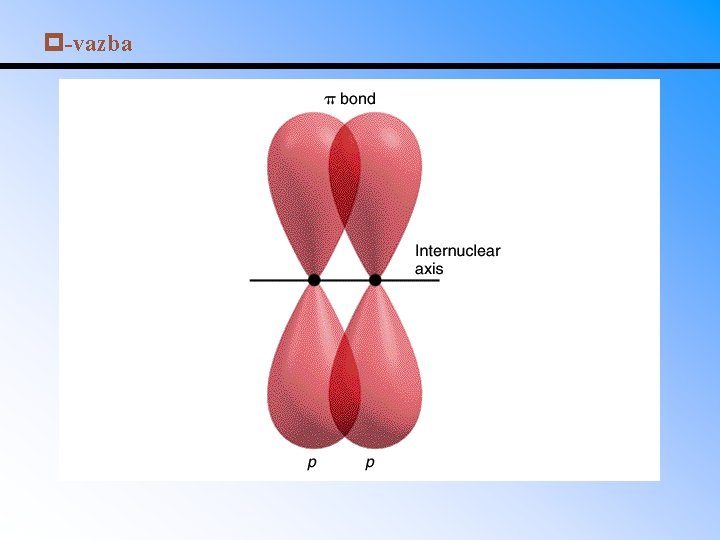
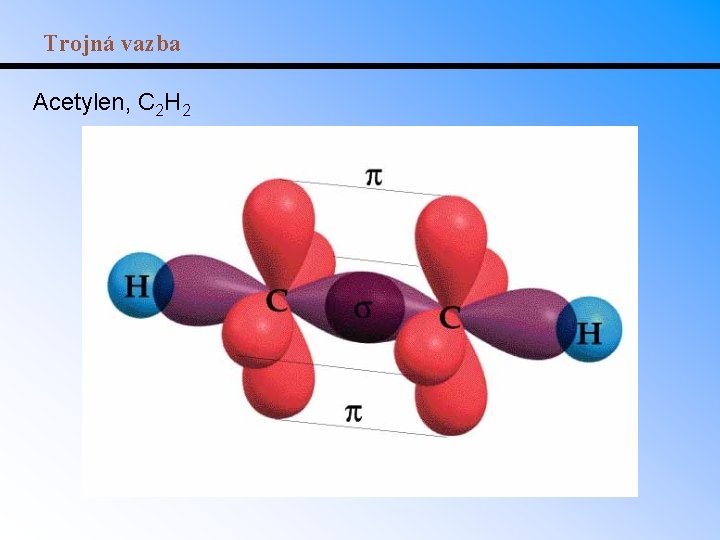
Násobné vazby • -vazba – elektrony jsou shromážděny v ose spojující atomová jádra. • -vazba – elektronový oblak nad a pod rovinou atomových jader. -vazba vzniká z nehybridizovaných orbitalů. • Dvojná vazba se skládá z jedné -vazby a jedné -vazby, trojná vazba z jedné -vazby a dvou vazeb.

-vazba

Trojná vazba Acetylen, C 2 H 2

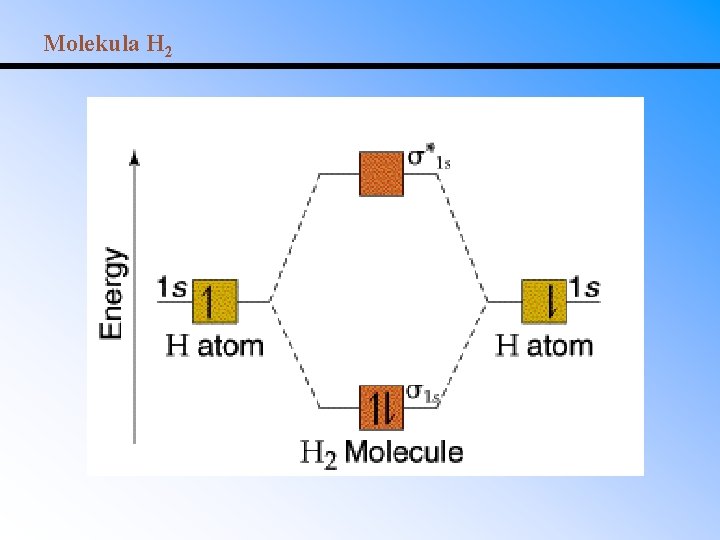
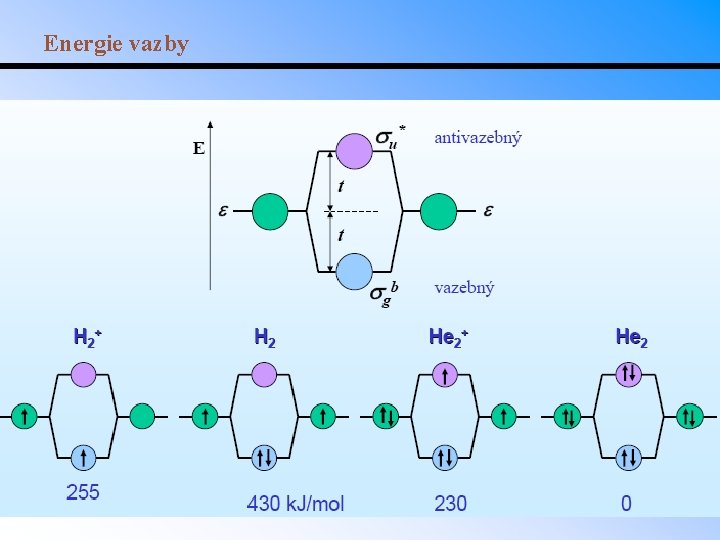
MO-LCAO • Teorie molekulových orbitalů dále rozšiřuje kvantověmechanický model: lineární kombinací atomových orbitalů vzniká stejný počet molekulových orbitalů, z nichž polovina má nižší energii než původní AO (vazebné MO) a polovina energii vyšší (antivazebné MO). • Teorie MO-LCAO tudíž dokáže popsat i excitaci vazebných elektronů. • Při zaplňování MO platí stejná pravidla jako u AO (Pauliho princip, Hundovo pravidlo). • Molekula vodíku: přiblížením dvou atomových orbitalů vzniknou dva molekulové orbitaly a *. – Energie vazebného MO je nižší než původních AO. – Energie antivazebného MO je vyšší než původních AO a tudíž destabilizuje molekulu.

Molekula H 2

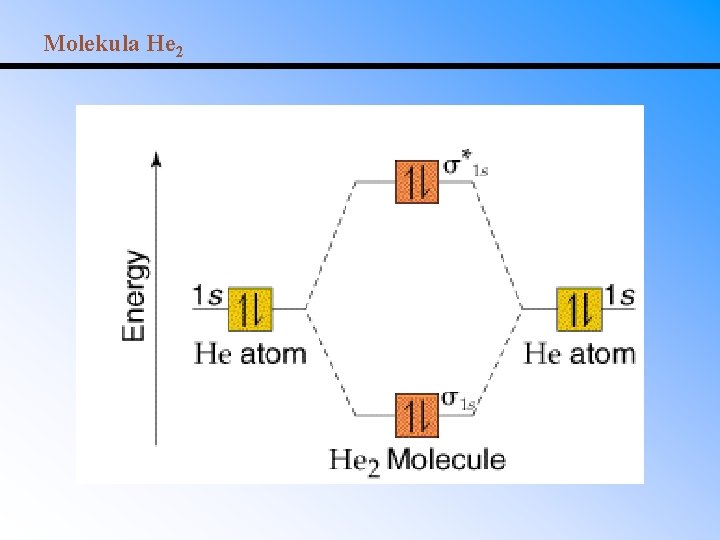
Molekula He 2

Řád vazby = ½(vazebné elektrony – antivazebné elektrony) Řád vazby = 1 pro jednoduchou vazbu Řád vazby = 2 pro dvojnou vazbu Řád vazby = 3 pro trojnou vazbu Řád vazby pro H 2 = ½(2 - 0) = 1. Vazba v H 2 je tedy jednoduchá. Řád vazby pro He 2 = ½(2 - 2) = 0. Molekula He 2 tedy není stabilní.

Energie vazby

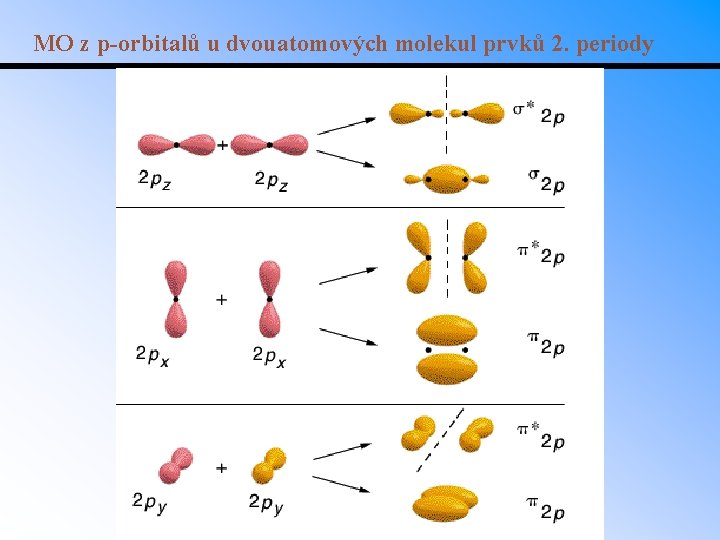
MO z p-orbitalů u dvouatomových molekul prvků 2. periody

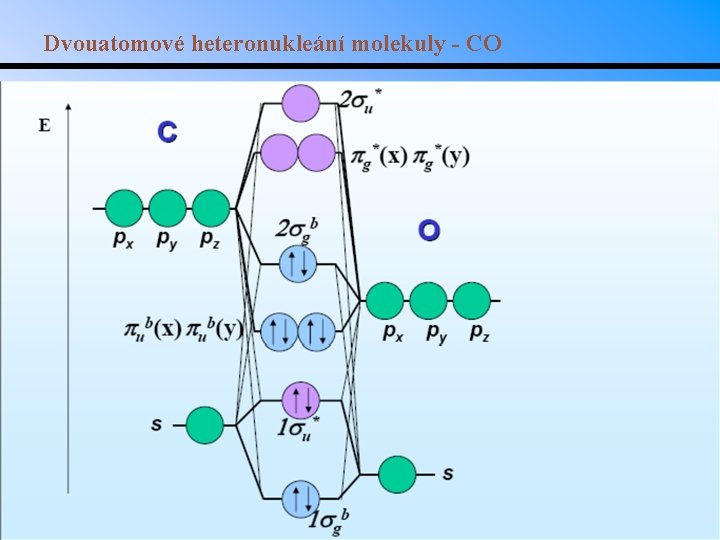
Dvouatomové heteronukleání molekuly - CO

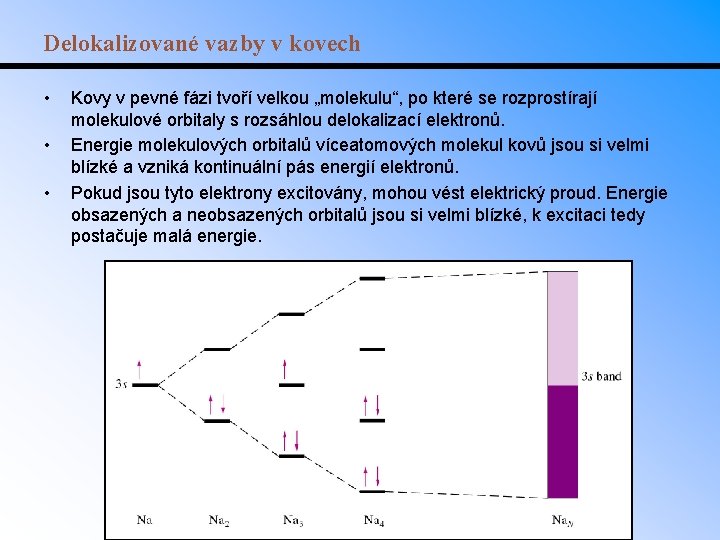
Delokalizované vazby v kovech • • • Kovy v pevné fázi tvoří velkou „molekulu“, po které se rozprostírají molekulové orbitaly s rozsáhlou delokalizací elektronů. Energie molekulových orbitalů víceatomových molekul kovů jsou si velmi blízké a vzniká kontinuální pás energií elektronů. Pokud jsou tyto elektrony excitovány, mohou vést elektrický proud. Energie obsazených a neobsazených orbitalů jsou si velmi blízké, k excitaci tedy postačuje malá energie.

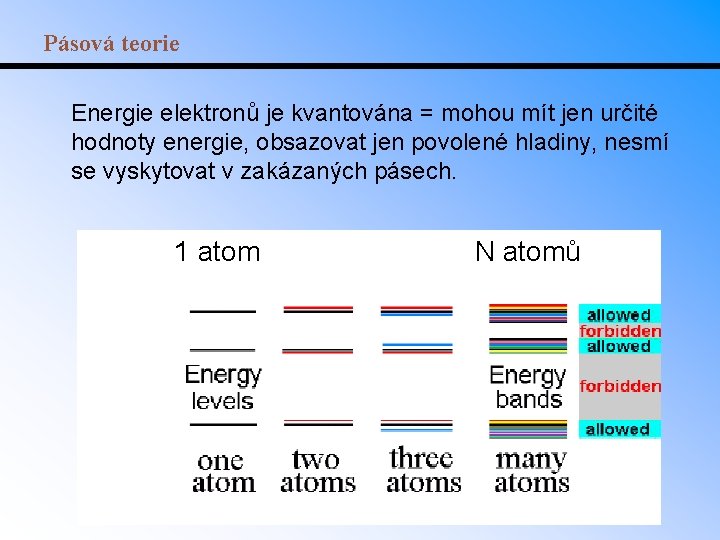
Pásová teorie Energie elektronů je kvantována = mohou mít jen určité hodnoty energie, obsazovat jen povolené hladiny, nesmí se vyskytovat v zakázaných pásech. 1 atom N atomů

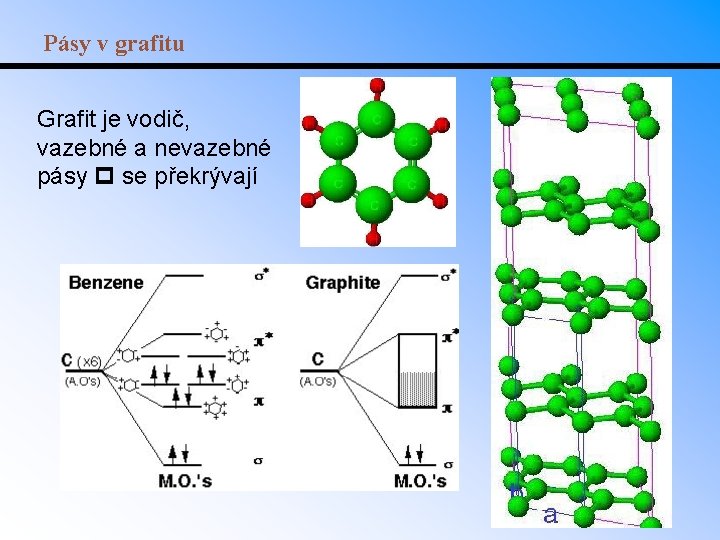
Pásy v grafitu Grafit je vodič, vazebné a nevazebné pásy se překrývají

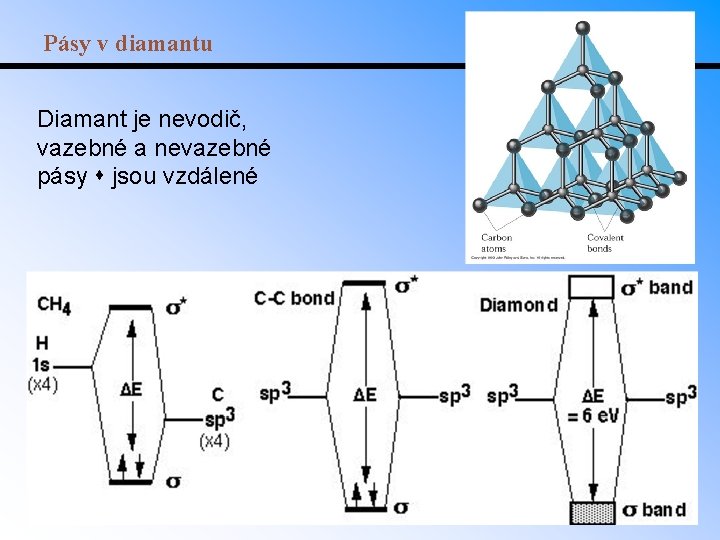
Pásy v diamantu Diamant je nevodič, vazebné a nevazebné pásy jsou vzdálené

Pásové uspořádání pro vodiče, nevodiče a polovodiče

Polární vazba: elektronegativita • Rozdíl elektronegativit dvou prvků ukazuje na to kolem kterého z nich se budou hromadit vazebné elektrony: • Iontová vazba vzniká pokud 2 • Kovalentní vazba vzniká pokud 1 • Polárně kovalentní vazba vzniká pokud 1 2. Na atomech ve vazbě se objevují částečné (parciální) náboje + a . • Př. : Určete polaritu vazby N – H v NH 3 a C-Cl v CCl 4. • Př. : Odhadněte relativní polaritu HF, HCl, HBr a HI.

Polarita molekul • Vazebný dipól vyjadřuje polaritu vazby (vektorová veličina): • Dipólový moment je celkový dipól molekuly (vektorový součet, dipólový moment tedy může být nulový i v případě nenulových vazebných dipólů): • Jednotky: debye (D), 1 D = 33. 36 x 10 30 Cm. • Polární vazba vzniká mezi atomy s odlišnou elektronegativitou. – Elektronegativnější atom bude mít částečný záporný náboj ( ) – Elektronově chudší část vazby vykazuje částečný kladný náboj ( +) • Př. : Odhadněte jestli molekuly NH 3, H 2 O, CO 2 mají dipólový moment. • Př. : Určete který z izomerů (cis- nebo trans-) C 2 H 2 Cl 2 má dipólový moment.


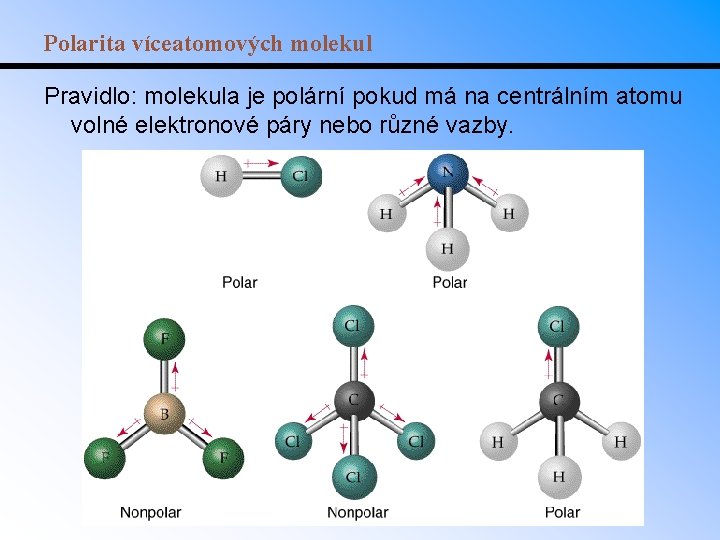
Polarita víceatomových molekul Pravidlo: molekula je polární pokud má na centrálním atomu volné elektronové páry nebo různé vazby.
 Lewisovy vzorce
Lewisovy vzorce Tom tom go 910
Tom tom go 910 Symbols in the devil and tom walker
Symbols in the devil and tom walker Geodreieck material
Geodreieck material Kunststof rotan stoelvorm buymouldsonline.nl
Kunststof rotan stoelvorm buymouldsonline.nl Esprit de geometrie
Esprit de geometrie Geometrická symbolika
Geometrická symbolika Pyramidenkante
Pyramidenkante Volumul prismei triunghiulare regulate
Volumul prismei triunghiulare regulate Co je to těžnice
Co je to těžnice Geometrie
Geometrie Geometrie
Geometrie L'atome le plus electronégatif
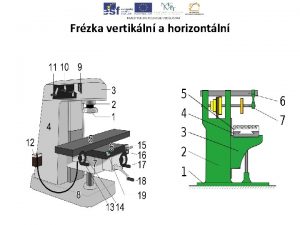
L'atome le plus electronégatif Geometrie břitu frézy
Geometrie břitu frézy Normálový a směrový vektor
Normálový a směrový vektor Eigenschaftsbegriffe geometrie
Eigenschaftsbegriffe geometrie Elipsa tvar
Elipsa tvar Formule géométrie dans l'espace
Formule géométrie dans l'espace ähnlichkeitstransformation geometrie
ähnlichkeitstransformation geometrie Darstellende geometrie matura
Darstellende geometrie matura Descartes geometrie
Descartes geometrie Průsvitka geometrie
Průsvitka geometrie Druhy čar geometrie
Druhy čar geometrie Symetrie molekul
Symetrie molekul Mol hesaplama
Mol hesaplama Struktura molekul
Struktura molekul Struktur geometri if2
Struktur geometri if2 O-dan
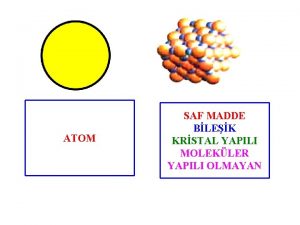
O-dan Kristal yapılı maddeler
Kristal yapılı maddeler Suatu gas yang massanya 1 95 kg pada suhu 27
Suatu gas yang massanya 1 95 kg pada suhu 27 Kromoproteid
Kromoproteid Bentuk molekul simetris dan asimetris
Bentuk molekul simetris dan asimetris Atomik yapılı element
Atomik yapılı element Ductile vs malleable
Ductile vs malleable Ekivalan nedir biyokimya
Ekivalan nedir biyokimya