Tvary molekul Mezimolekulov sly Co ovlivuje tvar molekul



- Slides: 12

Tvary molekul Mezimolekulové síly

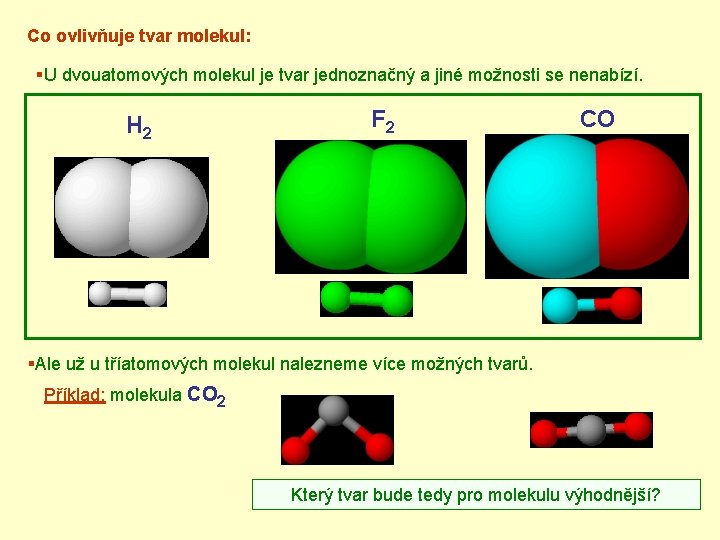
Co ovlivňuje tvar molekul: §U dvouatomových molekul je tvar jednoznačný a jiné možnosti se nenabízí. H 2 F 2 CO §Ale už u tříatomových molekul nalezneme více možných tvarů. Příklad: molekula CO 2 Který tvar bude tedy pro molekulu výhodnější?

Co ovlivňuje tvar molekul: §Víte, že se elektrony (nesoucí záporný náboj) vzájemně odpuzují. §Každá vazba i volný elektronový pár představuje určité zhuštění elektronů. §Proto zaujímá molekula takový tvar, aby tato „zhuštění“ byla co nejdále od sebe (každý vázaný atom měl co nejvíce prostoru). Příklad: molekula CO 2 Z centrálního atomu molekuly CO 2, tedy uhlíku, vychází pouze 2 dvojné vazby. O═C═O Výhodnější prostorové uspořádání proto bude LINEÁRNÍ MOLEKULA.

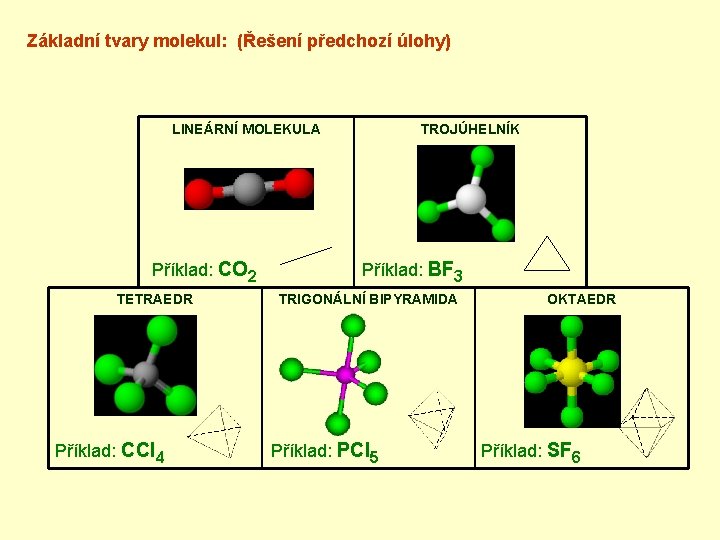
Úloha: §Sestavte modely molekul: 1)CCl 4 2)CO 2 3)PCl 5 4)BF 3 5)SF 6 §Přiřaďte tvarům molekul názvy: • LINEÁRNÍ MOLEKULA • ROVNOSTRANNÝ TROJÚHELNÍK • TETREDR (=pravidelný čtyřstěn) • TRIGONÁLNÍ BIPYRAMIDA (=trojboký dvojjehlan) • OKTAEDR (=pravidelný osmistěn) §K jednotlivým názvům si načrtněte příslušný tvar.

Základní tvary molekul: (Řešení předchozí úlohy) LINEÁRNÍ MOLEKULA Příklad: CO 2 TETRAEDR Příklad: CCl 4 TROJÚHELNÍK Příklad: BF 3 TRIGONÁLNÍ BIPYRAMIDA Příklad: PCl 5 OKTAEDR Příklad: SF 6

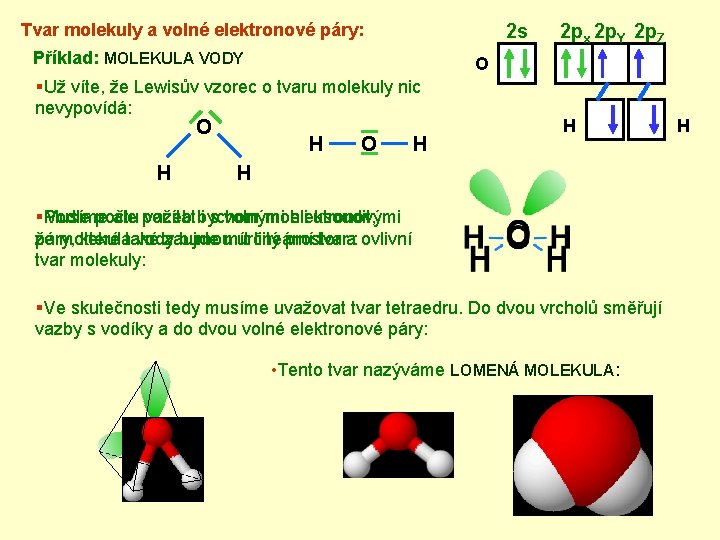
Tvar molekuly a volné elektronové páry: 2 s Příklad: MOLEKULA VODY O §Už víte, že Lewisův vzorec o tvaru molekuly nic nevypovídá: O H 2 px 2 p. Y 2 p. Z H O H H H §Musíme Podle počtu ale počítat vazeb bychom i s volnými mohli elektronovými usoudit, že molekula páry, které také vody zaujmou bude mít určitý lineární prostor tvara: ovlivní tvar molekuly: §Ve skutečnosti tedy musíme uvažovat tvar tetraedru. Do dvou vrcholů směřují vazby s vodíky a do dvou volné elektronové páry: • Tento tvar nazýváme LOMENÁ MOLEKULA: H

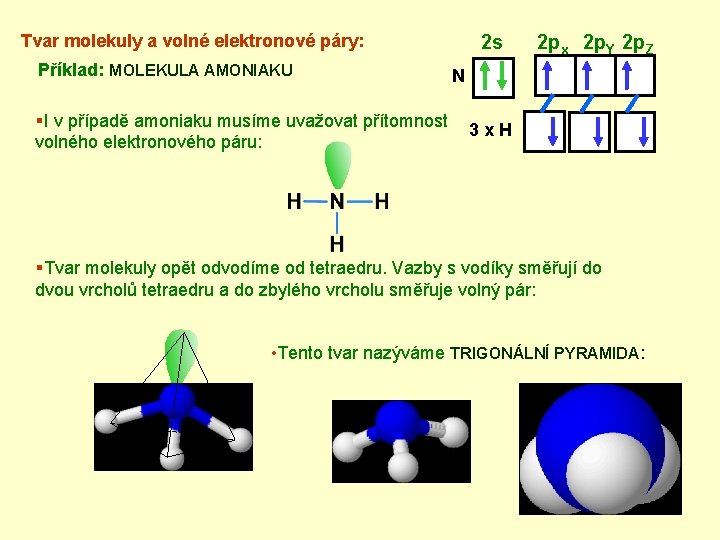
Tvar molekuly a volné elektronové páry: Příklad: MOLEKULA AMONIAKU §I v případě amoniaku musíme uvažovat přítomnost volného elektronového páru: 2 s 2 px 2 p. Y 2 p. Z N 3 x. H §Tvar molekuly opět odvodíme od tetraedru. Vazby s vodíky směřují do dvou vrcholů tetraedru a do zbylého vrcholu směřuje volný pár: • Tento tvar nazýváme TRIGONÁLNÍ PYRAMIDA:

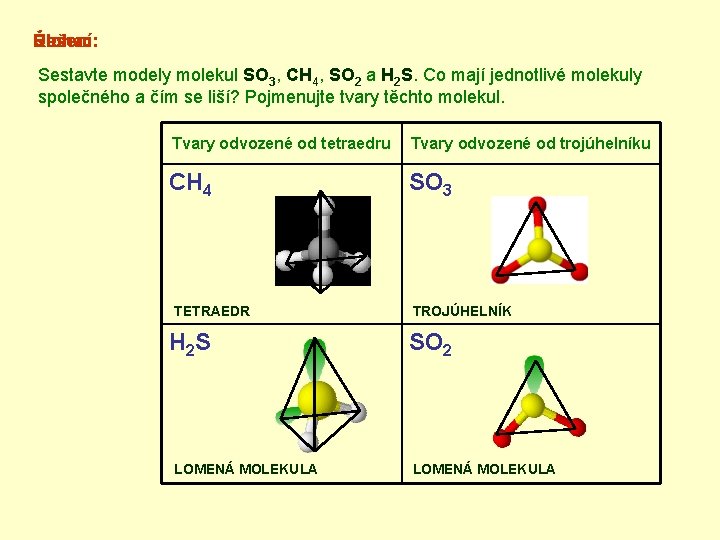
Řešení: Úloha: Sestavte modely molekul SO 3, CH 4, SO 2 a H 2 S. Co mají jednotlivé molekuly společného a čím se liší? Pojmenujte tvary těchto molekul. MODELY Tvary odvozené od tetraedru Tvary odvozené od trojúhelníku CH 4 SO 3 NÁZVY TVARY VOLNÉ PÁRY TETRAEDR H 2 S TROJÚHELNÍK SO 2 VOLNÉ PÁRY LOMENÁ MOLEKULA

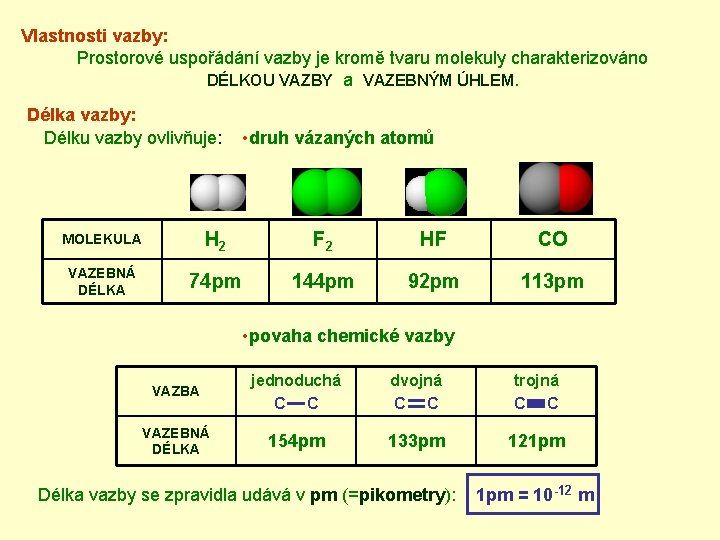
Vlastnosti vazby: Prostorové uspořádání vazby je kromě tvaru molekuly charakterizováno DÉLKOU VAZBY a VAZEBNÝM ÚHLEM. Délka vazby: Délku vazby ovlivňuje: • druh vázaných atomů MOLEKULA H 2 F 2 HF CO VAZEBNÁ DÉLKA 74 pm 144 pm 92 pm 113 pm • povaha chemické vazby VAZBA jednoduchá C C dvojná C C trojná C C VAZEBNÁ DÉLKA 154 pm 133 pm 121 pm Délka vazby se zpravidla udává v pm (=pikometry): 1 pm = 10 -12 m

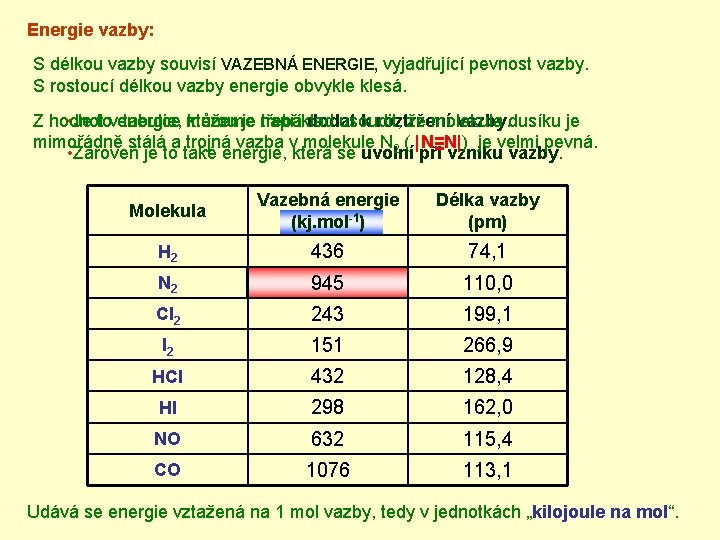
Energie vazby: S délkou vazby souvisí VAZEBNÁ ENERGIE, vyjadřující pevnost vazby. S rostoucí délkou vazby energie obvykle klesá. Z hodnot • Je tovenergie, tabulce můžeme kterou je například třeba dodat usoudit, k roztržení že molekula vazby. dusíku je mimořádně stálá a trojná vazba v molekule N 2 ( |N≡N|) je velmi pevná. • Zároveň je to také energie, která se uvolní při vzniku vazby. Molekula Vazebná energie (kj. mol-1) Délka vazby (pm) H 2 436 74, 1 N 2 945 110, 0 Cl 2 243 199, 1 I 2 151 266, 9 HCl 432 128, 4 HI 298 162, 0 NO 632 115, 4 CO 1076 113, 1 Udává se energie vztažená na 1 mol vazby, tedy v jednotkách „kilojoule na mol“.

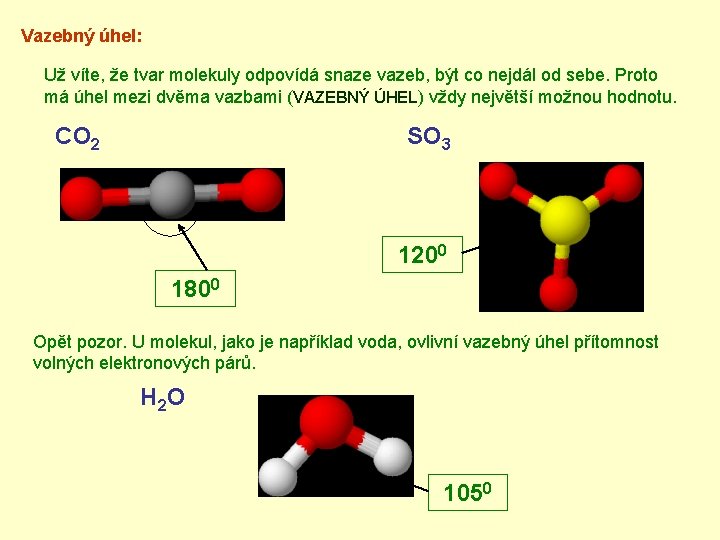
Vazebný úhel: Už víte, že tvar molekuly odpovídá snaze vazeb, být co nejdál od sebe. Proto má úhel mezi dvěma vazbami (VAZEBNÝ ÚHEL) vždy největší možnou hodnotu. CO 2 SO 3 1200 1800 Opět pozor. U molekul, jako je například voda, ovlivní vazebný úhel přítomnost volných elektronových párů. H 2 O 1050

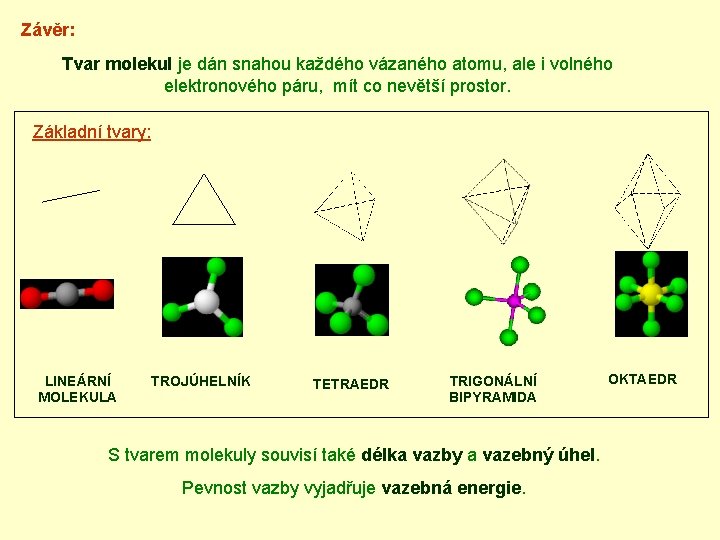
Závěr: Tvar molekul je dán snahou každého vázaného atomu, ale i volného elektronového páru, mít co nevětší prostor. Základní tvary: LINEÁRNÍ MOLEKULA TROJÚHELNÍK TETRAEDR TRIGONÁLNÍ BIPYRAMIDA S tvarem molekuly souvisí také délka vazby a vazebný úhel. Pevnost vazby vyjadřuje vazebná energie. OKTAEDR
 Hippos denotation
Hippos denotation Festooned definition lord of the flies
Festooned definition lord of the flies Lämminvesivaraajan kontaktori
Lämminvesivaraajan kontaktori Struktur vsepr
Struktur vsepr Slovesa vyjadřují svými tvary osobu
Slovesa vyjadřují svými tvary osobu Tvary slavnostních tabulí
Tvary slavnostních tabulí Kolena skloňování
Kolena skloňování Geometrické tvary básnička
Geometrické tvary básnička Ako nazyvame zakladny tvar slovies
Ako nazyvame zakladny tvar slovies Slovesné tvary
Slovesné tvary Tvary sloves
Tvary sloves Opisné tvary modálních sloves
Opisné tvary modálních sloves Kmen přítomný
Kmen přítomný