Teori Kinetik Gas Nama Anggota 1 Christina Purwaningsih



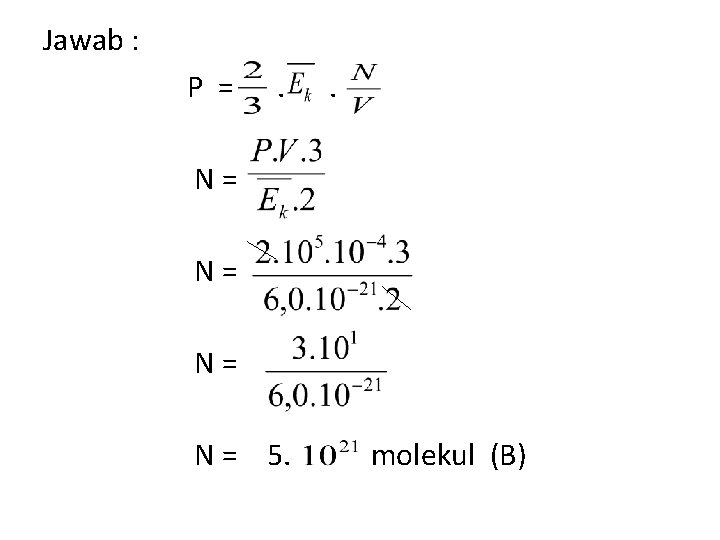











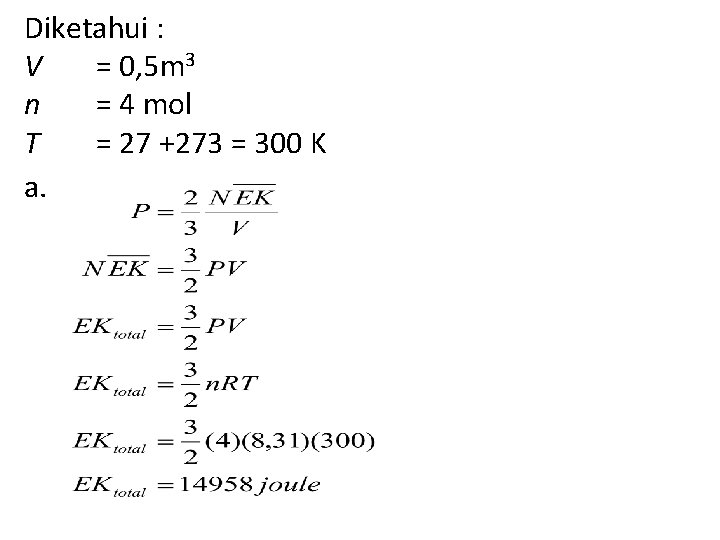




















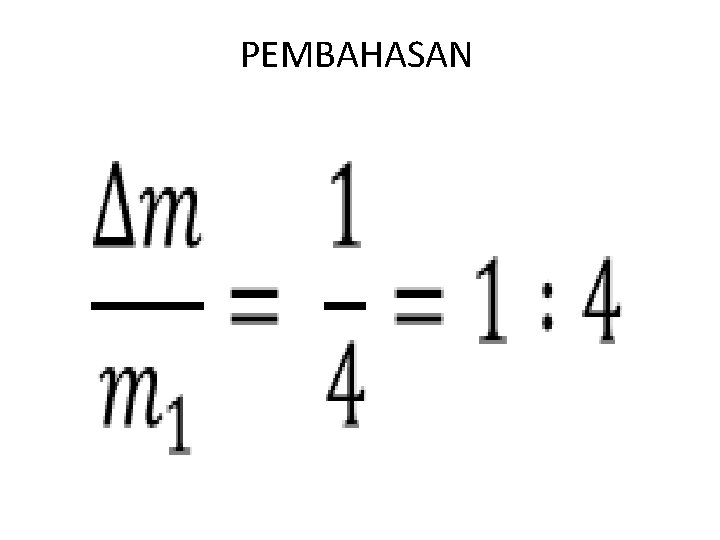
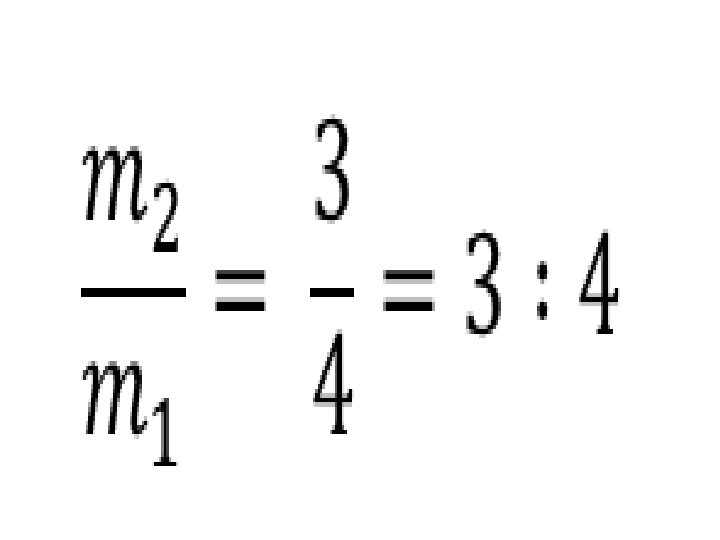


















- Slides: 60

Teori Kinetik Gas Nama Anggota : 1. Christina Purwaningsih 2. Septina Ayu Hapsari Kelas : XI IPA 4 (09) (23)

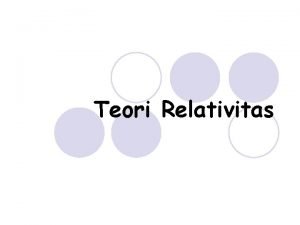
Soal 1 (Dari Buku Fisika Seribu Pena Hal 214 No. 21) Tekanan sebuah gas dalam bejana yang volumenya 100 adalah 200 k. Pa dan rata-rata energi kinetik translasi masing-masing partikel adalah 6, 0. J. Jumlah partikel gas pada bejana adalah. . a. 3. molekul b. 5. molekul c. 8. molekul d. 10. molekul e. 12. molekul

Diketahui : V = 100 = P = 200 k. Pa = 2. Pa = 6, 0 . J Ditanyakan : Jumlah partikel Gas (N) ?
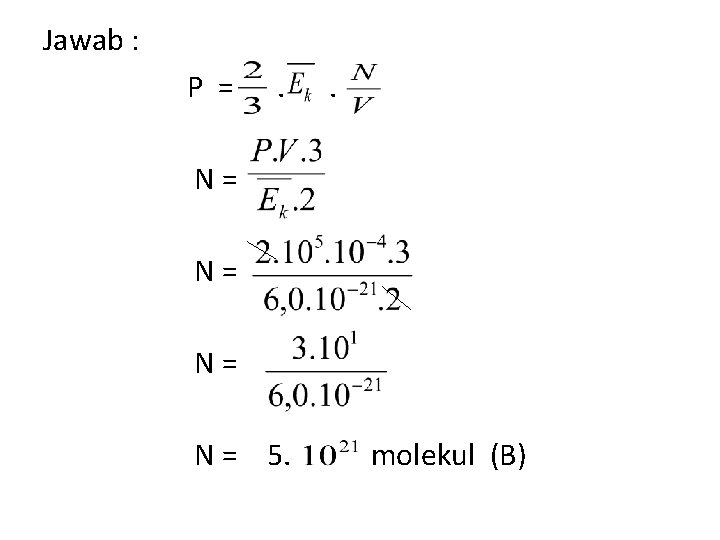
Jawab : P = . . N = 5. molekul (B)

SOAL DAN PEMBAHASAN TEORI KINETIK GAS IDEAL Nama anggota: 1. Alya Puspitasari (XI IPA 4 / 01) 2. Fitri Aryani (XI IPA 4 /15)

• Soal Massa atom relatif oksigen 16, massa sebuah atom hidrogen 1, 66 × 10 -27 kg, dan k = 1, 38 × 10 -23 J/K. Jika suhu gas 27°C , berapa kecepatan rata-rata molekul gas oksigen?

PENYELESAIAN Diketahui : T = 27°C = 273 + 27°C = 300°K Ar = 16 M(O 2) =2 × 16 =32 m = 32 × 1, 66 × 10 -27 kg = 53, 2 × 10 -27 kg k = 1, 38 × 10 -23 J/K Ditanyakan : • v. . . ?
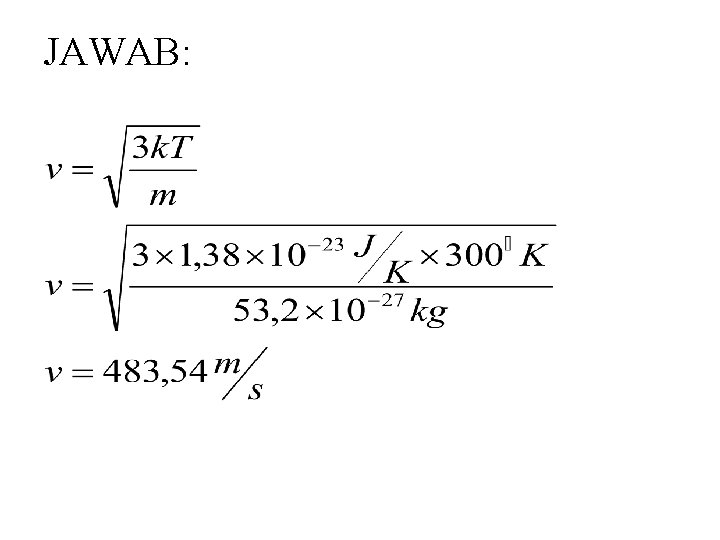
JAWAB:

Soal teori kinetik gas Andriansyah jalu B (02) Samuel rahmadi S (22) Yosua sepri A (31) XI IPA 4

SOAL •




TEORI KINETIK GAS XI IPA 4 Anggita Ratna D. Dian Permata P. (03) (11)

SOAL: Suatu gas yang massanya 1, 95 kg pada suhu 27⁰C memiliki volum 600 liter dan tekanan 5 atm. Tentukan massa molekul relatif (Mr) gas tersebut! (R = 0, 082 L atm / mol K)

DIKETAHUI : m T V P = 1, 95 kg = 1950 gram = 27 + 273 = 300 K = 600 liter = 5 atm JAWAB :

Sebuah tangki dengan volume 0, 5 m 3 mengandung 4 mol gas neon pada suhu 27⁰C. Tentukan : a. Energi kinetik total gas neon (R= 8, 31 J/mol K) b. Energi kinetik rata-rata setiap molekul gas
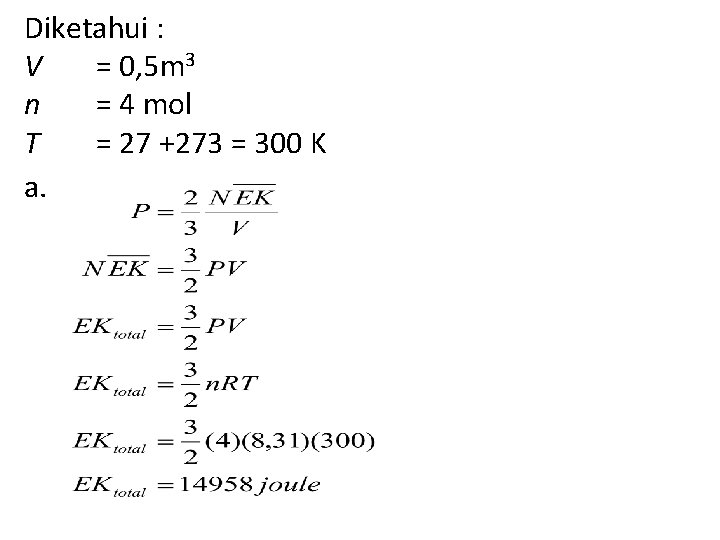
Diketahui : V = 0, 5 m 3 n = 4 mol T = 27 +273 = 300 K a.

b.

SOAL DAN PENYELESAIAN TEORI KINETIK GAS • DWI SARASWATI (12/XI IPA 4) • LINTANG NURLITHA A (17/XI IPA 4)

SOAL • Berapakah jumlah molekul oksigen per meter kubik dalam udara pada suhu dan tekanan normal (0°C dan 1 atm)?

PENYELESAIAN • Diketahui : • Ditanya: jumlah molekul oksigen per meter kubik?

• Jawab : Jadi jumlah molekul oksigen per meter kubik

SOAL dan PEMBAHASAN TEORI KINETIK GAS 1. Fabiaula Jillan M 13/XI IPA 4 2. Ufaira Septyasari 27/XI IPA 4

Sebuah tangki 1 liter diisi dengan gas ideal bermasssa 10 kg pada tekanan 4 atm, dan suhu 47 o. C. Tangki tersebut memiliki lubang kecil sehingga memungkinkan gas dapat lolos keluar. Ketika suhu 27 o. C dan tekanan gas 3 atm, massa gas yang lolos keluar dari tangki adalah. . (R=0, 082 atm L/mol K)

Diketahui : V = 1 liter m 0 = 10 kg P 0 = 4 atm T 0 = 470 C = 3200 K T 1 = 270 C = 3000 K P 1 = 3 atm R = 0, 082 atm L/mol K Ditanya: m. . . ? kg

Jawab:


• m = m 0 -m 1 m = 10 -8 m = 2 kg • Jadi massa gas yang lolos keluar dari tangki adalah 2 kg

Kelompok Fisika Bobby Lusanto Jarot Bayumurti Tetuko Lugas E. P. 08/XI IPA 4 16/XI IPA 4 24/XI IPA 4

Gas massa bermassa 4 kg bersuhu 27°C berada dalam tabung yang berlubang. 27°C 127°C Jika tabung dipanasi hingga suhu 127°C, dan pemuaian tabung diabaikan tentukan: a) Massa gas yang tersisa di tabung b) Massa gas yang keluar dari tabung c) Perbandingan massa gas yang keluar dari tabung dengan massa awal gas d) Perbandingan massa gas yang tersisa dalam tabung dengan massa awal gas e) Perbandingan massa gas yang tersisa dalam tabung

• Jawab: a) Massa gas yang tersisa di tabung

b) Massa gas yang keluar dari tabung c) Perbandingan massa gas yang keluar dari tabung dengan massa awal gas d) Perbandingan massa gas yang tersisa dalam tabung dengan massa awal gas e) Perbandingan massa gas yang keluar dari tabung dengan massa gas yang tersisa dalam tabung

Soal dan Penyelesaian Teori Kinetik Gas Tika Nur Kholifah/25/XI IPA 4 Titi Sari Indriani/26/XI IPA 4

Soal Di angkasa luar terdapat sekitar 1 atom H 2 per cm 3 pada suhu sekitar 3, 5 K. Jika massa atom H 2 adalah 1 g/mol, tentukan: a. Kelajuan efektif atom-atom H 2 itu; b. Tekanan udara pada tempat itu.

Penyelesaian Diketahui Kerapatan atom H 2 : N/V = 1 atom/m 3 = 106 atom/m 3 Suhu T = 3, 5 K M H 2 = 1 g/mol = 1 kg/kmol a. Kelajuan efektif:

b. Tekanan udara :

TEORI KINETIK GAS 1. Dellyquida Musthafa Z. 10 / XI IPA 4 2. Wisnu Pamungkas 29 / XI IPA 4

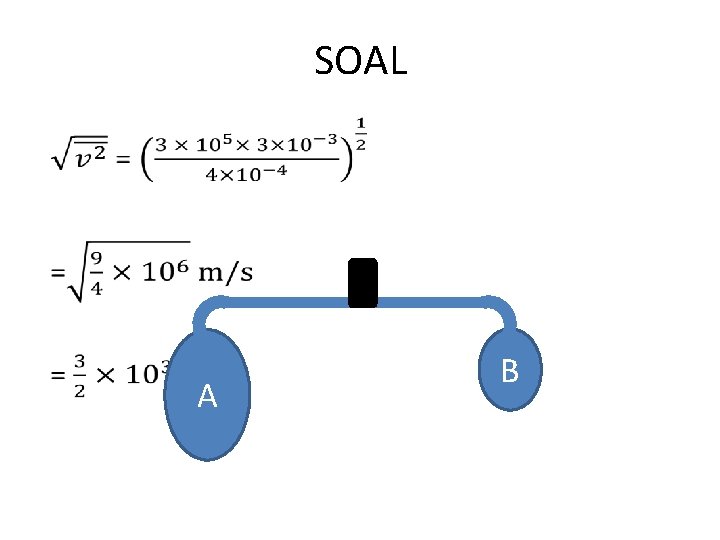
SOAL • A B
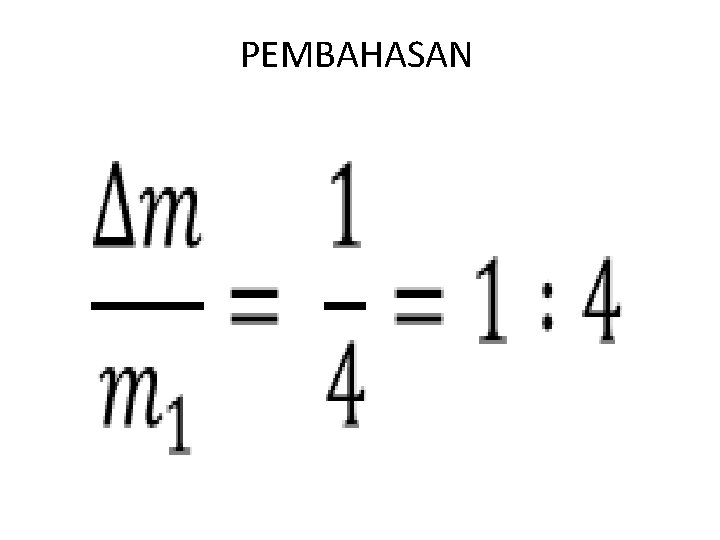
PEMBAHASAN •
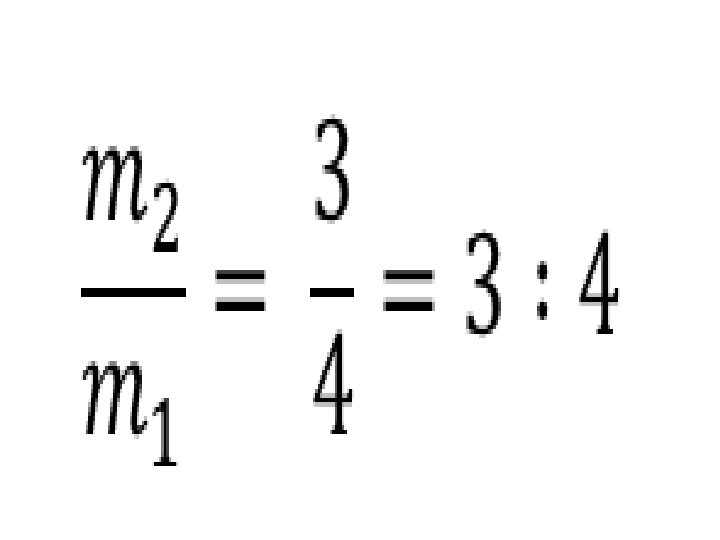

Soal dan Pembahasan Teori Kinetik Gas 1. Bima Satria Adji B. 2. Moch. Sentot Adi P. 3. Yoga Bayu Aji P. 07/XI IPA 4 18/XI IPA 4 30/XI IPA 4

Soal • Sebuah tangki diisi dengan 20 kg O 2 pada tekanan 4, 00 atm (1 atm = 105 Pa) dan suhu 47, 0 o. C. Tangki memiliki lubang kecil sehingga sejumlah O 2 dapat lolos keluar. Pada suatu hari, ketika suhu adalah 27, 0 o. C dan tekanan gas dalam tangki 3, 00 x 105 Pa, tentukan massa O 2 yang lolos keluar dari tangki.

Pembahasan • Diket : keadaan 1 (O 2 belum keluar) • Diket : keadaan 2 (O 2 sebagian keluar)

• Persamaan gas ideal, Dengan demikian

Masukkan (1) ke (2) sehingga kita peroleh, Massa oksigen yang keluar dari tangki, v Jadi, massa O 2 yang lolos dari tangki adalah 4 kg.

Soal dan pembahasan teori kinetik gas Fauzan jahid (XI ipa 4/14) Muklis tri haryanto (XI ipa 4/19)

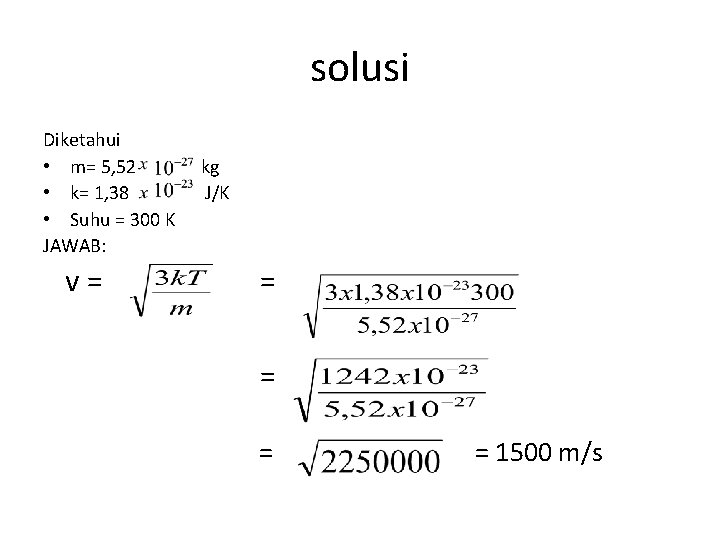
soal Tentukan Besarnya kecepatan rata-rata partikel gas jika diketahui: m= 5, 52 kg k= 1, 38 J/k. Pada suhu 300 K ditanya: • v=. . . ?

solusi Diketahui • m= 5, 52 kg • k= 1, 38 J/K • Suhu = 300 K JAWAB: v = = = 1500 m/s

SOAL dan PEMBAHASAN TEORI KINETIK GAS Apriali Sholihulail Arfan Dwi Maulana XI IPA 4 04 05

• Soal: Di angkasa luar terdapat sekitar 1 atom per pada suhu sekitar 3, 5 K. Jika massa atom adalah 1 gr/mol tentukan : a) Kelajuan efektif atom-atom itu b) Tekanan udara pada tempat itu

• Pembahasan : Diketahui : T = 3, 5 K m = 1 gr/mol Jawab : a. = 1 atom/ = atom/ = : R = 8310 J/kmol K = =29, 4 m/s Ditanya : a. b. p

b. Tekanan Udara : p. V = RT ; p = N = 1 atom, V= 1 = p = = 4, 83. Pa

Soal Fisika dan Pembahasan Nama Anggota: 1. Arini Noerma Evian (XI IPA 4/06) 2. Nurmalita Amelia N (XI IPA 4/20)

Soal 1. Energi kinetik rata-rata sebuah molekul gas monoatomik yang berada dalam tangki bervolume 30 liter dengan tekanan 1 atm adalah 2, 5 x 10 -21 J. Berapa mol gas yang berada dalam tangki tersebut, jika bilangan Avogadro 6, 02 x 1023 partikel/mol ?

Pembahasan • Diketahui: –V = 30 liter = 3. 10 -2 m 3 o. P = 1 atm = 105 Pa • Ek = 2, 5. 10 -21 J • NA = 6, 02. 1023 partikel/mol • Ditanya: n = ……mol ?

• Jawab: (i) PV k. T (ii) = N. k. T = = . k. T = . n = N = n. NA = . 2, 5. 10 -21 J = . n = 2, 99 mol.

• 2. sebuah tabung yang volumenya 1 liter , mempunyai lubang yang memungkinkan udara keluar dari tabung. Mula – mula suhu udara dalam tabung 27 o. C. Tabung dipanaskan hingga suhunya 127 o. C. Perbandingan antara massa gas yang keluar dari tabung dan massa awalnya adalah …. . • Dik : V = 1 liter T 1 = 27+ 273 = 300 K T 2 = 127 + 273 = 400 K Dit : ?

• Jawab : • (i) P. V = R. T atau m = . (ii) Dalam hal ini, sehingga m ~ adalah konstan Misal m awal gas = m 1 m akhir gas = m 2 Sehingga = = atau m 2 = m 1 Karena massa gas yang tersisa m 2= m 1, berarti telah keluar gas sebanyak m = m 1.

Dengan demikian perbandingan antara massa gas yang keluar dan massa awalnya adalah =
 Latihan soal teori kinetik gas
Latihan soal teori kinetik gas Teorema ekipartisi energi
Teorema ekipartisi energi 8 314 konstanta
8 314 konstanta Teori kinetik gas adalah
Teori kinetik gas adalah Teori kinetik gas
Teori kinetik gas Soal dan pembahasan teori kinetik gas
Soal dan pembahasan teori kinetik gas Suatu jenis gas mempunyai volume 100
Suatu jenis gas mempunyai volume 100 Phrasering+adalah
Phrasering+adalah Tuti purwaningsih
Tuti purwaningsih Kedudukan zarah subatom
Kedudukan zarah subatom Tugas kelompok dalam bahasa inggris
Tugas kelompok dalam bahasa inggris Names of group members
Names of group members Judul dan nama anggota kelompok informasi gambar informasi
Judul dan nama anggota kelompok informasi gambar informasi Judul dan nama anggota kelompok
Judul dan nama anggota kelompok Contoh sistematika laporan
Contoh sistematika laporan Aktif eha egzersizleri
Aktif eha egzersizleri Paralel levha kinetik enerji
Paralel levha kinetik enerji Paralel levha kinetik enerji
Paralel levha kinetik enerji Fotoelektrik
Fotoelektrik Hızınız 110 yavaş aq
Hızınız 110 yavaş aq Tünel kavite preparasyonu
Tünel kavite preparasyonu R sabiti
R sabiti Tenaga kinetik zarah
Tenaga kinetik zarah Tentukan dimensi dari besaran besaran berikut
Tentukan dimensi dari besaran besaran berikut Enerji potensial və kinetik enerji
Enerji potensial və kinetik enerji Materiyanın növləri
Materiyanın növləri Sistem partikel adalah
Sistem partikel adalah Doppelt reziproke auftragung
Doppelt reziproke auftragung Energi didefinisikan sebagai kemampuan untuk
Energi didefinisikan sebagai kemampuan untuk Tabel kapasitas panas (cp)
Tabel kapasitas panas (cp) Energi kinetik relativitas
Energi kinetik relativitas Kinetik enerji momentum ilişkisi
Kinetik enerji momentum ilişkisi Dönme kinetik enerjisi
Dönme kinetik enerjisi Energi kinetik
Energi kinetik Gaya konstan
Gaya konstan Energi yang dihasilkan
Energi yang dihasilkan Frasa nama + frasa nama contoh ayat
Frasa nama + frasa nama contoh ayat Nadi normal
Nadi normal Kartilej
Kartilej Silsilah anak keturunan prabu siliwangi
Silsilah anak keturunan prabu siliwangi Nama nama produk penghimpunan
Nama nama produk penghimpunan Struktur organisasi kelompok swadaya masyarakat
Struktur organisasi kelompok swadaya masyarakat Kuih kering tradisional melayu
Kuih kering tradisional melayu Kemuliaan alquran
Kemuliaan alquran Ktb kristen
Ktb kristen Guru kata nama am atau khas
Guru kata nama am atau khas Kata nama dalam frasa kerja
Kata nama dalam frasa kerja Prepare by
Prepare by Jumlah nabi dan rosul
Jumlah nabi dan rosul Kata sendi nama sehingga
Kata sendi nama sehingga Makanan tradisional melayu brunei
Makanan tradisional melayu brunei Nama2 jco
Nama2 jco 12 murid yesus dalam alkitab
12 murid yesus dalam alkitab Site:slidetodoc.com
Site:slidetodoc.com Nama kelompok yang keren
Nama kelompok yang keren Nama-nama kumpulan
Nama-nama kumpulan Garisan latitud terpanjang
Garisan latitud terpanjang Salzsa
Salzsa Arti gambar atribut pramuka
Arti gambar atribut pramuka Contoh ayat kata bilangan
Contoh ayat kata bilangan Nama nama perangkat keras komputer
Nama nama perangkat keras komputer