ESTEQUIOMETRIA MASAS ATOMICAS Escala de masa atmica Se




























- Slides: 34

ESTEQUIOMETRIA

MASAS ATOMICAS Escala de masa atómica Se define la masa del isótopo 12 C como equivalente a 12 unidades de masa atómica (u) 1 u = 1, 66054 · 10 -24 g 1 g = 6, 02214 · 1023 u De esta forma puede construirse una escala relativa de masas atómicas, que suele aparecer en la Tabla Periódica.

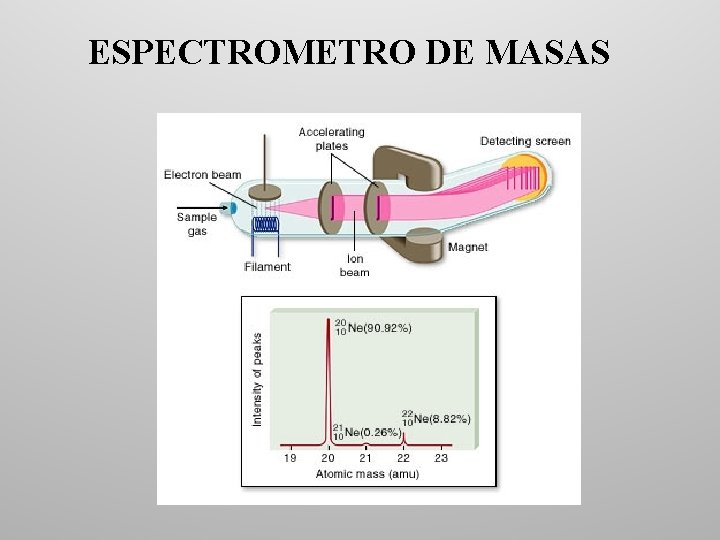
MASAS ATOMICAS Y ABUNDANCIA ISOTOPICA • El isótopo 12 C pesa 12 u, pero el carbono presenta tres isótopos en la Naturaleza: 12 C, 13 C y 14 C. • La existencia de dos o más isótopos de un mismo elemento se puede demostrar utilizando un espectrómetro de masas. • Cuando existen más de un isótopo de un elemento, la masa atómica del elemento es la media proporcional de las masas de los isótopos que lo componen: Masa Abundancia atómica (u) (%) 35 Cl 34, 97 75, 53 37 Cl 36, 97 24, 47 Luego la masa atómica del cloro es: 34, 97 · 75, 53 + 36; 97 · 24, 47 100 35, 46 u =

ESPECTROMETRO DE MASAS

NUMERO DE AVOGRADO Una muestra de cualquier elemento cuya masa en gramos sea igual a su masa atómica contiene el mismo número de átomos NA, independientemente del tipo de elemento. A este número se le conoce como Número de Avogadro NA = 6, 022 · 1023 H: 1, 008 g contienen NA = 6, 022 · 1023 átomos de H He: 4, 003 g contienen NA = 6, 022 · 1023 átomos de He S: 32, 07 g contienen NA = 6, 022 · 1023 átomos de S

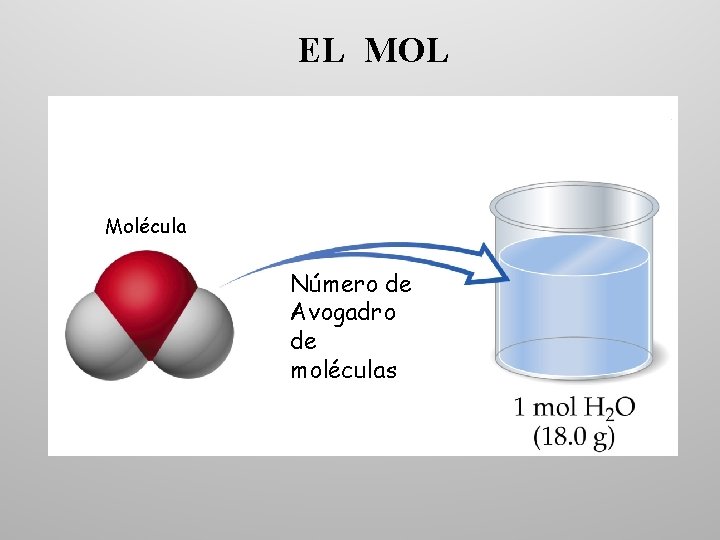
EL MOL Molécula Número de Avogadro de moléculas

EL MOL Un mol es la cantidad de cualquier sustancia que contiene el Número de Avogadro de entidades elementales (átomos, moléculas, iones o electrones) de esa sustancia: Un mol de He 6, 022 · 1023 átomos de He Un mol de H 2 O 6, 022 · 1023 moléculas de H 2 O Un mol de CH 4 6, 022 · 1023 moléculas de CH 4 La masa molecular es igual a la suma de las masas (en u) de los átomos de la fórmula de dicha sustancia: Masa molecular H 2 SO 4 = 2(1, 0 u)H + (32, 0 u)S + 4(16, 0 u)O = 98, 0 u/molécula Como 1 mol contiene 6, 02 · 1023 moléculas y 1, 0 g = 6, 02 · 1023 u Masa de un mol de H 2 SO 4 = 98 u/molécula · 6, 02 · 1023 moléculas/mol = 98 g/mol

CONVERSIONES MASA-CANTIDAD DE SUSTANCIA Para convertir en cantidad de sustancia (n) la masa (m) de cualquier sustancia sólo hay que dividir por la masa molar (M) de dicha sustancia: n= m M ¿Qué cantidad de sustancia hay en 24, 5 gramos de ácido sulfúrico (H 2 SO 4)? Ya sabemos que la masa molar (M) es 98, 0 g/mol, por lo que 24, 5 g de H 2 SO 4 1, 00 mol de H 2 SO 4 98, 0 g de H 2 SO 4 = 0, 25 mol de H 2 SO 4

COMPOSICION CENTESIMAL Esta magnitud especifica los porcentajes en masa de cada uno de los elementos presentes en un compuesto. masa del elemento % elemento = · 100 masa total del compuesto Ejemplo: H 2 SO 4 M (Masa molar) = 98 g/mol H = 2 mol · 1, 0 g/mol = 2, 0 g O = 4 mol · 16 g/mol = 64 g %H= %O= 2, 0 98 64 · 100 = 2, 04 % de H · 100 = 65, 3 % de O 98 S = 1 mol · 32 g/mol = 32 g %S= 32 98 · 100 = 32, 7 % de S

FORMULA EMPIRICA A partir de la composición de un compuesto (que puede obtenerse mediante un analizador elemental), es posible deducir su fórmula más simple, o fórmula empírica, que es una relación simple de números entre los átomos que lo componen. Ejemplo: calcular la fórmula empírica para un compuesto que contiene 6. 64 g de K, 8. 84 g de Cr y 9. 52 g de O. a) Se calcula el número de moles de cada elemento: b) y se divide por el menor número de moles 6, 64 g de K · 1 mol de K 39, 1 g de K = 0, 170 mol de K/ 0, 170 mol K = 1 mol K /mol K 8, 84 g de Cr · 1 mol de Cr = 0, 170 mol de Cr / 0, 170 mol K 52, 0 g de Cr = 1 mol Cr /mol K 9, 52 g de O · 1 mol de O = 0, 595 mol de O / 0, 170 mol K 16, 0 g de O = 3, 5 mol O /mol K 1 K : 1 Cr: 3, 5 O 2 K: 2 Cr: 7 O K 2 Cr 2 O 7

FORMULA MOLECULAR La fórmula empírica no tiene necesariamente que coincidir con la fórmula molecular. Por ejemplo, la fórmula empírica del benceno es CH, que no tiene correspondencia con ninguna molécula real, mientras que su fórmula molecular es C 6 H 6. “CH” C 6 H 6 fórmula molecular fórmula empírica Para poder calcular la fórmula molecular es preciso conocer la fórmula empírica y la masa molar de la sustancia. Ejemplo: la fórmula empírica de la glucosa es CH 2 O, y su masa molar es 180 g/mol. Escribir su fórmula molecular. Fórmula molar = (CH 2 O)n Masa CH 2 O = 12 + 16 = 30, n= 180 g/mol glucosa 30 g de CH 2 O =6 (CH 2 O)6 C 6 H 12 O 6

ESCRITURA DE ECUACIONES QUIMICAS n Una ecuación química debe contener: • Todos los reactivos • Todos los productos • El estado físico de las sustancias • Las condiciones de la reacción Ca. CO 3 D (s) Ca. O (s) + CO 2 (g)

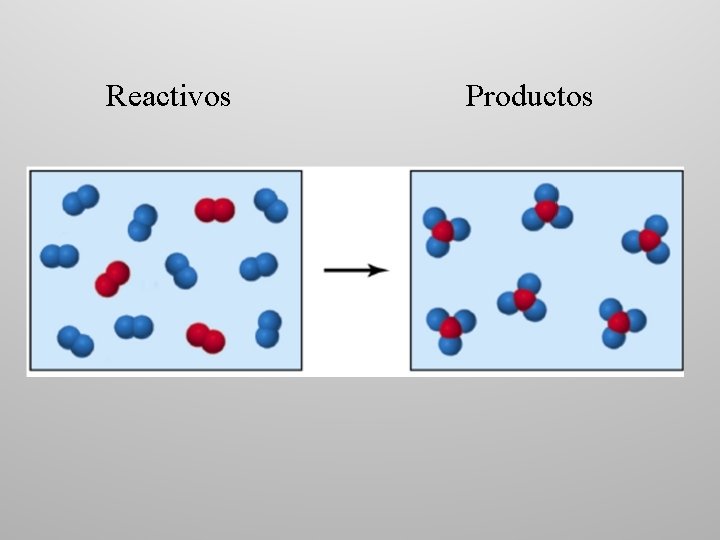
Reactivos Productos

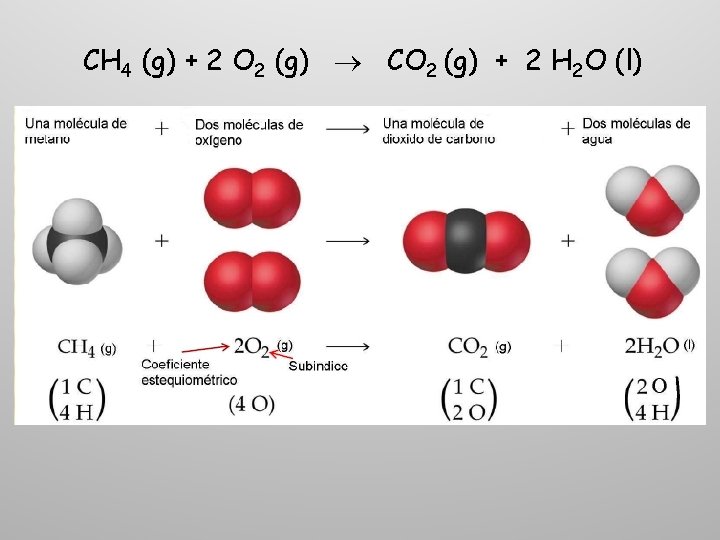
CH 4 (g) + 2 O 2 (g) CO 2 (g) + 2 H 2 O (l)



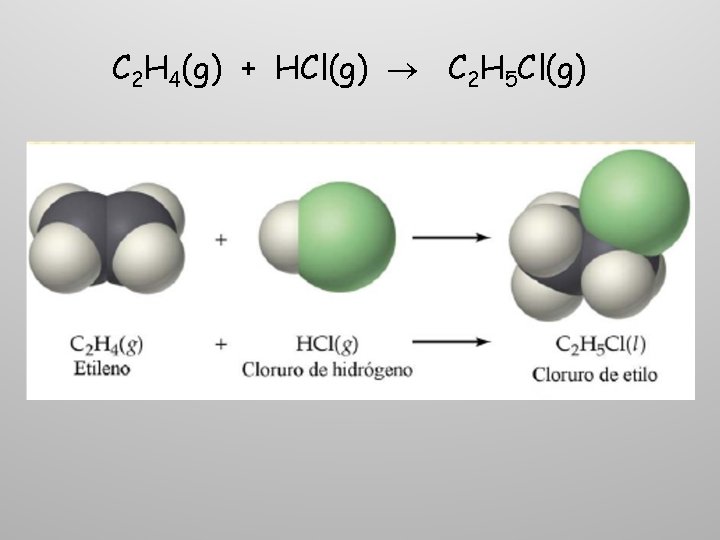
C 2 H 4(g) + HCl(g) C 2 H 5 Cl(g)

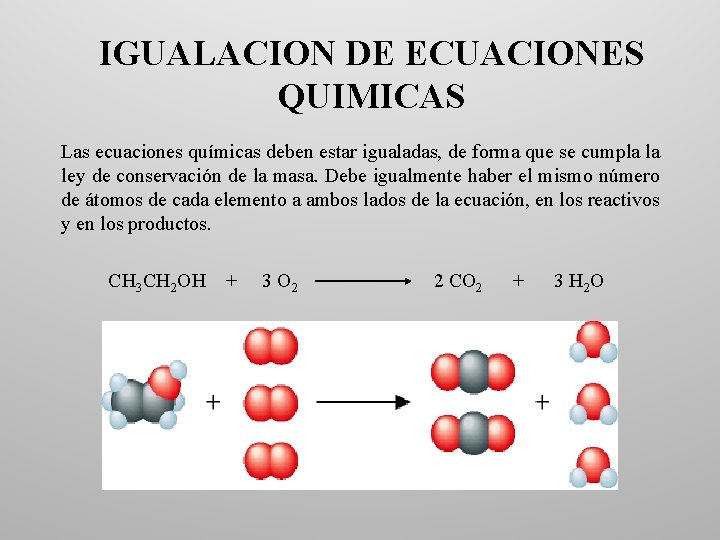
IGUALACION DE ECUACIONES QUIMICAS Las ecuaciones químicas deben estar igualadas, de forma que se cumpla la ley de conservación de la masa. Debe igualmente haber el mismo número de átomos de cada elemento a ambos lados de la ecuación, en los reactivos y en los productos. CH 3 CH 2 OH + 3 O 2 2 CO 2 + 3 H 2 O

RELACIONES DE MASAS DE LAS ECUACIONES - - - 4 Fe + 3 O 2 2 Fe 2 O 3 Los coeficientes de una ecuación química representan el número de moléculas o las cantidades de reactivos y productos. Así, 4 mol de Fe reaccionan con 3 mol de O 2 para dar 2 mol de Fe 2 O 3. Dichos coeficientes en una ecuación igualada pueden emplearse como factores de conversión para calcular la cantidad de producto formada o la de reactivo consumida. Ejemplo: ¿Qué cantidad de Fe 2 O 3 se producirán a a partir de… 4 mol de Fe? 2 2 mol de Fe? 1 8 mol de Fe? 4 1 mol de Fe? 0, 5

¿Qué cantidad de H 2 SO 4 se necesita para producir 8, 0 mol de Al 2(SO 4)3? 2 Al(OH)3 + 3 H 2 SO 4 6 H 2 O + Al 2(SO 4)3 ¿Qué cantidad de H 2 O se obtendrá a partir de 156 g de Al(OH)3 ?

RELACIONES DE MASA DE LAS ECUACIONES ¿Qué masa de Al(OH)3 reaccionará con 59 g de H 2 SO 4? 2 Al(OH)3 + 3 H 2 SO 4 6 H 2 O + Al 2(SO 4)3

REACTIVO LIMITANTE Al llevar a cabo una reacción química, los reactivos pueden estar o no en la proporción exacta que determinan sus coeficientes estequiométricos. Si se parte de una mezcla de productos que no es la estequiométrica, entonces el que se halla en menor cantidad se denomina reactivo limitante, pues la reacción sólo tendrá lugar hasta que se consuma éste, quedando el otro (u otros) reactivo en exceso. 2 H 2(g) + O 2(g) 2 H 2 O(l)


Ejercicio: Se tratan 40, 0 g de óxido de aluminio, con suficiente disolución de ácido sulfúrico en agua para que reaccione todo el óxido de aluminio y se forme sulfato de aluminio y agua. Calcula la cantidad del ácido que se necesita y la masa de sulfato que se forma. Al 2 O 3 + 3 H 2 SO 4 Al 2(SO 4)3 + 3 H 2 O

Ejemplo: Calcula el volumen de dióxido de carbono que se desprenderá al quemar 1 kg de butano (C 4 H 10) a) en condiciones normales b) a 5 atm y 50ºC. 2 C 4 H 10 + 13 O 2 8 CO 2 + 10 H 2 O


Ejercicio: En la descomposición térmica del clorato de potasio en cloruro de potasio y oxígeno ¿Qué volumen de oxígeno medido a 19ºC y 746 mm Hg se obtendrá a partir de 7, 82 g de clorato de potasio? 2 KCl. O 3 2 KCl + 3 O 2

RENDIMIENTO TEORICO La cantidad máxima que puede obtenerse de un determinado producto en una reacción química se denomina Rendimiento Teórico. Se calcula a partir de los coeficientes estequiométricos de una ecuación química y de las masas y/o cantidades de reactivos empleadas. ¿Cuál es el rendimiento teórico de sulfato de aluminio a partir de 39 g de hidróxido de aluminio? 2 Al(OH)3 + 3 H 2 SO 4 6 H 2 O + Al 2(SO 4)3

RENDIMIENTO TEORICO Y REACTIVO LIMITANTE ¿Qué sucede si existe un reactivo limitante? 2 Sb(g) + 3 I 2(s) 2 Sb. I 3(s) Si se hacen reaccionar 1, 2 mol de Sb y 2, 4 mol de I 2, ¿cuál será el rendimiento teórico? REACTIVO LIMITANTE ES Sb Sólo hay 1, 2 mol

RENDIMIENTO EXPERIMENTAL. RENDIMIENTO PORCENTUAL El Rendimiento Teórico es una cantidad máxima, que en muchas ocasiones no se alcanza, pues las reacciones químicas no siempre se completan. Por ello, la cantidad de producto obtenida experimentalmente (esto es, medida tras realizar el experimento en el laboratorio) suele ser menor que la calculada teóricamente. Por ello, se define el Rendimiento Porcentual como el cociente entre la cantidad de producto obtenida (rendimiento experimental) y el rendimiento teórico. Rendimiento porcentual = Cantidad de producto experimental Cantidad de producto Teórico · 100

Si la metilamina CH 3 NH 2 se trata con ácido ocurre la siguiente reacción: CH 3 NH 2(ac) + H+(ac) CH 3 NH 3+(ac) Cuando 3, 0 g de metilamina reaccionan con 0, 1 mol de H+, se producen 2, 6 g de CH 3 NH 3+. Calcular los rendimientos teórico y porcentual. Rendimiento teórico: El reactivo limitante es la metilamina


Problema: Se hacen reaccionar 22, 75 g de Zn que contiene un 7, 25 % de impurezas con HCl suficiente. Calcula la masa de H 2 desprendida. Zn + 2 HCl Zn. Cl 2 + H 2

Ejemplo: Calcular el volumen de la disolución 0, 1 M de Ag. NO 3 que se necesita para reaccionar exactamente con 100 m. L de Na 2 S 0, 1 M. 2 Ag. NO 3 + Na 2 S Ag 2 S + Na. NO 3 Se puede calcular usando m. L porque los factores de conversión de m. L a L se simplifican.
 Masa atomica absoluta
Masa atomica absoluta Relacion molar
Relacion molar Tabla de disyuncion
Tabla de disyuncion Teorias atomicas
Teorias atomicas Normalidad redox
Normalidad redox Acido acetico
Acido acetico El numero de avogadro
El numero de avogadro Estequiometria
Estequiometria Estequiometria quimica
Estequiometria quimica Tableau de conversion mol
Tableau de conversion mol Conclusion de estequiometria
Conclusion de estequiometria A palavra estequiometria do grego
A palavra estequiometria do grego Atmica
Atmica Atmica
Atmica Atmica
Atmica Atmica
Atmica Atmica
Atmica Comisin
Comisin Atmica
Atmica Atmica
Atmica Ejercicios de m/m
Ejercicios de m/m Perkembangan hardware
Perkembangan hardware Pendidikan masa kini dan masa depan
Pendidikan masa kini dan masa depan Relativna molekulska masa
Relativna molekulska masa Solucion
Solucion Masa molar molecular
Masa molar molecular Perkembangan mobil dari masa ke masa
Perkembangan mobil dari masa ke masa Perkembangan desain dari masa ke masa
Perkembangan desain dari masa ke masa Mūru graujamā ierīce
Mūru graujamā ierīce Masas polares alternador
Masas polares alternador Radiologiassistant
Radiologiassistant Masa
Masa Argumento confianza del emisor ejemplos
Argumento confianza del emisor ejemplos Dinámica de las masas fluidas
Dinámica de las masas fluidas Tipos de mass
Tipos de mass