ESTRUCTURA ATMICA FUNDAMENTOS PROPIEDADES PERIODICAS DE DE LA


























- Slides: 39

ESTRUCTURA ATÓMICA • FUNDAMENTOS • PROPIEDADES PERIODICAS DE DE LA TEORIA LOS ELEMENTOS ATÓMICA • MODELOS ATÓMICOS • ESTRUCTURA ATÓMICA

EL CONCEPTO DE ÁTOMO Los filósofos atomistas: l l l Demócrito de Abdera (460 - 360 AC), Epicuro de Samos (341 - 270 AC), Tito Lucrecio (98 - 54 AC). Como tantos otros conceptos griegos, el del átomo lo desarrollan en base a la lógica y la argumentación y no a la experimentación

EL CONCEPTO DE ÁTOMO l La idea de que el mundo que nos rodea está constituido de una gran cantidad de partículas infinitesimales e idénticas llamadas moléculas, y que a su vez esta inmensa cantidad de diferentes moléculas son simplemente diferentes arreglos de grupos de átomos, no tiene más de 150 años.

EL CONCEPTO DE ÁTOMO l l La materia no puede ser subdividida infinitamente. Las propiedades de la sustancias no son las de sus átomos, sino la de la forma cómo estos se combinan. Los átomos están en constante movimiento. Los átomos están separados entre si por el vacío, en el cual se mueven.

LA MICROESTRUCTURA DEL ÁTOMO l l La conducción eléctrica a través de los gases. Radiactividad. Espectroscopía Rayos-X.

ESTRUCTURA ATOMICA DE LA MATERIA Enunciados de Dalton: • Todo elemento está compuesto de átomos. • Todos los átomos de un mismo elemento son iguales. • Elementos diferentes tienen átomos con propiedades diferentes. • Los compuestos están formados por átomos de más de un elemento. • Los átomos no se cambian por tipos diferentes de átomos por reacciones químicas. Se reordenan

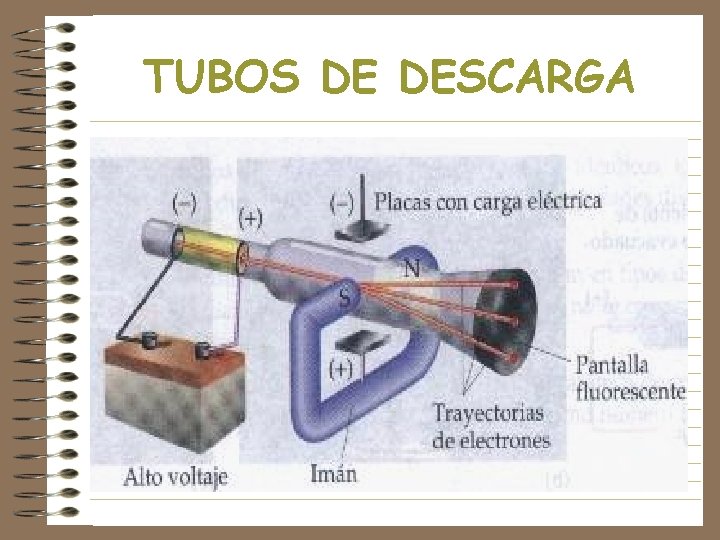
TUBOS DE DESCARGA Crooks & Thomson • Cátodo: Polo negativo conectado a la corriente • Anodo: Polo positivo, cierra el circuito • Un gas a muy baja presión entre ellos •

CARGA ELECTRICA • Es una de las propiedades primarias de la materia, como lo es la masa. • Los objetos con carga eléctrica interactúan entre si. • Existe una fuerza eléctrica y un campo eléctrico • Experimentaron descomponiendo sustancias con corriente eléctrica

TUBOS DE DESCARGA

RAYOS CATÓDICOS

EL ELECTRON • Tubo de descarga de Thomson • Las partículas de los rayos catódicos interactuaban con un campo eléctrico (que desvía la pantalla hacia arriba) y otro magnético que actuaba en sentido contrario • Cuando las magnitudes de ambas fuerzas se igualaban la trayectoria era rectilínea

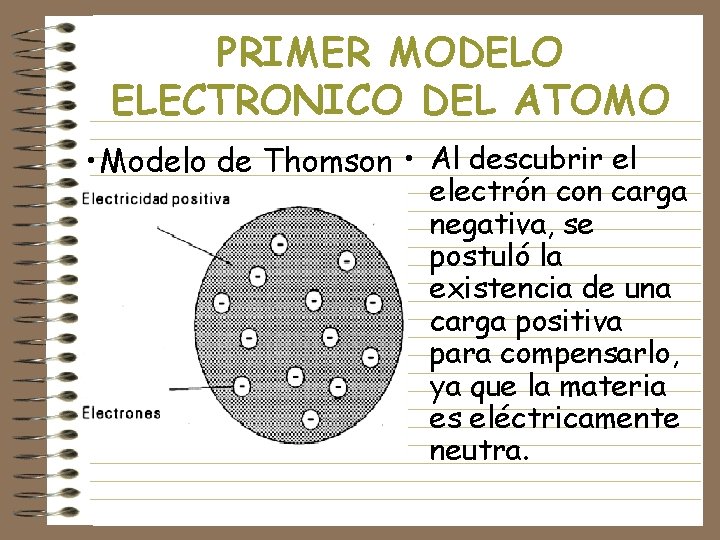
PRIMER MODELO ELECTRONICO DEL ATOMO • Modelo de Thomson • Al descubrir el electrón con carga negativa, se postuló la existencia de una carga positiva para compensarlo, ya que la materia es eléctricamente neutra.

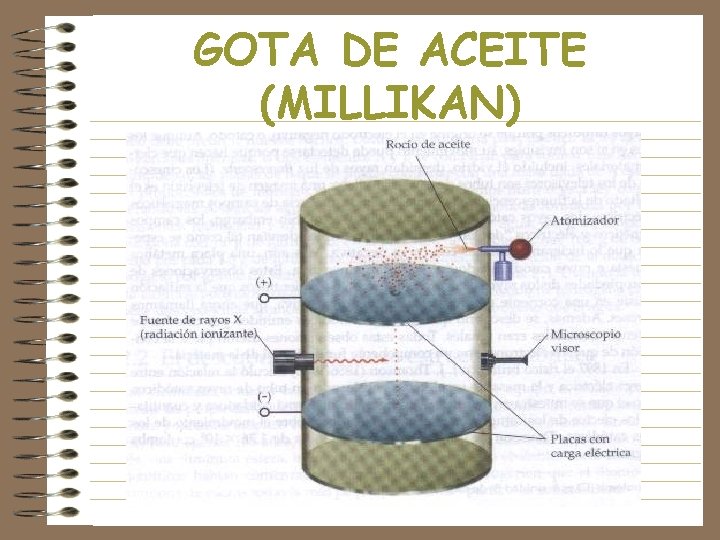
GOTA DE ACEITE (MILLIKAN) Los rayos X dan carga negativa. Al aumentar voltaje, aumenta la carga y caen lento. A un voltaje determinado la fuerza eléctrica y gravitacional se igualan. Conociendo el voltaje y la masa de la gota, se conoce la carga.

GOTA DE ACEITE (MILLIKAN)

EL ELECTRON • Las partículas de los rayos tienen carga negativa, -e, y masa, m. • Relación e/m = 1. 759 x 1011 • La relación entre e/m del hidrogeno era 2000 veces mayor al de las partículas. • O sea, la partícula (electrón) era 2000 veces mas ligera que el H, o tenía 2000 veces mas carga.

RAYOS X

RAYOS EMITIDOS

COMPORTAMIENTO DE 38 , ,

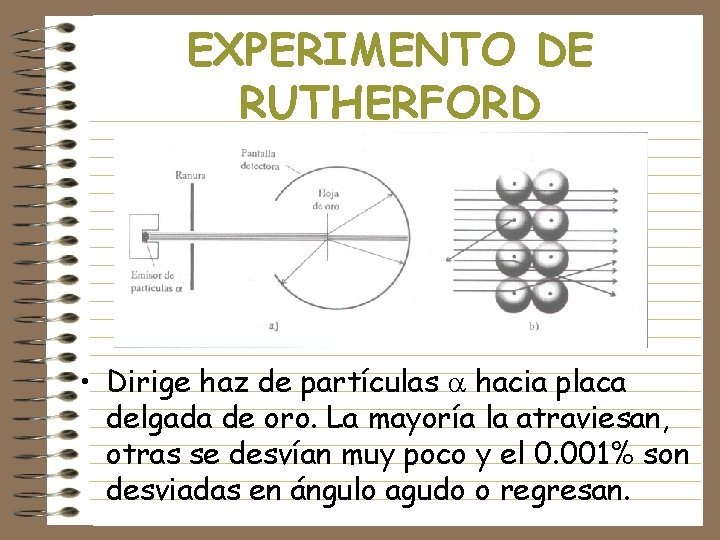
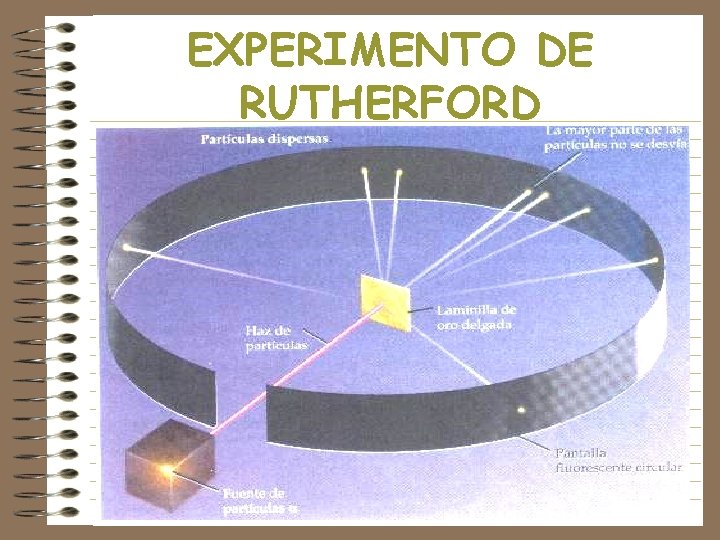
EXPERIMENTO DE RUTHERFORD • Dirige haz de partículas hacia placa delgada de oro. La mayoría la atraviesan, otras se desvían muy poco y el 0. 001% son desviadas en ángulo agudo o regresan.

EXPERIMENTO DE RUTHERFORD

HIPOTESIS NUCLEAR DE RUTHERFORD • El átomo tiene espacio vacío • Tiene un campo eléctrico muy intenso en una zona muy reducida de espacio que hace posible el rebote de algunas partículas . • Propuso la existencia del protón y del neutrón. • Pero fue Chadwick en 1932 quien probó que la relación He: H es 4: 1

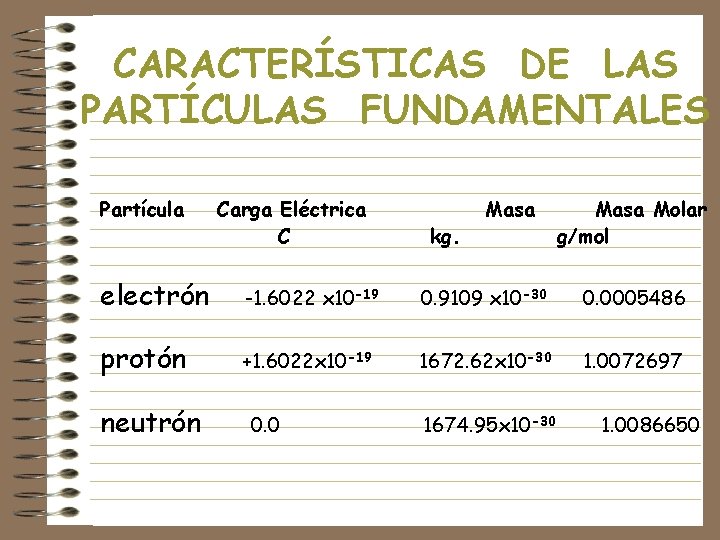
CARACTERÍSTICAS DE LAS PARTÍCULAS FUNDAMENTALES Partícula Carga Eléctrica C kg. Masa Molar g/mol electrón -1. 6022 x 10 -19 0. 9109 x 10 -30 0. 0005486 protón +1. 6022 x 10 -19 1672. 62 x 10 -30 1. 0072697 neutrón 0. 0 1674. 95 x 10 -30 1. 0086650

MODELO DE RUTHERFORD

850 – 950°C ESTRUCTURA ELECTRONICA 1050 – 1150°C 1450 – 1550°C

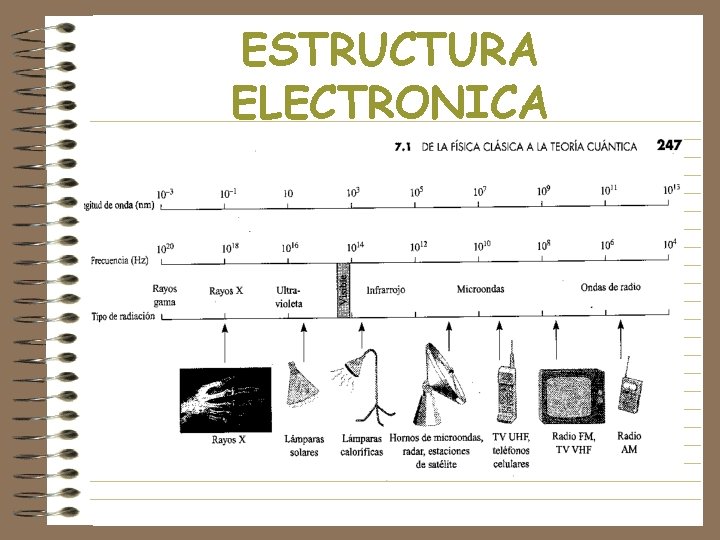
ESTRUCTURA ELECTRONICA • Los cuerpos calientes emiten radiación electromagnética. • Los cuerpos calientes despiden rayos infrarrojos. • Un cuerpo a muy alta temperatura se pone rojo porque emite luz roja. • Si la temperatura sube más, el cuerpo se pone incandescente y emite luz blanca.

ESTRUCTURA ELECTRONICA

TEORIA DE M. PLANCK • Los cuerpos del microcosmos (electrones, nucleones, átomos y moléculas) absorben y emiten luz de manera discontinua, en pequeños paquetes de energía llamados cuantos de energía (latín QUANTUM “cantidad elemental”

LA LUZ Y LOS FOTONES • Einstein, basado en la teoría de Planck, lanzo la hipótesis de que la luz estaba formada por corpúsculos, que luego fueron llamados fotones, con energía E=hv • Esto explicaba el fenómeno fotoeléctrico (el desprendimiento de electrones de la superficie de un metal que se ilumina con luz de alta frecuencia.

LA LUZ Y LOS FOTONES

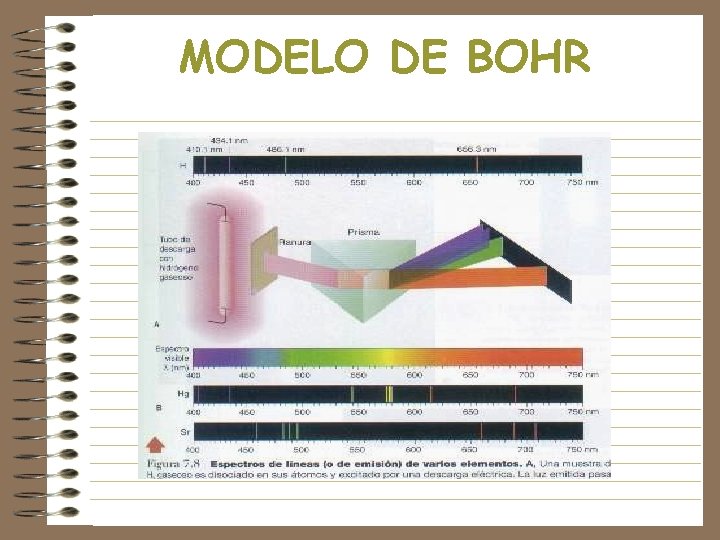
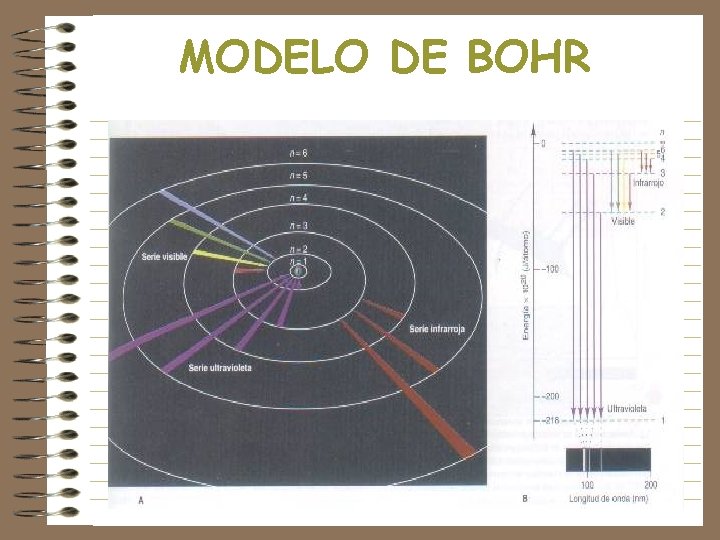
MODELO DE BOHR • Los electrones en los átomos presentan solo ciertos niveles energéticos estables • Basado en la teoría de Planck, encontró que solo ciertas órbitas eran factibles, con r=0. 529 n 2, donde r=radio atómico y n=número cuántico principal • Concluyó que la energía de los electrones en el átomo no pueden tomar cualquier valor. • En la órbita n caben 2 n 2 electrones

MODELO DE BOHR

MODELO DE BOHR

MODELO DE SOMMERFELD

EVOLUCION DEL MODELO ATOMICO

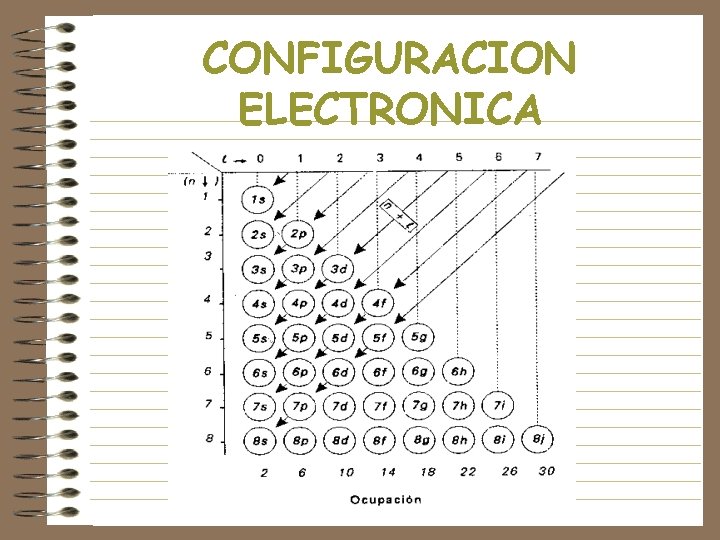
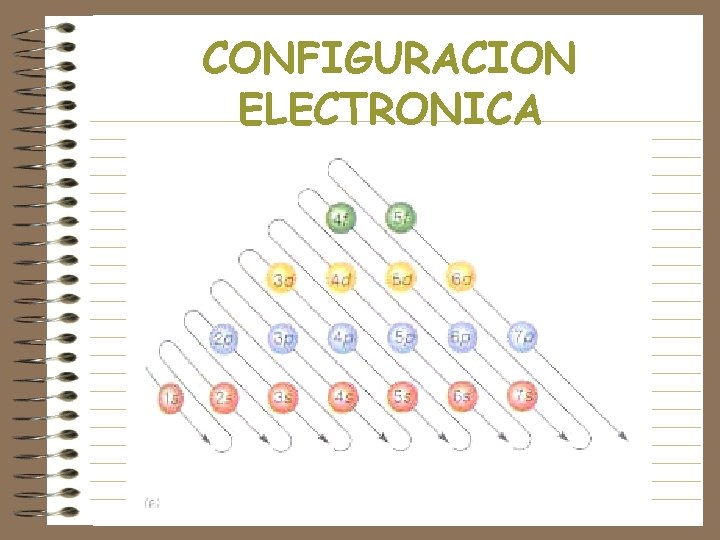
NÚMEROS CUÁNTICOS • n, principal, se refiere a la energía de las órbitas, o los niveles energéticos y al tamaño do órbita • l , orbital, se refiere a un subnivel energético, cuando hablamos de una órbita especifica • ml, magnético, se refiere a la orientación del orbital • ms, spin, se refiere al movimiento de rotación del electrón

NÚMEROS CUÁNTICOS

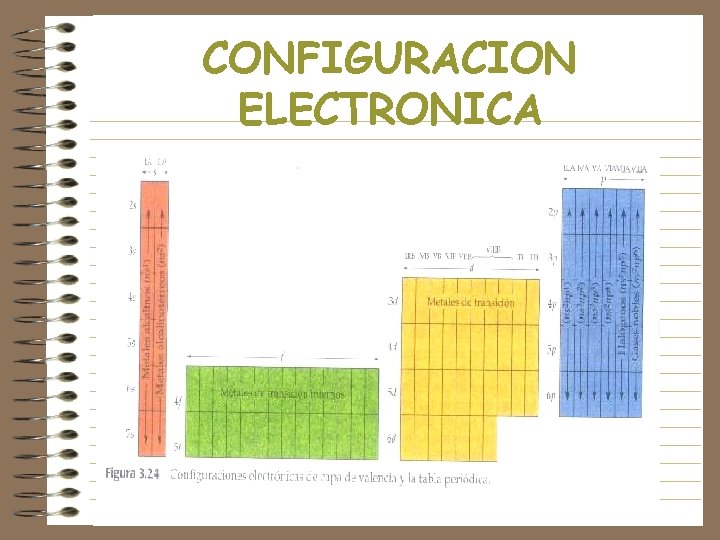
CONFIGURACION ELECTRONICA

CONFIGURACION ELECTRONICA

CONFIGURACION ELECTRONICA
 Propiedades periodicas
Propiedades periodicas Ejercicios de radio atómico
Ejercicios de radio atómico Radio atomico
Radio atomico Cuadro comparativo de las propiedades periódicas
Cuadro comparativo de las propiedades periódicas Atmica
Atmica Las partículas fundamentales del átomo son
Las partículas fundamentales del átomo son Atmica
Atmica Atmica
Atmica Masa atomica absoluta
Masa atomica absoluta Atmica
Atmica Comisin
Comisin Relacion molar
Relacion molar Atmica
Atmica Atmica
Atmica Fundamentos del diseño estructura
Fundamentos del diseño estructura Ondas no periodicas
Ondas no periodicas Movimento de reflexão
Movimento de reflexão Ondas periodicas definicion
Ondas periodicas definicion Sociedad finisecular
Sociedad finisecular 10log102
10log102 Tratado del salitre
Tratado del salitre Ejemplos de fracciones periodicas puras
Ejemplos de fracciones periodicas puras Leyes periodicas
Leyes periodicas Fundamento del comportamiento individual
Fundamento del comportamiento individual Fundamentos de economia
Fundamentos de economia Fundamentos ecologicos
Fundamentos ecologicos Gilberto cotrim mirna fernandes fundamentos de filosofia
Gilberto cotrim mirna fernandes fundamentos de filosofia Fundamentos de las pruebas de software
Fundamentos de las pruebas de software Mapa frentes geopoliticos de venezuela
Mapa frentes geopoliticos de venezuela 6yueqeozkae -site:youtube.com
6yueqeozkae -site:youtube.com Significado de etica cristiana
Significado de etica cristiana Fundamentos da linguagem visual
Fundamentos da linguagem visual Los fundamentos de handball
Los fundamentos de handball Fundamentos do grego bíblico william mounce
Fundamentos do grego bíblico william mounce Codigo de etica psicopedagogo
Codigo de etica psicopedagogo Fundamentos de los sistemas operativos
Fundamentos de los sistemas operativos Fundamentos de javascript
Fundamentos de javascript Cuál es el objetivo de baloncesto
Cuál es el objetivo de baloncesto Fundamentos de arquitectura de computadoras
Fundamentos de arquitectura de computadoras Fundamentos de redes de computadores
Fundamentos de redes de computadores