TEMA 4 EL TOMO 1 2 3 4



- Slides: 13

TEMA 4: EL ÁTOMO 1. 2. 3. 4. 5. 6. 7. La materia está formada por átomos La naturaleza eléctrica de la materia Los primeros modelos atómicos ¿Cómo se identifican los átomos? Los nuevos modelos atómicos Cómo dibujar átomos Radiactividad

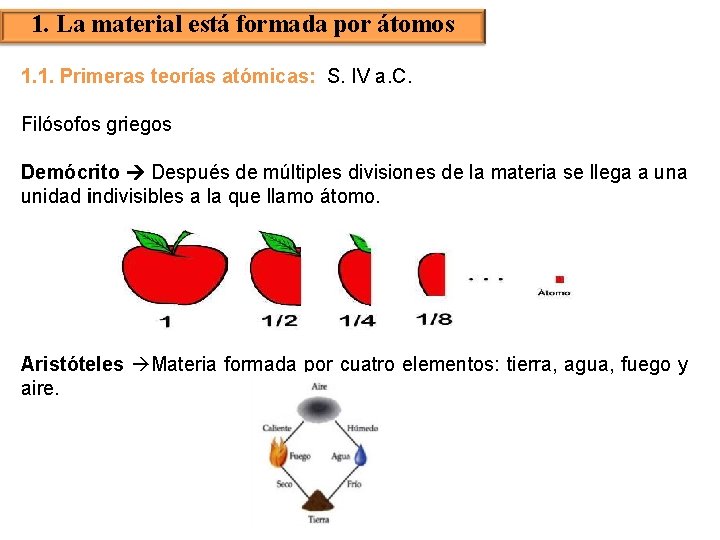
1. La material está formada por átomos 1. 1. Primeras teorías atómicas: S. IV a. C. Filósofos griegos Demócrito Después de múltiples divisiones de la materia se llega a unidad indivisibles a la que llamo átomo. Aristóteles Materia formada por cuatro elementos: tierra, agua, fuego y aire.

1. La material está formada por átomos 1. 2. Teoría atómica de Dalton (1808): Postulados de Dalton: 1. La materia está formada por átomos indivisibles. 2. Los átomos de un mismo elemento son iguales entre sí (masa y propiedades) 3. Los átomos de los diferentes elementos son diferentes (masa y propiedades) 4. En las reacciones químicas, los átomos ni se crean ni se destruyen, solo cambian su distribución. 5. Átomos de los diferentes elementos se combinan para dar compuestos siempre en la misma proporción. Definiciones importantes para Dalton: ÁTOMO: Mínima porción de un elemento químico que conserva sus propiedades ELEMENTO: Sustancia formada por átomos iguales (aislados, emparejados…) COMPUESTO: Sustancia formada por átomos distintos, combinados en proporciones fijas

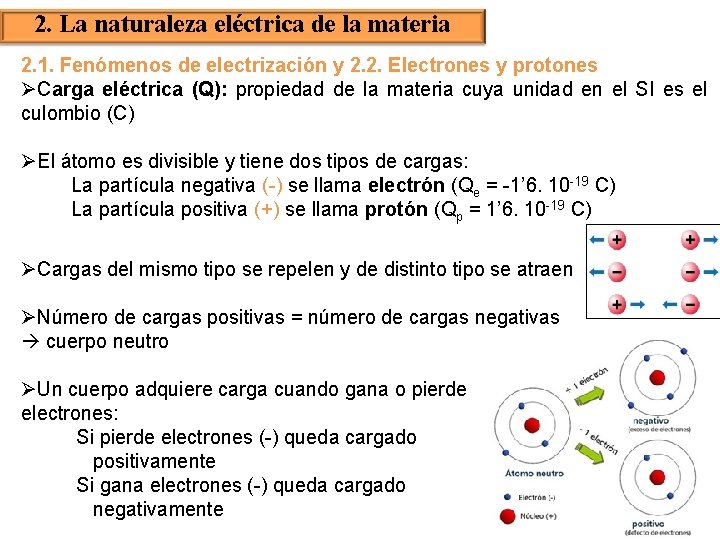
2. La naturaleza eléctrica de la materia 2. 1. Fenómenos de electrización y 2. 2. Electrones y protones ØCarga eléctrica (Q): propiedad de la materia cuya unidad en el SI es el culombio (C) ØEl átomo es divisible y tiene dos tipos de cargas: La partícula negativa (-) se llama electrón (Qe = -1’ 6. 10 -19 C) La partícula positiva (+) se llama protón (Qp = 1’ 6. 10 -19 C) ØCargas del mismo tipo se repelen y de distinto tipo se atraen ØNúmero de cargas positivas = número de cargas negativas cuerpo neutro ØUn cuerpo adquiere carga cuando gana o pierde electrones: Si pierde electrones (-) queda cargado positivamente Si gana electrones (-) queda cargado negativamente

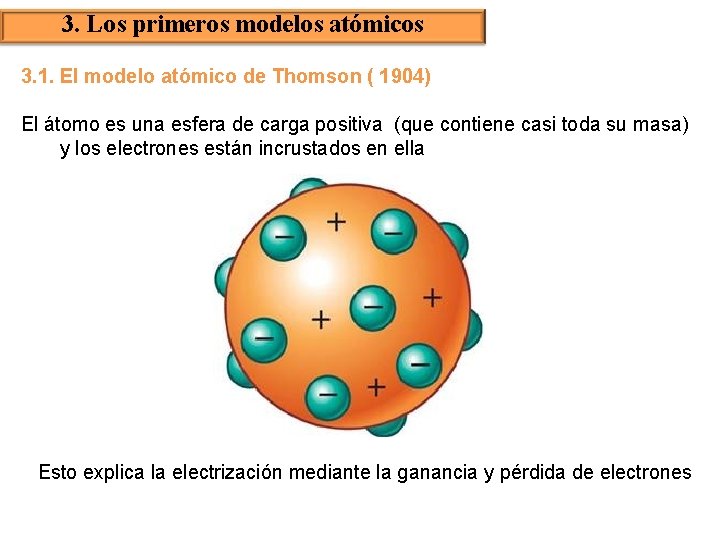
3. Los primeros modelos atómicos 3. 1. El modelo atómico de Thomson ( 1904) El átomo es una esfera de carga positiva (que contiene casi toda su masa) y los electrones están incrustados en ella Esto explica la electrización mediante la ganancia y pérdida de electrones

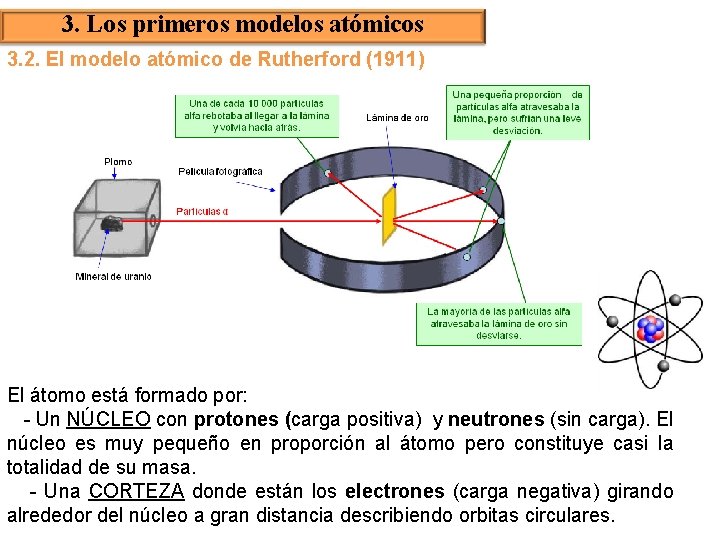
3. Los primeros modelos atómicos 3. 2. El modelo atómico de Rutherford (1911) El átomo está formado por: - Un NÚCLEO con protones (carga positiva) y neutrones (sin carga). El núcleo es muy pequeño en proporción al átomo pero constituye casi la totalidad de su masa. - Una CORTEZA donde están los electrones (carga negativa) girando alrededor del núcleo a gran distancia describiendo orbitas circulares.

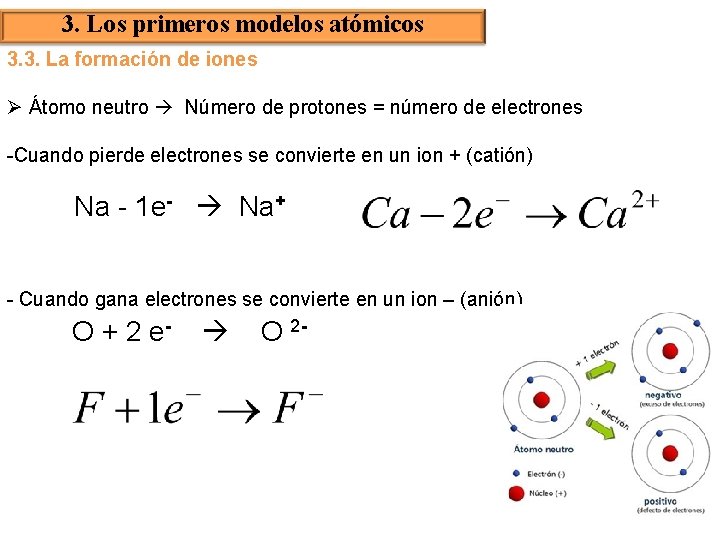
3. Los primeros modelos atómicos 3. 3. La formación de iones Ø Átomo neutro Número de protones = número de electrones -Cuando pierde electrones se convierte en un ion + (catión) Na - 1 e- Na+ - Cuando gana electrones se convierte en un ion – (anión) O + 2 e- O 2 -

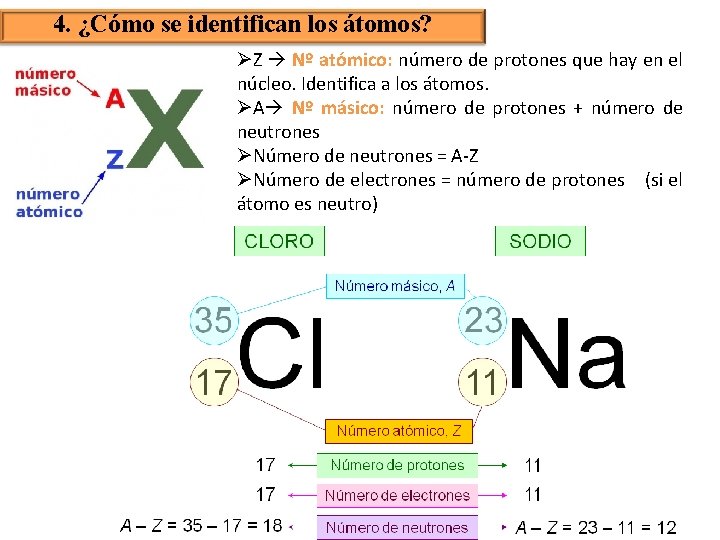
4. ¿Cómo se identifican los átomos? ØZ Nº atómico: número de protones que hay en el núcleo. Identifica a los átomos. ØA Nº másico: número de protones + número de neutrones ØNúmero de neutrones = A-Z ØNúmero de electrones = número de protones (si el átomo es neutro)

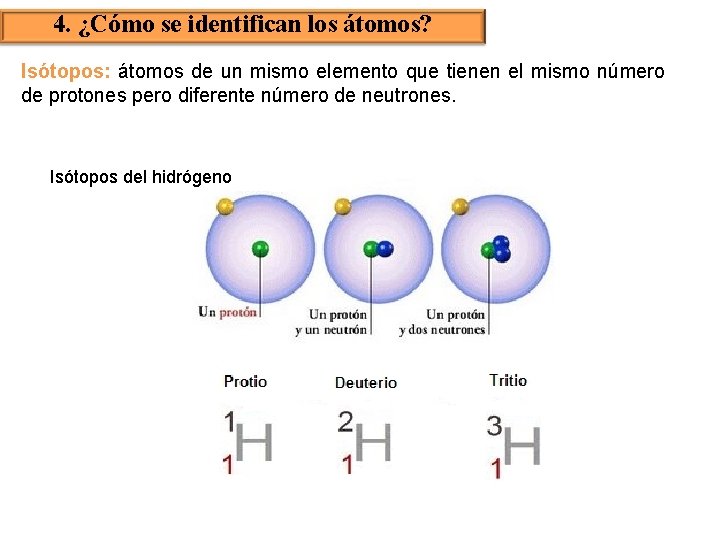
4. ¿Cómo se identifican los átomos? Isótopos: átomos de un mismo elemento que tienen el mismo número de protones pero diferente número de neutrones. Isótopos del hidrógeno

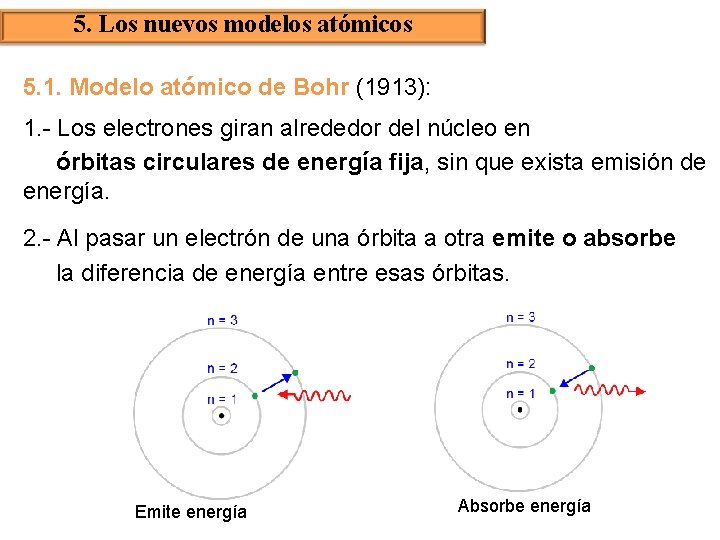
5. Los nuevos modelos atómicos 5. 1. Modelo atómico de Bohr (1913): 1. - Los electrones giran alrededor del núcleo en órbitas circulares de energía fija, sin que exista emisión de energía. 2. - Al pasar un electrón de una órbita a otra emite o absorbe la diferencia de energía entre esas órbitas. Emite energía Absorbe energía

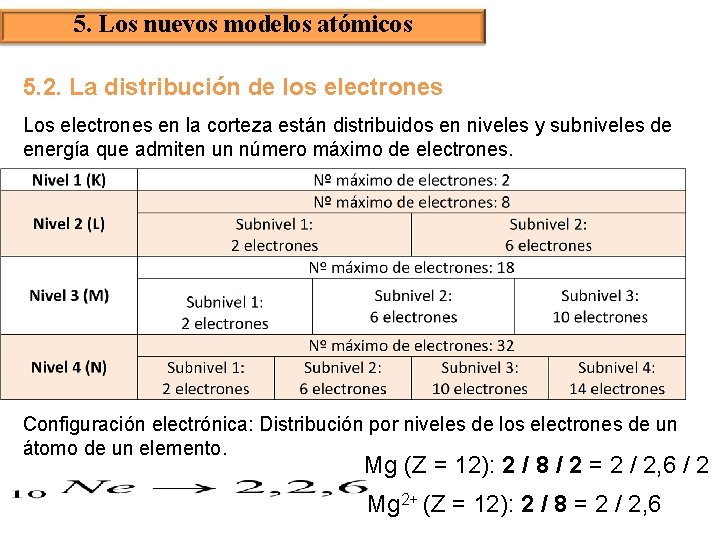
5. Los nuevos modelos atómicos 5. 2. La distribución de los electrones Los electrones en la corteza están distribuidos en niveles y subniveles de energía que admiten un número máximo de electrones. Configuración electrónica: Distribución por niveles de los electrones de un átomo de un elemento. Mg (Z = 12): 2 / 8 / 2 = 2 / 2, 6 / 2 Mg 2+ (Z = 12): 2 / 8 = 2 / 2, 6

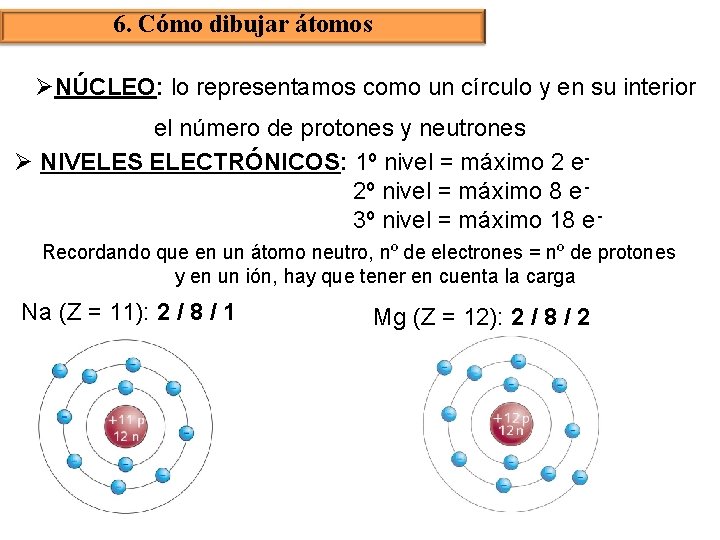
6. Cómo dibujar átomos ØNÚCLEO: lo representamos como un círculo y en su interior el número de protones y neutrones Ø NIVELES ELECTRÓNICOS: 1º nivel = máximo 2 e 2º nivel = máximo 8 e 3º nivel = máximo 18 e Recordando que en un átomo neutro, nº de electrones = nº de protones y en un ión, hay que tener en cuenta la carga Na (Z = 11): 2 / 8 / 1 Mg (Z = 12): 2 / 8 / 2

7. La radiactividad Descubierta en 1896 con el Uranio Radiactividad: emisión espontánea de partículas por parte de los núcleos atómicos para conseguir mayor estabilidad con lo que transforman en núcleos de otros elementos. • Radiación alfa ( ): es de carga positiva, son partículas formadas por dos protones y dos neutrones. Tiene bajo poder de penetración. • Radiación beta ( ): es de carga negativa, son electrones. Tiene gran poder de penetración. • Radiación gamma ( ): no tiene carga, son partículas sin masa que viajan a la velocidad de la luz (fotones). Tiene altísimo poder de penetración. Tienen aplicaciones en: medicina, datación de objetos, industria y agricultura, fuentes de energía (fusión y fisión), …