ESTEQUIOMETRIA ESTEQUIOMETRIA A palavra estequiometria deriva do grego















- Slides: 16

ESTEQUIOMETRIA

ESTEQUIOMETRIA • A palavra estequiometria deriva do grego "STOICHEON", que significa "a medida dos elementos químicos", ou seja, as quantidades envolvidas de cada substância em uma reação química.

ESTEQUIOMETRIA • É o cálculo das quantidades de reagentes e/ou produtos das reações químicas em mols, em massa, em volume, número de átomos e moléculas, realizado como conseqüência da lei de Proust (lei das proporções definidas), executado, em geral, com auxílio das equações químicas correlatas.

ESTEQUIOMETRIA • A estequiometria é de extrema importância no cotidiano, principalmente nas indústrias ou laboratórios, pois objetiva calcular teoricamente a quantidade de reagentes a ser usada em uma reação, prevendo a quantidade de produtos que será obtida em condições preestabelecidas.

ESTEQUIOMETRIA Para melhor entendimento das proporções fixas na estequiometria fizemos uma analogia com o exemplo a seguir. Perceba a necessidade de todos os componentes estarem em quantidades corretas para que o produto seja formado. 10 lentes + 5 armações 5 óculos Observe que é impossível obter mais que cinco óculos, pois faltarão lentes. Porém, para até cinco armações, o número de óculos que podemos montar é o mesmo das armações. Em química ocorre algo semelhante: as substâncias participam de uma reação química sempre em proporções definidas.

ESTEQUIOMETRIA ELEMENTOS 1 mol de átomos corresponde à massa atômica expressa em gramas, um número igual a 6, 0 · 1023 átomos, que, se forem de um gás e estiverem nas CNTP, ocuparão um volume de 22, 4 L.

ESTEQUIOMETRIA SUBST NCIAS 1 mol de moléculas corresponde à massa molecular expressa em gramas, um número igual a 6, 02 · 10 23 moléculas, que, se forem de um gás e estiverem nas CNTP, ocuparão um volume de 22, 4 L.

ESTEQUIOMETRIA Para efetuarmos o cálculo estequiométrico, vamos obedecer à seguinte seqüência: a) escrever a equação envolvida; b) acertar os coeficientes da equação (ou equações); Obs: Uma equação química só estará corretamente escrita após o acerto dos coeficientes, sendo que, após o acerto, ela apresenta significado quantitativo.

ESTEQUIOMETRIA c) relacionar os coeficientes com mols. Teremos assim uma proporção inicial em mols; d) estabelecer entre o dado e a pergunta do problema uma regra de três. Esta regra de três deve obedecer aos coeficientes da equação química e poderá ser estabelecida, a partir da proporção em mols, em função da massa, em volume, número de moléculas, entre outros, conforme dados do problema.

ESTEQUIOMETRIA • Como exemplo podemos citar a reação de combustão do álcool etílico: Balanceando a equação, ficamos com: proporção em mols

ESTEQUIOMETRIA Estabelecida a proporção em mols, podemos fazer inúmeros cálculos, envolvendo os reagentes e/ou produtos dessa reação, combinando as relações de várias maneiras.

exercícios Fosgênio, COCl 2, é um gás venenoso. Quando inalado, reage com a água nos pulmões para produzir ácido clorídrico (HCl), que causa graves danos pulmonares, levando, finalmente, à morte: por causa disso, já foi até usado como gás de guerra. A equação química dessa reação é: COCl 2 + H 2 O→ CO 2 + 2 HCl Se uma pessoa inalar 198 mg de fosgênio, a massa de ácido clorídrico, em gramas, que se forma nos pulmões, é igual a:

exercícios O gás cianídrico é uma substância utilizada em câmara de gás. Esse composto é preparado por uma reação do ácido sulfúrico (H 2 SO 4) com o cianeto de potássio (KCN). Com relação a esse composto, pede-se: a) A equação balanceada para sua obtenção; b) O número de moléculas formado a partir de 32, 5 g de cianeto de potássio;

exercícios A combustão do gás amoníaco é representada pela seguinte equação, não balanceada: NH 3 + O 2 → N 2 + H 2 O. Calcule a massa de água, obtida a partir de 56 L de NH 3, nas CNTP, sabendo que o rendimento da reação é de 95%.

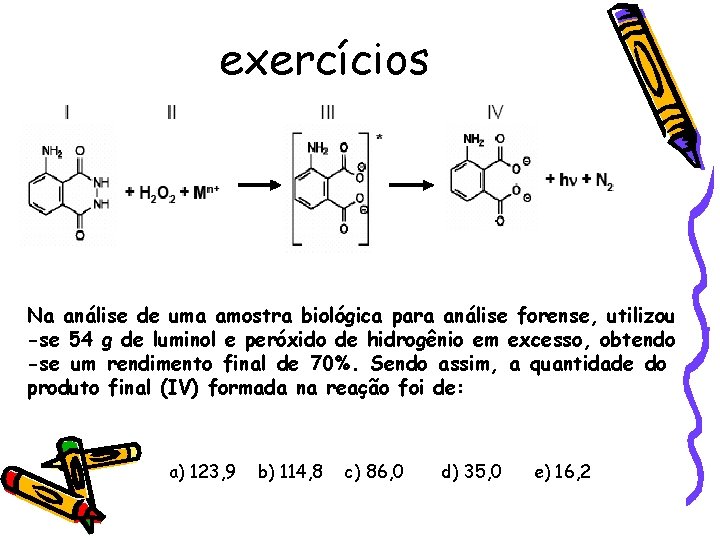
Exercícios (esse é do ENEM) Na investigação forense, utiliza-se luminol, uma substancia que reage com o ferro presente na hemoglobina do sangue, produzindo luz que permite visualizar locais contaminados com pequenas quantidades de sangue, mesmo em superfícies lavadas. É proposto que, na reação do luminol (I) em meio alcalino, na presença de peroxido de hidrogênio (II) e de um metal de transição (Mn+), forma-se o composto 3 -amino ftalato (III) que sofre uma relaxação dando origem ao produto final da reação (IV), com liberação de energia (hv) e de gás nitrogênio (N 2).

exercícios Na análise de uma amostra biológica para análise forense, utilizou -se 54 g de luminol e peróxido de hidrogênio em excesso, obtendo -se um rendimento final de 70%. Sendo assim, a quantidade do produto final (IV) formada na reação foi de: a) 123, 9 b) 114, 8 c) 86, 0 d) 35, 0 e) 16, 2
 A palavra estequiometria do grego
A palavra estequiometria do grego A palavra ergonomia deriva do grego
A palavra ergonomia deriva do grego Todos os circos são iguais
Todos os circos são iguais O que perguntavam os primeiros filósofos?
O que perguntavam os primeiros filósofos? Fernanda maria borges youtube
Fernanda maria borges youtube Normalidad
Normalidad Medioab
Medioab Formulas empiricas ejemplos
Formulas empiricas ejemplos Stoicheon
Stoicheon 20000x160
20000x160 Conclusion de estequiometria
Conclusion de estequiometria Estequiometria
Estequiometria Nomos grego
Nomos grego As gimnospermas (do grego gymnos
As gimnospermas (do grego gymnos Estratégia vem do grego
Estratégia vem do grego Areópago grego
Areópago grego Diakonos grego
Diakonos grego































