Entendese por ELETROQUMICA o ramo da Qumica que





























- Slides: 38


Entende-se por ELETROQUÍMICA o ramo da Química que estuda so fenômenos químicos que envolvem transferência de elétrons. Quando um processo químico ocorre espontaneamente e produz transferência de elétrons é chamado de pilha ou bateria, mas quando o processo químico é provocado por uma corrente elétrica é denominado eletrólise.

ELETROQUÍMICA

PILHAS E BATERIAS Para calculadoras Para lanternas Para celulares Para automóveis

ELETRÓLISE laboratório indústria

Conceitos introdutórios Para entender os fenômenos eletroquímicos, consideramos necessário, antes, fazer um estudo a respeito um tipo de reação química denominada oxidação-redução. Então lá vai!

Reação química OXIDAÇÃO-REDUÇÃO (REDOX) Na imagem ao lado, diz-se`, normalmente, que o objeto “enferrujou”. Quimicamente, porém, seria mais adequado falar-se em um processo de “oxidação-redução”.

Reação química OXIDAÇÃO-REDUÇÃO (REDOX) A oxidação-redução é, na verdade, uma reação química em que se observa “transferência de elétrons” de uma espécie química para outra.

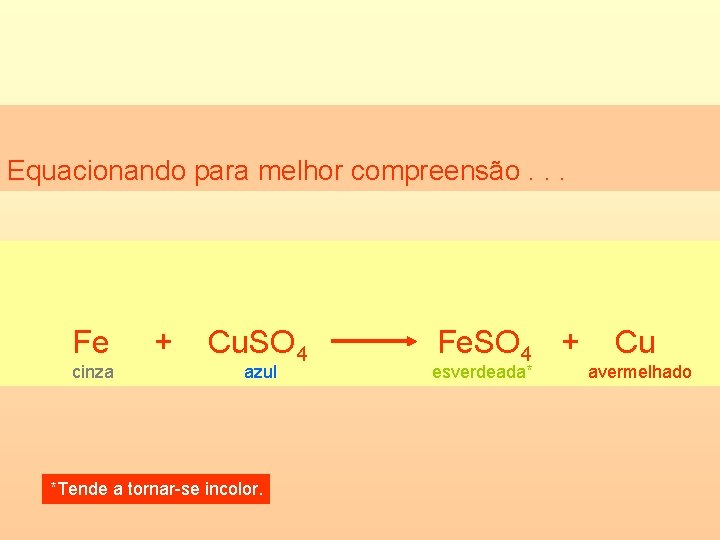
Uma experiência realizada no laboratório Após certo tempo, a solução muda de cor e um “pó” avermelhado (Cu) parece ocupar o lugar do prego (Fe).

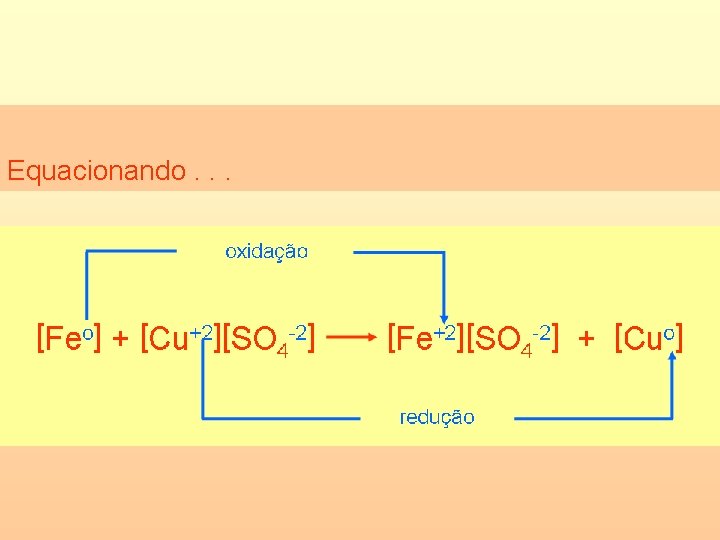
Equacionando para melhor compreensão. . . Fe cinza + Cu. SO 4 azul *Tende a tornar-se incolor. Fe. SO 4 + esverdeada* Cu avermelhado

Equacionando. . .

Explicando. . . O ferro, inicialmente neutro (NOX=0), perde 2 elétrons, os quais são transferidos para o cobre, tornado-se carregado (NOX=+2). É a oxidação do ferro!

Explicando. . . O cobre, inicialmente carregado (NOX = +2), recebe 2 elétrons e tornando-se neutro (NOX=0). É a redução do cobre!

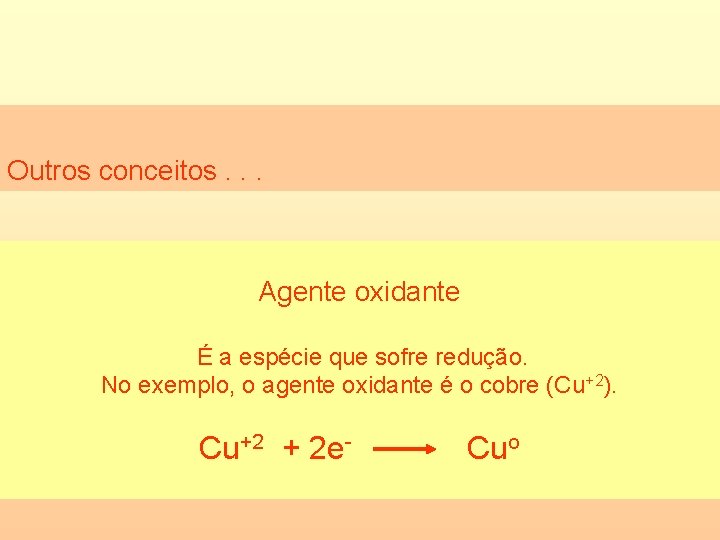
Outros conceitos. . . Agente oxidante É a espécie que sofre redução. No exemplo, o agente oxidante é o cobre (Cu+2). Cu+2 + 2 e- Cuo

Outros conceitos. . . Agente redutor É a espécie que sofre oxidação. No exemplo, o agente redutor é o cobre (Feo). Feo Fe+2 + 2 e-

A equação global. . . Feo + Cu+2 Fe+2 + Cuo Esta é chamada de equação global. Nela só aparecem os íons ou átomos que mudaram o seu número de oxidação (NOX).

Pilhas. . . Pilha de Volta A pilha de Volta, como o próprio nome indica, foi inventada em 1800 pelo físico italiano Alessandro Volta (1745 -1827).

Pilhas. . .

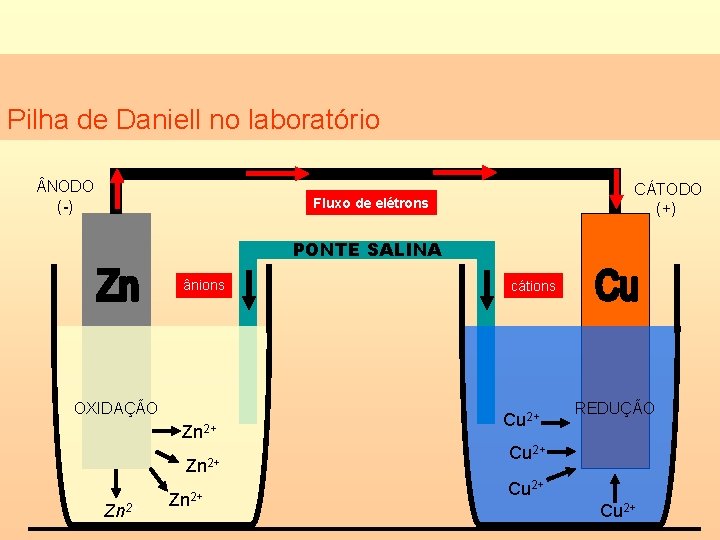
Pilha de Daniell A pilha de Daniell baseia-se na seguinte reação (forma iônica simplificada). . . Zno + Cu+2(aq) Zn+2(aq) + Cuo

Pilha de Daniell no laboratório NODO (-) CÁTODO (+) Fluxo de elétrons PONTE SALINA ânions OXIDAÇÃO Zn 2+ cátions Cu 2+ REDUÇÃO Cu 2+

Pilha de Daniell percebeu que os elétrons poderiam ser transferidos do zinco (Zn) para os cátions cobre (Cu+2) por um fio condutor externo e, com isso, produzir uma corrente elétrica.

Pilha de Daniell Com o passar do tempo, haverá excesso de cátions na solução de sulfato de zinco e falta de cátions na solução de sulfato de cobre. Isso faz com que a pilha pare de funcionar. Isso é, então, compensado pela ponte salina.

Representação de uma pilha (IUPAC) A IUPAC determina como deve ser representada uma pilha. M 1 o / M 1+x // M 2+y / M 2 o Zno / Zn+2 // Cu+2 / Cuo * As barras paralelas representam a ponte salina.

Potencial de redução Na pilha de Daniell o zinco (Zno) tende a se oxidar, enquanto o cobre (Cuo), a se reduzir. Por quê? O zinco apresenta menor potencial de redução (- 0, 76 V), enquanto cobre apresenta maior potencial de redução (+ 0, 34 V).

Potencial de redução Os valores são obtidos experimentalmente e permitem que. . . 1. Seja calculada a diferença de potencial da pilha 2. Façamos previsão de quem se oxida ou quem se reduz

TABELA DE POTENCIAIS-PADRÃO* DE REDUÇÃO (1 atm e 25°C) *São valores experimentais

Entendendo. . . Quanto maior for a medida do potencial de oxidação, maior é a tendência do metal ceder elétrons Quanto maior for a medida do potencial de redução, maior é a tendência do metal ganhar elétrons

Exemplificando. . . Zn 2+ + 2 e- Zno E° = – 0, 76 V Cu 2+ + 2 e- Cuo E° = + 0, 34 V

Exemplificando. . . O cobre tem maior potencial de redução, logo ganhará elétrons (sofrerá redução); o zinco perderá elétrons (sofrerá oxidação). Zno Cu 2+ + 2 e. Zno + Cu 2+ Zn 2+ + 2 e. Cuo E° = + 0, 76 V E° = + 0, 34 V Zn 2+ + Cuo ΔE = + 1, 10 V

Exercitando. . . Sejam as seguintes semi-reações e os seus potenciais padrão de redução, determine a “ d. d. p “ da pilha formada: Sn+2 + 2 e. Sno Eo = - 0, 14 V Ag+1 +1 e. Ago Eo = + 0, 80 V (a) + 0, 54 V. (b) + 0, 66 V. (c) + 1, 46 V. (d) + 0, 94 V. (e) + 1, 74 V.

Exercitando. . . Sejam as seguintes semi-reações e os seus potenciais padrão de redução, determine a “ d. d. p “ da pilha formada: Sn+2 + 2 e. Sno Eo = - 0, 14 V Ag+1 +1 e. Ago Eo = + 0, 80 V (a) + 0, 54 V. (b) + 0, 66 V. (c) + 1, 46 V. (d) + 0, 94 V. (e) + 1, 74 V. O potencial de redução da prata é maior que o do estanho Sno 2 Ag+1 + 2 e. Sno + 2 Ag+1 Sn+2 + 2 e 2 Ago Eo = + 0, 14 V Eo = + 0, 80 V Sn+2 + 2 Ago ∆Eo = + 0, 94 V

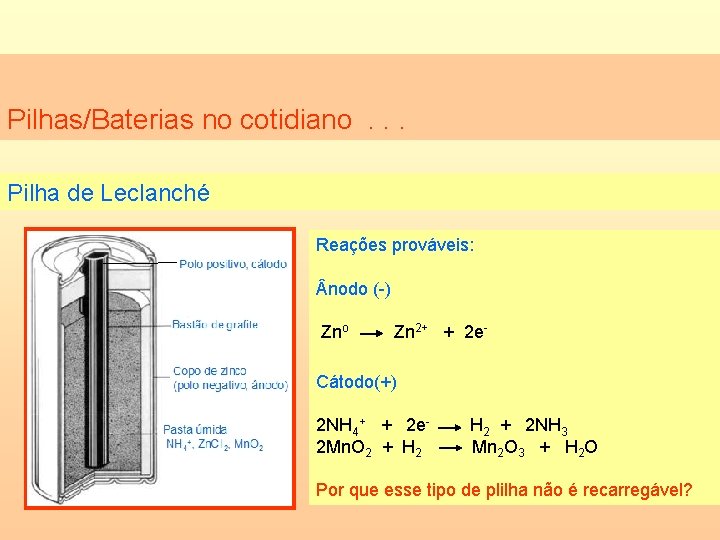
Pilhas/Baterias no cotidiano. . . Pilha de Leclanché Reações prováveis: nodo (-) Zno Zn 2+ + 2 e- Cátodo(+) 2 NH 4+ + 2 e 2 Mn. O 2 + H 2 + 2 NH 3 Mn 2 O 3 + H 2 O Por que esse tipo de plilha não é recarregável?

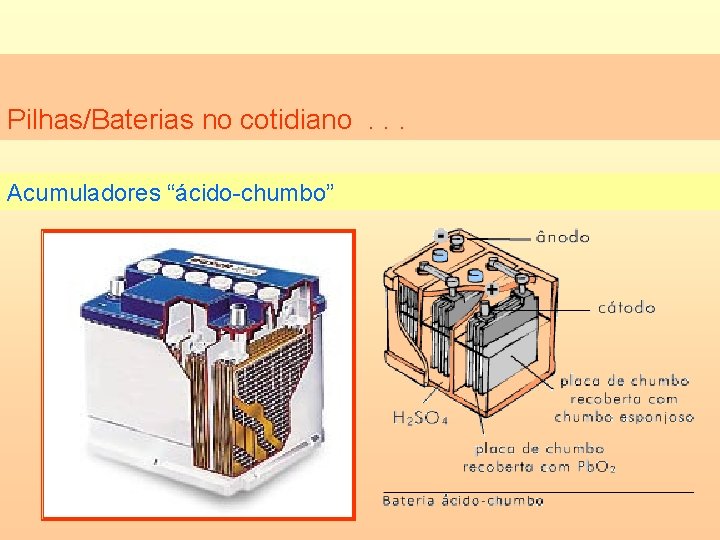
Pilhas/Baterias no cotidiano. . . Acumuladores “ácido-chumbo”

Pilhas/Baterias no cotidiano. . . Acumuladores “ácido-chumbo” Durante a descarga: Durante a carga: nodo (-) Cátodo (-) Pbo + SO 42 - Pb. SO 4 + 2 e- Cátodo (+) Pb. O 2 + SO 42 - + 2 e- Pb. SO 4 + 2 e- Pbo + SO 42 - Anodo (+) Pb. SO 4 Pb. O 2 + SO 42 - + 2 e-

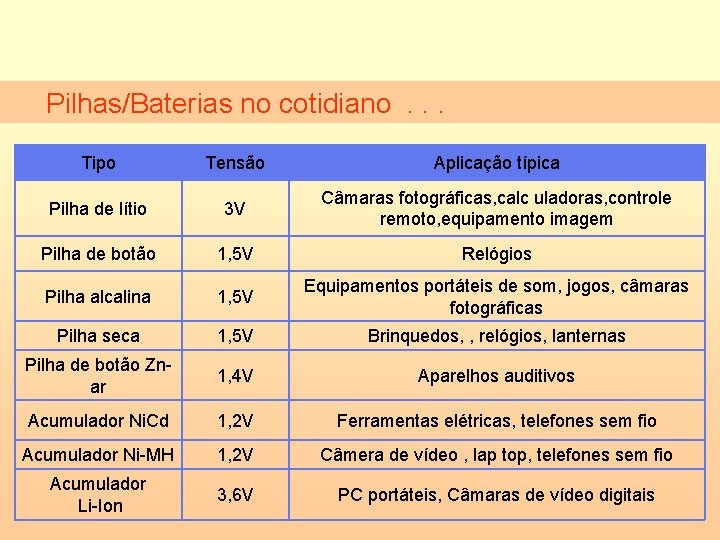
Pilhas/Baterias no cotidiano. . . Tipo Tensão Aplicação típica Pilha de lítio 3 V Câmaras fotográficas, calc uladoras, controle remoto, equipamento imagem Pilha de botão 1, 5 V Relógios Pilha alcalina 1, 5 V Equipamentos portáteis de som, jogos, câmaras fotográficas Pilha seca 1, 5 V Brinquedos, , relógios, lanternas Pilha de botão Znar 1, 4 V Aparelhos auditivos Acumulador Ni. Cd 1, 2 V Ferramentas elétricas, telefones sem fio Acumulador Ni-MH 1, 2 V Câmera de vídeo , lap top, telefones sem fio Acumulador Li-Ion 3, 6 V PC portáteis, Câmaras de vídeo digitais

Descarte de pilhas e baterias. . . De acordo com o CONAMA, Lei 257, publicada em 22 de julho de 1999, as pilhas e baterias devem conter o símbolo indicativo de descarte.

Descarte de pilhas e baterias. . . Podem ser descartadas em lixo doméstico; pilhas secas, alcalinas, Ni-H e de lítio. As demais, por conterem, por exemplo, Pb, Hg e Cd não podem ter descarte simples, devendo ser devolvidas ao fabricante.

Fim da primeira parte. Em seguida, eletrólise. Prof. Luiz Antônio Tomaz Turma 201
 Las personas valen por lo que son y no por lo que tienen
Las personas valen por lo que son y no por lo que tienen Sanna vako
Sanna vako Que es la probabilidad
Que es la probabilidad Topografia alveolo dental
Topografia alveolo dental Quel ramo del lago di como disegno
Quel ramo del lago di como disegno Violetas de manet
Violetas de manet Analisis foda de una empresa de ropa
Analisis foda de una empresa de ropa Maritimidade e continentalidade
Maritimidade e continentalidade Bloqueio de ramo direito ecg
Bloqueio de ramo direito ecg Feixe de bachman
Feixe de bachman Ramo di parabola
Ramo di parabola Coro atto terzo adelchi figure retoriche
Coro atto terzo adelchi figure retoriche ไทย
ไทย Ramo comunicante bianco e grigio
Ramo comunicante bianco e grigio Ramos ventrales
Ramos ventrales Muscolo miloioideo
Muscolo miloioideo O que é complemento oblíquo
O que é complemento oblíquo Biologia
Biologia Por que este hombre caminaba por el bosque
Por que este hombre caminaba por el bosque Por que o entrevistado não vai agradecer por ele ter vindo
Por que o entrevistado não vai agradecer por ele ter vindo Reaccion de condensacion
Reaccion de condensacion Qumica moderna
Qumica moderna Acidos organicos
Acidos organicos Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Entalpia
Entalpia Carbonos primarios secundarios y terciarios ejemplos
Carbonos primarios secundarios y terciarios ejemplos Qumica
Qumica Qumica
Qumica Tabla qumica
Tabla qumica Qumica
Qumica Pilha de daniell
Pilha de daniell Philippe spitaleri kaufmann
Philippe spitaleri kaufmann Qumica
Qumica Qumica
Qumica Qumica
Qumica Nitrila
Nitrila