CINTICA QUMICA Ramo da Qumica que estuda a
















- Slides: 25

CINÉTICA QUÍMICA “Ramo da Química que estuda a velocidade das reaçãoes e os fatores que a influenciam” Reações rápidas Reações Lentas

Medida da Velocidade Considere a reação: C 2 H 2 + 2 H 2 → C 2 H 6 v. Velocidade da Substância Isolada: v = ∆n / ∆t tempo (min) n (mols de C 2 H 6 formado) 0 0 4 12 6 15 10 20 No intervalo de tempo de 0 a 4 min, a velocidade de formação do C 2 H 6 é de v = 3 mols/min, obsevar que para os próximos intervalos de tempo a velocidade vai decaindo.

Medida da Velocidade v Velocidade Média: Vm = Vr = VP = ∆n / c. ∆t, onde c é o coeficiente estequiométrico correspondente a cada substância que participa da reação. tempo (min) n (mols de C 2 H 2) n (mols de C 2 H 6) 0 50 60 0 4 38 36 12 6 35 30 15 10 30 20 20 Para o intervalo de tempo de 6 a 10 min, a velocidade média da reação é de 1, 25 mols/min. Para uma reação genérica: a. A + b. B → c. C + d. D, temos Vm = ∆n. A / a. ∆t = ∆n. B / b. ∆t = ∆n. C / c. ∆t = ∆n. D / d. ∆t

Exercícios de fixação: 1. Um químico misturou 2 mols de hidrogênio com 3 mols de cloro num recipiente adequado. Suponha que do início da mistura até 15 s, a reação H 2 + Cl 2 → 2 HCl ocorra conforme os dados da tabela: Tempo (s) 0 1 3 6 10 12 mols H 2 2, 0 1, 75 1, 25 1, 0 0, 75 mols Cl 2 3, 0 2, 75 2, 25 2, 0 1, 75 mols HCl 0 0, 5 1, 0 1, 5 2, 0 2, 5 a) Calcule a velocidade em relação a cada participante e a velocidade média da reação no intervalo de 10 a 15 s. b) Construa o gráfico que mostra a variação da concentração em mol em função do tempo de cada participante da reação.

Exercícios de fixação: 2. Um químico realizou a reação de decomposição do ácido carbônico: H 2 CO 3 → H 2 O + CO 2. Mediu a concentração molar de CO 2 nos tempos 10 s e 20 s e obteve: 10 s: [CO 2] = 0, 2 mol/L 20 s: [CO 2] = 0, 8 mol/L Qual é a velocidade média dessa reação no intervalo de 10 a 20 s? 3. Considere a equação: 2 N 2 O 5 (g) → 4 NO 2 + O 2. Admita que a formação de O 2 tem uma velocidade média constante igual a 0, 05 mol/s. A massa de NO 2 formada em 1 min é: (Dado: ma O: 16 u, ma N = 14 u) a) 96 g b) 55, 2 g, c) 12, 0 g d) 552, 0 g e) 5, 52 g

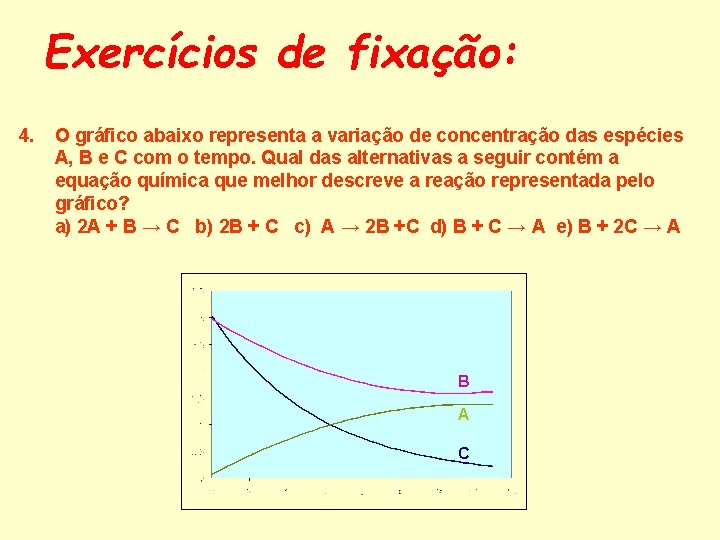
Exercícios de fixação: 4. O gráfico abaixo representa a variação de concentração das espécies A, B e C com o tempo. Qual das alternativas a seguir contém a equação química que melhor descreve a reação representada pelo gráfico? a) 2 A + B → C b) 2 B + C c) A → 2 B +C d) B + C → A e) B + 2 C → A B A C

Mecanismo das reações v É a maneira que se processa uma reação química v. Teoria das Colisões: “quebra das ligações dos reagentes e formação das ligações dos produtos” Reação: H 2 (g) + I 2 (g) → 2 HI(g)

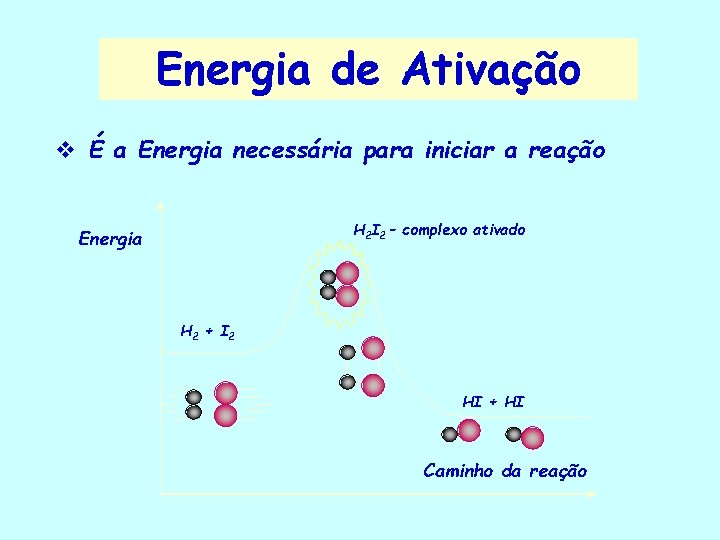
Energia de Ativação v É a Energia necessária para iniciar a reação H 2 I 2 – complexo ativado Energia H 2 + I 2 HI + HI Caminho da reação

Fatores que Influenciam uma Reação Química v Estado físico dos reagentes; v Estado Cristalino dos reagentes; v Reagentes em soluções; v Área de contato entre os reagentes; v Temperatura e Radiações na reação; v Energia Elétrica; v Catalisadores; v Pressão sobre o sistema em reação; v Concentração dos reagentes.

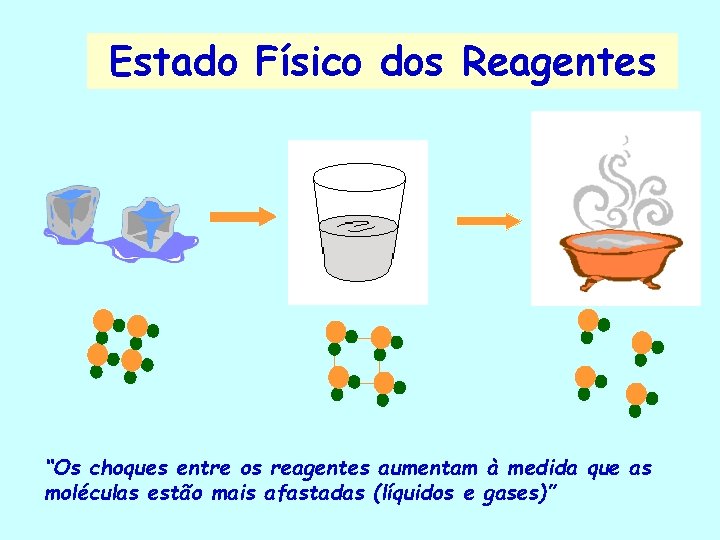
Estado Físico dos Reagentes “Os choques entre os reagentes aumentam à medida que as moléculas estão mais afastadas (líquidos e gases)”

Estado Cristalino dos Reagentes C(grafite) estrutura amorfa C(diamante) estrutura cristalina “A estrutura amorfa possui ligações mais fracas do que na estrutura cristalina”

Reagentes em Soluções “partículas solúveis possuem maior movimento aumentando o número de choques entre as várias espécies presentes na solução”

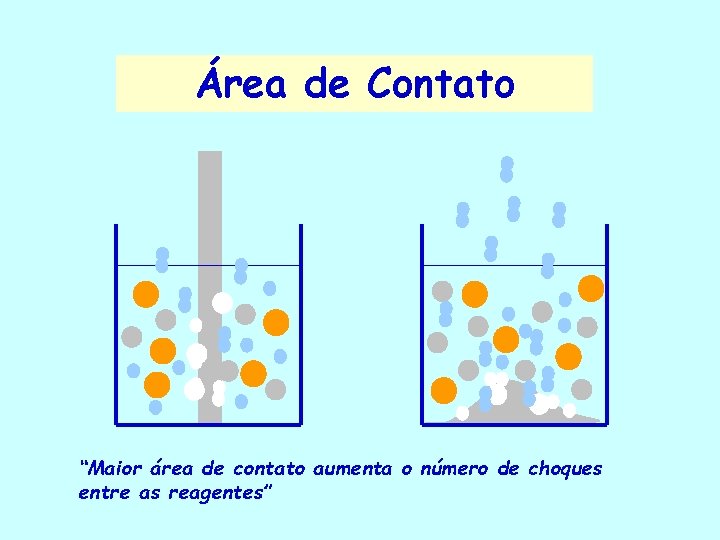
Área de Contato “Maior área de contato aumenta o número de choques entre as reagentes”

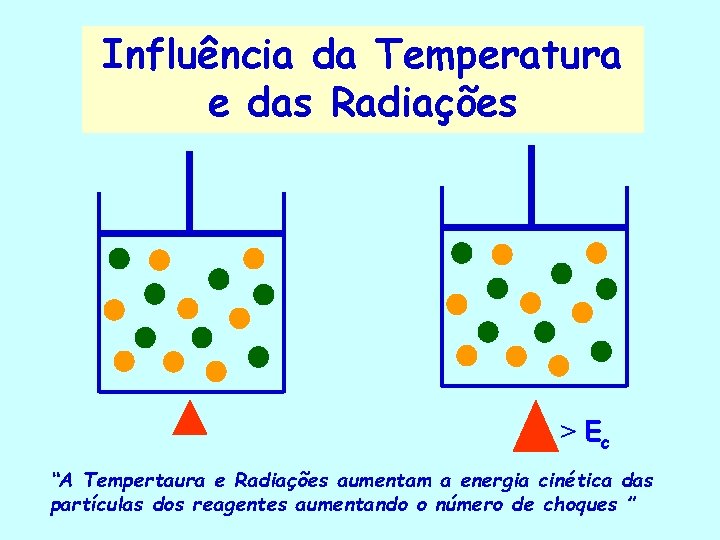
Influência da Temperatura e das Radiações > Ec “A Tempertaura e Radiações aumentam a energia cinética das partículas dos reagentes aumentando o número de choques ”

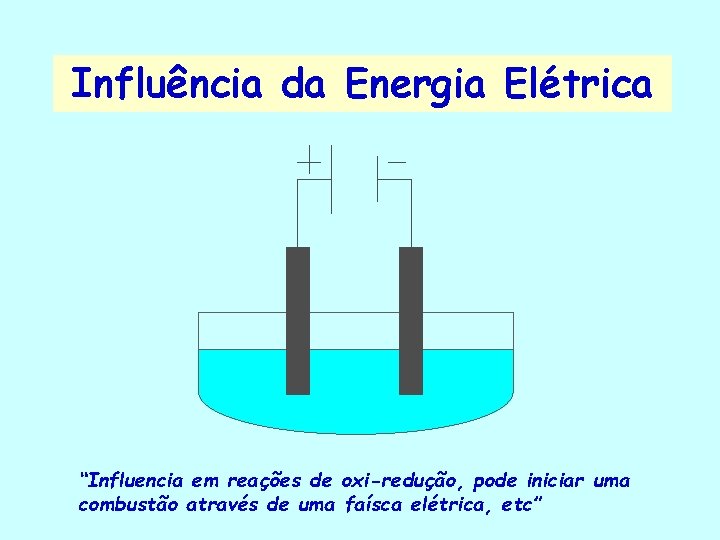
Influência da Energia Elétrica “Influencia em reações de oxi-redução, pode iniciar uma combustão através de uma faísca elétrica, etc”

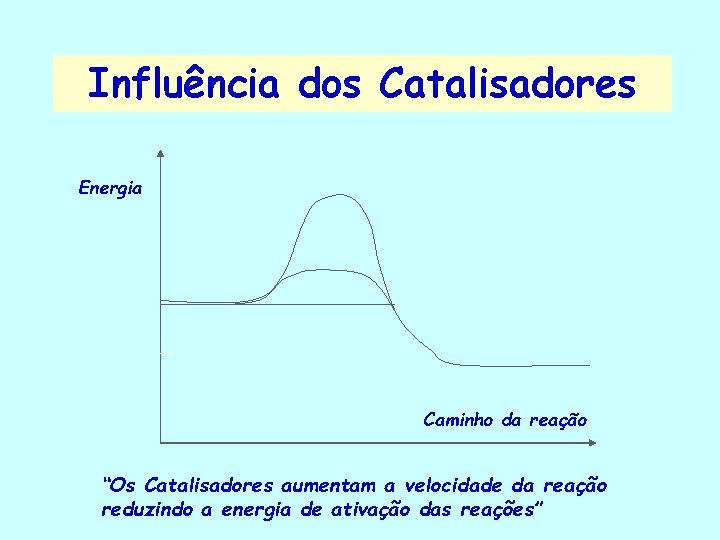
Influência dos Catalisadores Energia Caminho da reação “Os Catalisadores aumentam a velocidade da reação reduzindo a energia de ativação das reações”

Tipos de Catalisadores v Catalisadores heterogênios: não participa diretamente da reação e forma uma fase distinta em relação aos reagentes. Ex: H 2(g) + O 2(g) → H 2 O(l), na presença de Pt v Catalisadores homogêneos: participa diretamente da reação. Formando uma só fase com os reagentes e sendo recuperado na última etapa da reação. Ex: decomposição do peróxido de hidrogênio na presemça de Fe+2 Reação geral: 2 H 2 O 2(aq) → 2 H 2 O(l) + O 2(g) 1 a Etapa: H 2 O 2(aq) + 2 Fe+2(aq) + 2 H+(aq) → 2 Fe+3(aq) + 2 H 2 O(l) 2 a Etapa: 2 Fe+3(aq) + H 2 O 2(aq) → 2 Fe+2(aq) + O 2(g) + 2 H+(aq)

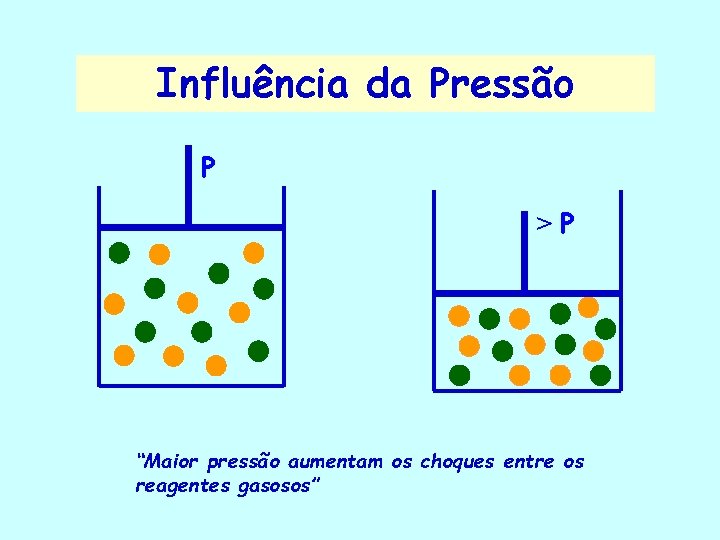
Influência da Pressão P >P “Maior pressão aumentam os choques entre os reagentes gasosos”

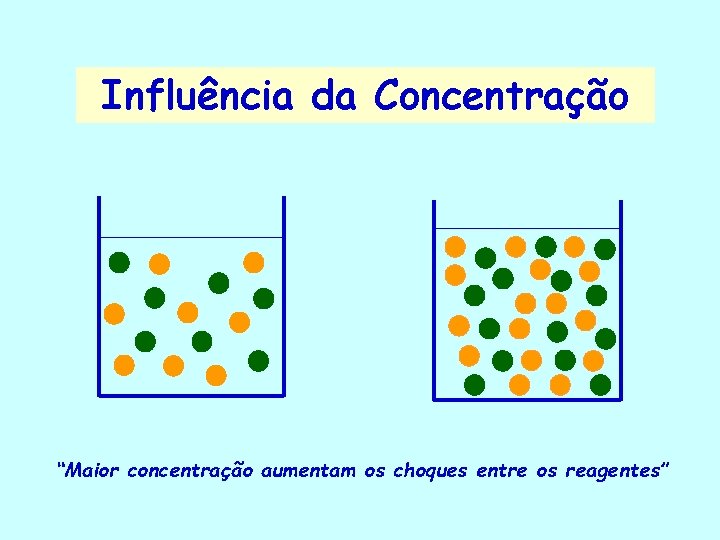
Influência da Concentração “Maior concentração aumentam os choques entre os reagentes”

Exercícios de fixação: 1. Dada a seguinte reação: reagentes → complexo ativado → produtos + calor Represente em um gráfico energia x caminho da reação, os níveis das energias dos reagentes, complexo ativado e produtos. 2. Esboce os gráficos das seguintes reações: a) A + B → C Energia dos reagentes = 8 Kj Energia dos produtos = 7 Kj Energia de ativação = 17 kj 3. b) A +B → R + Q Energia dos reagentes = 12 Kj Energia dos produtos = 17 Kj Energia de ativação = 20 kj

Lei da Ação das Massas “A velocidade de uma reação química é diretamente proporcional ao produto das concentrações molares dos reagentes elevadas a potências determinadas experimentalmente” Guldeberg e Waage Para a reação: a. A + b. B → c. C + d. D Temos: V = K. [A]a. [B]b Onde: K = constante cinética (varia com a temperatura) a e b = ordem dos reagentes A e B (experimental) a + b = ordem da reação [ ] = concentração molar

Lei da Ação das Massas Observações: 1) Para reações que ocorrem em uma única etapa (reações elementares), as potências normalmente coincidem com os coeficientes dos reagentes; 2) Reações que ocorrem em mais de uma etapa, a velocidade da reação é dada pela etapa mais lenta; 3) Reagentes sólidos ou solventes não participam da expressão da velocidade; 4) Nas reações entre gases a velocidade pode ser expressa em função das pressões parciais dos reagentes. Para a reação a. A(g) + b. B(g) → c. C(g) + d. D(g), teremos: 1. V = K. p. Aa. p. Bb

Lei da Ação das Massas EXEMPLO A reação NO 2 (g) + CO(g) → CO 2(g) + NO(g) ocorre em duas etapas: 2 NO 2(g) → NO 3(g) + NO (g) (etapa lenta) NO 3(g) + CO (g) → CO 2(g) + NO 2(g) (etapa rápida) V = K. [NO 2]2 ou V = K. P 2 NO 2

Exercícios de fixação: 1. Escreva a equação da velocidade em função das concentrações e das pressões parciais dos reagentespara cada uma das seguintes reações, supondo todas elementares: 2. a) 2 SO 2(g) + O 2(g) → 2 SO 3(g) b) C(s) + O 2(g) → CO 2(g) 3. c) C(s) + 2 S(s) → CS 2(l) d) Zn(s) + 2 HCl(aq) → Zn. Cl 2(aq) + H 2(g) 4. 2. Considere a reação de síntese da amônia, dada pela equação N 2(g) + 3 H 2 → 2 NH 3(g), mantida a temperatura, o que ocorrerá com a velocidade da reaçlão se: 5. a) A concentração em mol/L do H 2(g) for reduzida a terça parte e a do N 2(g) for triplicada? 6. b) A pressão parcial do N 2(g) for quadruplicada e a do H 2(g) for triplicada?

Exercícios de fixação: 3. A cinética da reação 2 Hg. Cl 2(aq) + C 2 O 4 -2(aq) → 2 Cl-(aq) + 2 CO 2(g) + Hg 2 Cl 2(s) foi estudada em solução aquosa, segundo a quantidade de matéria que precipita por litro de solução por minuto. Os dados obtidos estão na tabela a seguir em mol/L: [Hg. Cl 2] [C 2 O 4 -2] V (mol/L. min) 0, 100 0, 150 1, 8 x 10 -5 0, 100 0, 300 7, 2 x 10 -5 0, 050 0, 300 3, 6 x 10 -5 a) Determine a equação da velocidade da reação b) Calcule o valor da constante da velocidade da reação c) Qual será a velocidade da reação quando as concentrações dois reagentes forem igual a 0, 01 mol/L?
 O que estuda bromatologia
O que estuda bromatologia Medicina legista
Medicina legista Que estuda gelotologia
Que estuda gelotologia O que estuda bromatologia
O que estuda bromatologia Deutoromicetos
Deutoromicetos Geografia humana estuda
Geografia humana estuda Identificação
Identificação Estuda
Estuda Tipos de sujeito indeterminado
Tipos de sujeito indeterminado Estuda.com
Estuda.com O gráfico de segmentos é também conhecido como:
O gráfico de segmentos é também conhecido como: Trabalho sobre energia
Trabalho sobre energia Cintica
Cintica Cintica
Cintica Cintica
Cintica Qumica
Qumica Lei da velocidade de reação
Lei da velocidade de reação Cintica
Cintica Teoría cinetico molecular
Teoría cinetico molecular Cintica
Cintica Cintica
Cintica Cintica
Cintica Cintica
Cintica Cintica
Cintica Cintica
Cintica Qumica
Qumica