Srie Eletroqumica Srie eletroqumica os elementos so dispostos

















































- Slides: 53

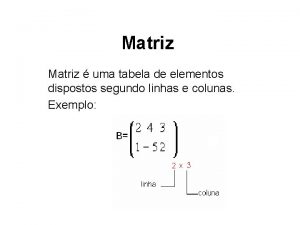
Série Eletroquímica • Série eletroquímica: os elementos são dispostos em ordem crescente de potenciais de eletrodo padrão (potenciais padrão de redução). • Potenciais de redução podem ser usados na explicação das reações de oxidação-redução em solução aquosa.

ELETROQUÍMICA

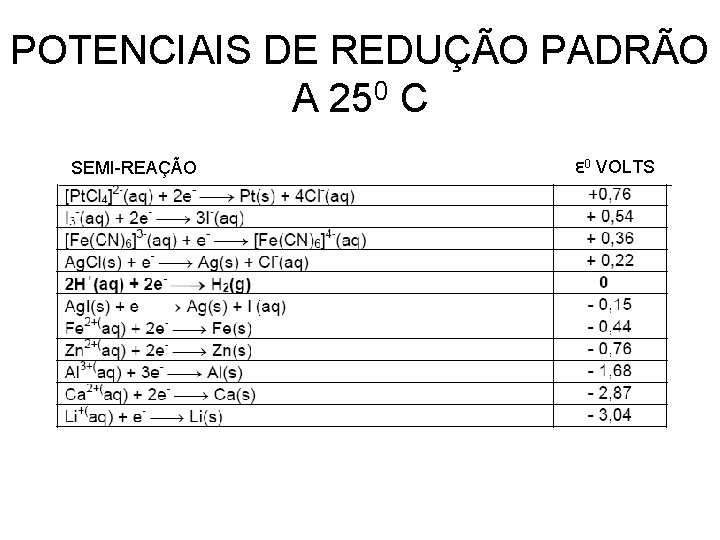
POTENCIAIS DE REDUÇÃO PADRÃO A 250 C SEMI-REAÇÃO Ԑ 0 VOLTS

SIGNIFICADO DO POTENCIAL DE REDUÇÃO PADRÃO (Ԑ) • Elementos mais eletropositivos apresentam maior valor negativo de potencial, ou seja, têm maior tendência do metal se oxidar. • Quanto mais positivo for Ԑ tanto maior será a tendência da reação escrita ocorrer. • Valores positivos de Ԑ (red. ) significa que estas espécies se reduziram, portanto são fortes oxidantes.

RELAÇÃO G x Ԑ 0 • O potencial de redução está relacionado com a energia livre • G = -n. FԐ 0 • G < 0 (a reação é termodinamicamente possível) • G > 0 ( a reação não é termodinamicamente possível) • A termodinâmica não fornece nenhuma informação sobre a velocidade de uma reação.

Aplicação dos Potenciais de Oxidação-Redução • Verificar que espécies irão oxidar ou reduzir uma outra espécie. • Ex: ferro galvanizado (um metal é sacrificado para proteger o outro) • Fe 2+ + 2 e- Fe • Zn 2+ + 2 e- Zn Ԑ 0 = -0, 44 V Ԑ 0 = -0, 76 V

O Zn É SACRIFICADO PARA PROTEGER O FERRO • Em contato com a água ambos os metais podem se oxidar, portanto os potenciais de oxidação são: Fe/Fe 2+ = + 0, 44 V e Zn/Zn 2+ = + 0, 76 V, o que implica dizer que o zinco irá oxidar porque possui maior potencial de oxidação e como G < 0 a dissolução de zinco é mais favorecida energeticamente, de modo que ela deve ocorrer em detrimento da dissolução do ferro.

Aplicação dos Potenciais de Oxidação-Redução • Verificar que espécies irão oxidar ou reduzir uma outra espécie. • Verificar os produtos deste processo. • Verificar estados de oxidação estáveis. • Obter informações sobre reações de desproporcionamento.

REAÇÃO DE DESPROPORCIONAMENTO • O QUE É ? • TRATA-SE DE UMA REAÇÃO REDOX EM QUE UM MESMO ELEMENTO SOFRE SIMULTANEAMENTE OXIDAÇÃO E REDUÇÃO. • 0 -1 +1 • Ex: Cl 2(aq) + H 2 O(l) → Cl- (aq) + HOCl(aq) + H+ (aq) • Cloro 0 → Cloro -1 Cloro 0 → Cloro +1

DESPROPORCIONAMENTO • As reações de desproporcionamento ocorrem quando um íon num dado estado de oxidação se decompõe formando íons com o elemento em questão num estado de oxidação mais alto e mais baixo. • Ex: Cu 2+_____ Cu+ _____ Cu • (Cu + sofre desproporcionamento em solução)

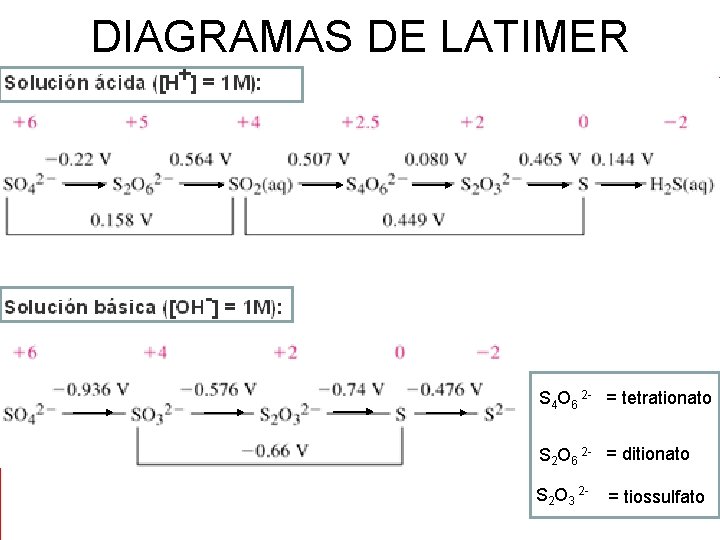
DIAGRAMAS DE LATIMER Diagrama de Latimer para o cloro em meio ácido: +1, 20 +1, 18 +1, 65 +1, 67 +1, 36 • Cl. O 4 - Cl. O 3 - HCl. O 2 HCl. O Cl 2 Cl • +7 +5 +3 +1 0 -1 Diagrama de Latimer para o cloro em meio básico: • +0, 37 +0, 30 +0, 68 +0, 42 +1, 36 • Cl. O 4 - Cl. O 3 - Cl. O 2 - Cl. O- Cl 2 Cl+7 +5 +3 +1 0 -1

DIAGRAMAS DE LATIMER • Os diagramas são compactos e sintetizam grande número de informações, por exemplo fornecem: • uma idéia global da química de redox de cada elemento; • a espontaneidade das reações de redox (observar os valores de E 0 e G); • permitem identificar a força dos ácidos e bases • a espontaneidade das reações de desproporcionamento.

DIAGRAMAS DE LATIMER • . S 4 O 6 2 - = tetrationato S 2 O 6 2 - = ditionato S 2 O 3 2 - = tiossulfato

DIAGRAMAS DE LATIMER • A conversão de um diagrama de Latimer à semi -reação frequentemente envolve o balanceamento de elementos, incluindo a espécie predominante presente em solução ácida que é o H+ e a H 2 O e em solução básica OH- e H 2 O. • A notação: • +1, 20 • Cl. O 4 Cl. O 3+7 +5

NOTAÇÃO E SIGNIFICADO • A NOTAÇÃO ABAIXO REFERE-SE A SEMIREAÇÃO ESCRITA LOGO A SEGUIR • +1, 20 • Cl. O 4 Cl. O 3 Meio ácido p. H=0 +7 +5 Cl. O 4 -(aq) + 2 H+(aq) + 2 e- Cl. O 3 -(aq) + H 2 O(l) Ԑ 0 = + 1, 20 V

NOTAÇÃO E SIGNIFICADO

O que os diagramas identificam? • Os diagramas podem identificar ácidos fortes e fracos: HBr. O (aq) H+(aq) + Br. O- (aq) K = 3, 4 X 10 -8 • (dissociação muito pequena, portanto a espécie predominante em p. H = 0 é o HBr. O) • forma associada/ forma dissociada (HBr. O / Br. O-) • a presença no diagrama, de um ácido na forma associada indica que o ácido é fraco e que se trata de um diagrama para meio ácido.

O que os diagramas identificam? • Em meio básico p. H = 14 • Os diagramas podem identificar bases fortes e fracas • a presença no diagrama, de uma base na forma associada indica que a base é fraca e que se trata de um diagrama para meio básico.

O que os diagramas identificam? • Em meio ácido o hidróxido se dissolveria formando o íon Fe 2+(aq) • Fe(OH)2 (s) + 2 H+(aq) Fe 2+(aq) + 2 H 2 O(l) • Exercício: (Haroldo, pág. 119) • Consultando o diagrama de Latimer, identifique se são fortes ou fracos os seguintes ácidos: HNO 2 (fraco), HNO 3 (forte), HCl. O 2 (fraco), HCl. O 4 (forte), H 5 IO 6 (fraco), H 2 Mn. O 4 (forte), H 2 Fe. O 4 (forte) e H 2 SO 4 (forte).

Como escrever e balancear semiequações e equações de redox: • • a)Iniciar a semi-equação escrevendo as formas oxidada e reduzida do elemento em foco e balancear o número de átomos desse elemento. [ 2 HBr. O (aq) Br 2 (l) ] b)Verificar qual é a variação de seu número de oxidação. 1+ 0 (variação de 1 unidade) (redução)

Como escrever e balancear semiequações e equações de redox: • c)Escrever, na equação, o número conveniente de elétrons (número de elétrons = variação do nº de oxidação X nº de átomos); esses elétrons serão, é claro, escritos à esquerda para uma redução e à direita para uma oxidação. • [ 2 HBr. O (aq) + 2 e- Br 2 (l) ]

Como escrever e balancear semiequações e equações de redox: • d)Balancear a carga elétrica total nos dois lados da equação; para isso adicionar, no lado conveniente, H+ se o meio for ácido e OH- se o meio for básico. • • [2 HBr. O (aq) + 2 e- + 2 H+ (aq) Br 2 (l) ] 0 carga

Como escrever e balancear semiequações e equações de redox: • e)Balancear os átomos de hidrogênio e os de oxigênio, para isso, adicionar, no lado conveniente, tantas moléculas de água quantas forem necessárias. [2 HBr. O (aq) + 2 e- + 2 H+ (aq) Br 2 (l) +2 H 2 O(l)] f)Conferir o balancemento e cada átomo.

Exercícios • Exercício: (Haroldo, pág. 120) • Escreva as semi-equações balanceadas para as seguintes transformações: • Fe. O 42 - (aq) Fe 3+ (aq) (meio ácido) • Mn. O 2 (s) Mn 2+ (aq) (meio ácido) • Br. O 3 - (aq) Br. O- (aq) (meio básico) • N 2 (g) NO 3 - (aq) (meio básico)

Reações de desproporcionamento: • O desproporcionamento ocorre quando o Ԑ 0 de redução à direita é mais positivo que um à esquerda (significa Ԑ>0 - processo espontâneo) • Exs: • +0, 77 -0, 47 • Fe 3+ ____ Fe 2+ ____ Fe (Fe 2+ não sofre desproporcionamento e é estável em solução) • (III) (II) 0 • +0, 15 +0, 50 • Cu 2+ ____ Cu (Cu+ sofre desproporcionamento e é instável em solução, só pode ser encontrado no estado sólido) • (II) (I) 0

Analisando a espontaneidade dos processos: • • • 2 Fe 2+ 2 Fe 3+ + 2 eԐox = -0, 77 V Fe 2+ + 2 e- Fe Ԑred = -0, 47 V ________________ 3 Fe 2+ 2 Fe 3+ + Fe Ԑ = - 1, 24 V (não espontâneo)

Analisando a espontaneidade dos processos: • • Cu+ Cu 2+ + eԐox = -0, 15 V Cu+ + e- Cu Ԑred = +0, 50 V _______________ 2 Cu+ Cu 2+ + Cu Ԑ = + 0, 35 V (espontâneo)

Calculando os E 0 não fornecidos nos diagramas: • +0, 77 -0, 47 • Fe 3+ ____ Fe 2+ ____ Fe • (III) (II) 0 • -0, 057 • • ε° = (n 1. ε 1) + (n 2. ε 2) n 1 + n 2 ε° = (1. 0, 77) + (2. -0, 47) = - 0, 057 V 1+ 2

Calculando os E 0 não fornecidos nos diagramas: • Fe 3+ + e- Fe 2+ E° = + 0, 77 V G = - 0, 77 F • Fe 2+ + 2 e- Fe E° = - 0, 47 V G = + 0, 94 F ___________________ • Fe 3+ + 3 e- Fe G = + 0, 17 F • (termodinamicamente não favorável) • G = Propriedade Extensiva pode ser somada

Calculando os E 0 não fornecidos nos diagramas: • Ԑ 0 = G • - n. F Ԑ= + 0, 77 V como G = -n. F E logo G = - 1. F. (+0, 77) = - 0, 77 F • E = - 0, 47 V como G = -n. F Ԑ logo • G = - 2. F. (-0, 47) = + 0, 94 F • Ԑ 0 = +0, 17 F = - 0, 057 V • -3 F •

• • Calculando os E 0 não fornecidos nos diagramas: +0, 15 +0, 50 Cu 2+ ____ Cu (II) (I) 0 + 0, 33 ε° = (n 1. ε 1) + (n 2. ε 2) n 1 + n 2 ε° = (1. 0, 15) + (1. 0, 50) = 0, 325 V 1+ 1

• • Calculando os E 0 não fornecidos nos diagramas: +0, 15 +0, 50 Cu 2+ ____ Cu (II) (I) 0 + 0, 33 • • • Cu 2+ + e- Cu+ Ԑ = + 0, 15 V G = - 0, 15 F Cu+ + e- Cu Ԑ = + 0, 50 V G = - 0, 50 F ___________________ Cu 2+ + 2 e- Cu G = - 0, 65 F (termodinamicamente favorável)

Calculando os E 0 não fornecidos nos diagramas: • • Ԑ = + 0, 15 V como G = - 1. F. (+0, 15) Ԑ= + 0, 50 V como G = - 1. F. (+0, 50) = G = -n. F Ԑ logo donde G = - 0, 15 F G = -n. F Ԑ logo donde G = - 0, 50 F • Ԑ 0 = - 0, 65 F = + 0, 33 V • -2 F

Desproporcionamento • Exercício: (Lee, pág. 89 e 90) • Identificar, nos diagramas abaixo, as espécies que sofrem desproporcionamento. Calcule o potencial não fornecido: • +0, 682 +1, 776 • O 2 ______* H 2 O 2 ______H 2 O 0 -I -II • +1, 129

Cálculo do Potencial não Fornecido • • • ε° = (n 1. ε 1) + (n 2. ε 2) n 1 + n 2 • • ε° = (1. 0, 682) + (1. 1, 776) = 1, 229 V 1+ 1

Desproporcionamento • H 2 O 2 + e Ԑox = - 0, 682 V • H 2 O 2 + e- H 2 O Ԑred. = + 1, 776 V _______________ • 2 H 2 O 2 + H 2 O Ԑ = +1, 094 V (Processo espontâneo. Logo a água oxigenada sofre desproporcionamento)

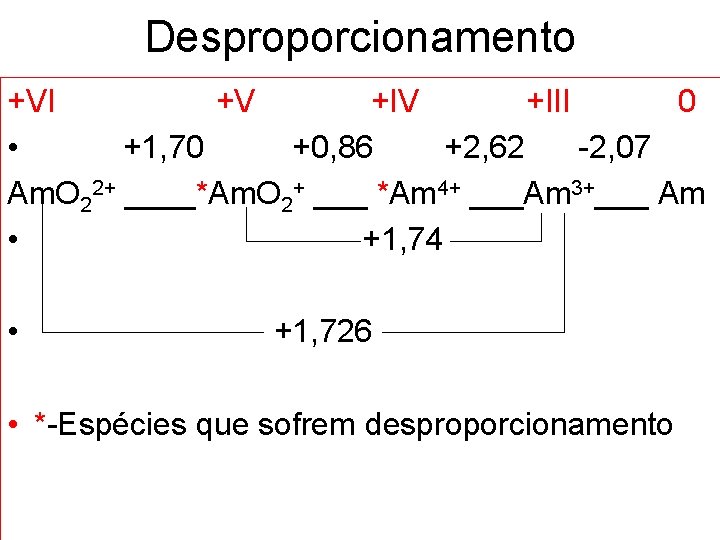
Desproporcionamento +VI +V +III 0 • +1, 70 +0, 86 +2, 62 -2, 07 Am. O 22+ ____*Am. O 2+ ___ *Am 4+ ___Am 3+___ Am • +1, 74 • +1, 726 • *-Espécies que sofrem desproporcionamento

Desproporcionamento • +5 +6 • Am. O 2+ Am. O 22+ + e • Am. O 2+ + 2 e- + 4 H+ Am 3+ Ԑox = - 1, 70 V Ԑred = + 1, 74 V 2 Am. O 2+ +1 e- + 4 H+ Am. O 22+ + Am 3+ Ԑ = + 0, 04 V (processo espontâneo)

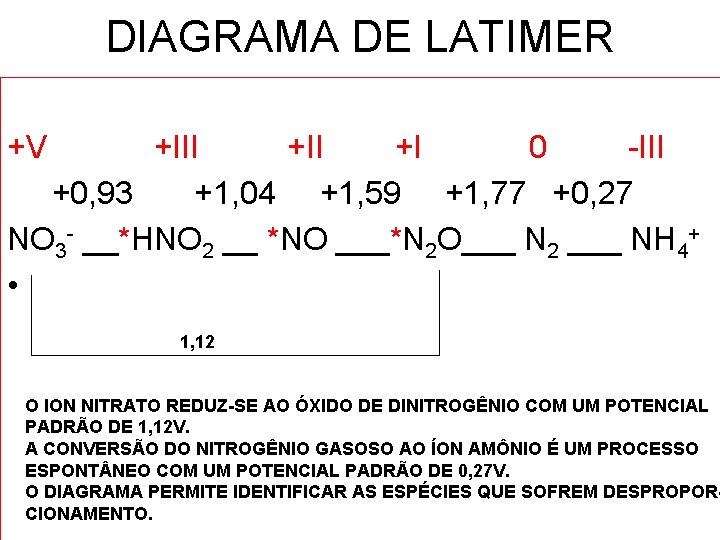
DIAGRAMA DE LATIMER +V +III +I 0 -III +0, 93 +1, 04 +1, 59 +1, 77 +0, 27 NO 3 - __*HNO 2 __ *NO ___*N 2 O___ N 2 ___ NH 4+ • 1, 12 O ION NITRATO REDUZ-SE AO ÓXIDO DE DINITROGÊNIO COM UM POTENCIAL PADRÃO DE 1, 12 V. A CONVERSÃO DO NITROGÊNIO GASOSO AO ÍON AMÔNIO É UM PROCESSO ESPONT NEO COM UM POTENCIAL PADRÃO DE 0, 27 V. O DIAGRAMA PERMITE IDENTIFICAR AS ESPÉCIES QUE SOFREM DESPROPORCIONAMENTO.

DIAGRAMAS DE LATIMER • .

DIAGRAMA DE LATIMER – MEIO ÁCIDO • ÍON SULFATO , COMO AGENTE OXIDANTE, É BASTANTE FRACO EM SOLUÇÕES 1 M DE ÁCIDO. • O DIÓXIDO DE ENXOFRE TEM UM PODER OXIDANTE MODERADO. • O ÍON TIOSSULFATO PODE SER OXIDADO COM FACILIDADE AO TETRATIONATO. • O ÍON TIOSSULFATO SOFRE DESPROPORCIONAMENTO EM MEIO ÁCIDO • O H S É FRACAMENTE REDUTOR EM MEIO ÁCIDO.

DIAGRAMA DE LATIMER – MEIO BÁSICO • PODEMOS CONSTATAR QUE OS ÍONS SULFATO, SULFITO E TIOSSULFATO SÃO FRACOS AGENTES OXIDANTES. • AO CONTRÁRIO , EM MEIO BÁSICO, OS ÍONS SULFITO E TIOSSULFATO PODEM SER OXIDADOS COM FACILIDADE. • O TIOSSULFATO JÁ NÃO É MAIS INSTÁVEL AO DESPROPORCIONAMENTO. LEMBRE-SE QUE O TIOSSULFATO SOFRIA DESPROPORCIONAMENTO EM MEIO ÁCIDO.

ANÁLISE DO DIAGRAMA • ESPÉCIES NO ESTADO +6 COMO H 2 SO 4 E SO 42 - PODEM ATUAR APENAS COMO AGENTES OXIDANTES, E NUNCA COMO AGENTES REDUTORES. • ESPÉCIES NO ESTADO +4 COMO SO 2 E SO 3 -2 PODEM ATUAR COMO AGENTES OXIDANTES OU REDUTORES. • EM SÍNTESE TODAS AS OUTRAS ESPÉCIES, EXCETO AQUELAS COM NOX +6 E -2 PODEM ATUAR COMO AGENTES OXIDANTES OU REDUTORES.

ANÁLISE DO DIAGRAMA • ESPÉCIES NO ESTADO DE OXIDAÇÃO -2 COMO H 2 S E S 2 - PODEM ATUAR APENAS COMO AGENTES REDUTORES, E NUNCA COMO AGENTES OXIDANTES, EM REAÇÕES REDOX.

DIAGRAMA DE LATIMER Diagrama de Latimer para o cloro em meio ácido: +1, 20 +1, 18 +1, 65 +1, 67 +1, 36 • Cl. O 4 - Cl. O 3 - HCl. O 2 HCl. O Cl 2 Cl • +7 +5 +3 +1 0 -1 Diagrama de Latimer para o cloro em meio básico: • +0, 37 +0, 30 +0, 68 +0, 42 +1, 36 • Cl. O 4 - Cl. O 3 - Cl. O 2 - Cl. O- Cl 2 Cl+7 +5 +3 +1 0 -1

ANÁLISE DO DIAGRAMA • UMA ESPÉCIE NA QUAL O NÃO METAL ESTÁ EM SEU MAIS ALTO ESTADO DE OXIDAÇÃO PODE APENAS ATUAR COMO AGENTE OXIDANTE E NUNCA COMO AGENTE REDUTOR. • EX: NO ÍON PERCLORATO O CLORO ESTÁ NO SEU MAIS ALTO ESTADO DE OXIDAÇÃO, (+7). LOGO EM QUALQUER REAÇÃO REDOX QUE O ÍON PERCLORATO PARTICIPE, O CLORO DEVE SER REDUZIDO A UM ESTADO DE OXIDAÇÃO MAIS BAIXO.

ANÁLISE DO DIAGRAMA • DO MESMO MODO , ESPÉCIES NAS QUAIS O NÃO METAL ESTÁ EM SEU MAIS BAIXO ESTADO DE OXIDAÇÃO PODEM APENAS ATUAR COMO AGENTE REDUTOR. • EX. QUER EM MEIO ÁCIDO OU EM MEIO BÁSICO O ÍON CLORETO PODE APENAS ATUAR COMO AGENTE REDUTOR. LEMBRE -SE NO ÍON CLORETO O CLORO ESTÁ NO SEU MAIS BAIXO NÚMERO DE OXIDAÇÃO -1.

ANÁLISE DO DIAGRAMA • UMA ESPÉCIE NA QUAL O NÃO METAL ESTÁ EM UM ESTADO DE OXIDAÇÃO INTERMEDIÁRIO PODE ATUAR COMO AGENTE OXIDANTE OU REDUTOR. • EX: O ÍON CLORATO (Cl. O 3 -) ONDE O NOX. DO CLORO É +5 PODE SER OXIDADO A PERCLORATO (Cl. O 4 - → NOX DO Cl=+7). NESTE CASO O ÍON CLORATO ATUA COMO AGENTE REDUTOR. • QUANDO O ÍON CLORATO (Cl. O 3 -) É POR EXEMPLO, REDUZIDO A CLORETO (Cl-) ELE ATUA COMO AGENTE OXIDANTE.

ANÁLISE DO DIAGRAMA • EM SOLUÇÕES ÁCIDAS TODAS AS ESPÉCIES COM CLORO, EXCETO Cl- , SÃO FORTES AGENTES OXIDANTES. • DUAS REAÇÕES DE DESPROPORCIONAMENTO SÃO IMPORTANTES EM MEIO ALCALINO • Cl 2 + 20 H- → Cl- + Cl. O • 3 Cl. O- → Cl. O 3 - + 2 Cl-

ANÁLISE DO DIAGRAMA • ANALISANDO AINDA O DIAGRAMA PODE – SE CONSTATAR QUE O CLORO É UM AGENTE OXIDANTE MAIS FORTE DO QUE O BROMO OU O IODO. • FACE AO EXPOSTO, O CLORO PODE SER USADO PARA PREPARAR Br 2 E I 2 POR OXIDAÇÃO DOS NIONS Br - E I-. Ex: • Cl 2(g) + 2 Br-(aq) → 2 Cl-(aq) + Br 2(l) • PODE-SE POR EXEMPLO TAMBÉM CONSTATAR QUE O ÁCIDO CLOROSO (HCl. O 2) SOFRE DESPROPORCIONAMENTO.

DIAGRAMA DE LATIMER • +V H 3 PO 4 +III -0, 28 _____ H 3 PO 3 -0, 50 _______ H +I 0 -III -0, 51 -0, 06 _______ P 4 PH 3 3 PO 2 -1, 12 -1, 57 -2, 05 -0, 89 3_______ 2 -_______ -______ PO 4 HPO 3 H 2 PO 2 P 4______ PH 3 0 s oxiânions do fósforo são agentes oxidantes muito fracos em solução básica. Ao contrário, em meio básico os oxiânions do fósforo são bons agentes redutores. O fósforo elementar em meio básico e ácido é instável com respeito ao desproporcionamento, ou seja o P 4 sofre desproporcionamento nos dois meios. O P 4 é melhor agente redutor em meio básico. O ácido fosfórico e o ânion fosfato não são agentes redutores. Os oxiácidos do fósforo não são fortes. Embora o H 3 PO 4 possa ser classificado como um ácido moderadamente forte.

ANÁLISE DO DIAGRAMA • O 2 0, 695 H 2 O 2 1, 763 H 2 O 1, 229 • A H 2 O 2 É UM BOM AGENTE OXIDANTE, MAIS INSTÁVEL EM RELAÇÃO AO SEU DESPROPORCIONAMENTO. • H 2 O 2 H 2 O + 1/2 O 2 desproporcionamento da água oxigenada

DIAGRAMA DE LATIMER PARA O MANGANÊS EM SOLUÇÃO ÁCIDA
 Srie a
Srie a Um rapaz com chapeu observa
Um rapaz com chapeu observa Paisagens naturais e modificadas 3 ano
Paisagens naturais e modificadas 3 ano Elementos de apoio
Elementos de apoio Código homógrafo
Código homógrafo Que son los elementos vulnerables
Que son los elementos vulnerables Telemantica
Telemantica Organismos pluricelulares ejemplos
Organismos pluricelulares ejemplos Textos con elementos gramaticales
Textos con elementos gramaticales El poder del arrepentimiento
El poder del arrepentimiento Elementos comunes de la civilización agrícola
Elementos comunes de la civilización agrícola Para um elemento químico representativo grupos 1 2
Para um elemento químico representativo grupos 1 2 Elementos del cine
Elementos del cine Clasificacion de los elementos quimicos
Clasificacion de los elementos quimicos Base funcion exponencial
Base funcion exponencial Elementos del acotado
Elementos del acotado Elementos de la negociacion mercantil
Elementos de la negociacion mercantil Ecuación fundamental de la contabilidad
Ecuación fundamental de la contabilidad Elementos del enunciado
Elementos del enunciado Los siete pilares de la autoestima
Los siete pilares de la autoestima Tolerancias geometricas
Tolerancias geometricas Introduccion al iva
Introduccion al iva Elementos del ci
Elementos del ci Elementos fundamentales del relato policial
Elementos fundamentales del relato policial Diagramacion de texto
Diagramacion de texto Elementos de un texto argumentativo
Elementos de un texto argumentativo Enzimas de restriccion
Enzimas de restriccion Es un ensayo
Es un ensayo Contrato de reporto mercantil
Contrato de reporto mercantil Texto narrativo elementos
Texto narrativo elementos Cônvexo
Cônvexo Poesia obrerito
Poesia obrerito Texto informativo
Texto informativo Elementos de argumentación
Elementos de argumentación Elementos que conforman el comportamiento organizacional
Elementos que conforman el comportamiento organizacional Trama
Trama Ecosistema acuático con factores bióticos y abióticos
Ecosistema acuático con factores bióticos y abióticos Oratoria de la paz
Oratoria de la paz Arterias musculares ejemplos
Arterias musculares ejemplos Nevesco
Nevesco Elementos dos poliedros
Elementos dos poliedros Elementos intratextuales
Elementos intratextuales Narrar es
Narrar es Asocea
Asocea Elementos profeticos
Elementos profeticos Elementos de un diagnóstico institucional
Elementos de un diagnóstico institucional Elementos armonicos
Elementos armonicos Numero seguridad social tarjeta sanitaria aragon
Numero seguridad social tarjeta sanitaria aragon Funciones de los elementos
Funciones de los elementos Elemento del agua potable
Elemento del agua potable Que es la intertextualidad
Que es la intertextualidad Retenedores indirectos
Retenedores indirectos Cuadro isd
Cuadro isd Definición de estado
Definición de estado