Ch KIM LOI KIM TH V MT S























- Slides: 30

Chủ đề KIM LOẠI KIỀM THỔ VÀ MỘT SỐ HỢP CHẤT QUAN TRỌNG Tiết 2

C. HỢP CHẤT QUAN TRỌNG CỦA CANXI Phần này theo hướng dẫn của BGD-ĐT là hướng dẫn HS tự học ở nhà nên các em nghiên cứu một số nội dung sau: ? Em hãy cho biết công thức hóa học, tính chất của các chất sau: Vôi sống (vôi bột) Nước vôi Đá vôi Thạch cao Ca(OH)2, Ca. CO 3, Ca. O, Ca. SO 4, Ca(HCO 3)2

Phản ứng giải thích sự tạo thành thạch nhũ trong các hang động Ca. CO 3 + CO 2 + H 2 O Ca(HCO 3)2 Chiều thuận: Sự xâm thực của nước mưa đối với đá vôi Chiều nghịch: Sự tạo thành thạch nhũ

3. ỨNG DỤNG CỦA Ca(OH)2, Ca. CO 3 Chế tạo vữa xây nhà Khử chua đất trồng trọt Sản xuất thủy tinh Làm vật liệu xây dựng

2. Ứng dụng của thạch cao Ca. SO 4 Trần thạch cao Tượng thạch cao Sản xuất xi măng Bó bột khi gãy xương

D. NƯỚC CỨNG Thế nào là nước cứng?

D. NƯỚC CỨNG Nước tự nhiên chảy trong lòng đất nên hòa tan nhiều muối Ca 2+, Mg 2+ I. Khái niệm Nước cứng là nước có chứa nhiều ion Ca 2+, Mg 2+

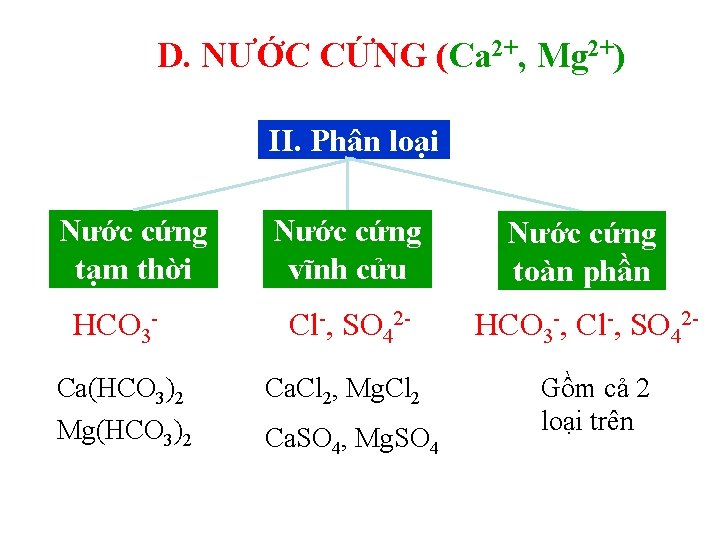
D. NƯỚC CỨNG (Ca 2+, Mg 2+) II. Phân loại Nước cứng tạm thời HCO 3 Ca(HCO 3)2 Mg(HCO 3)2 Nước cứng vĩnh cửu Nước cứng toàn phần Cl-, SO 42 - HCO 3 -, Cl-, SO 42 - Ca. Cl 2, Mg. Cl 2 Ca. SO 4, Mg. SO 4 Gồm cả 2 loại trên

D. NƯỚC CỨNG (Ca 2+, Mg 2+) III. Tác hại của nước cứng Tạo lớp cặn trong ấm nước, nồi hơi, ống nước…→ lãng phí nhiên liệu, không an toàn, làm giảm hương vị khi nấu ăn, làm hao tổn xà phòng khi giặt đồ. . .

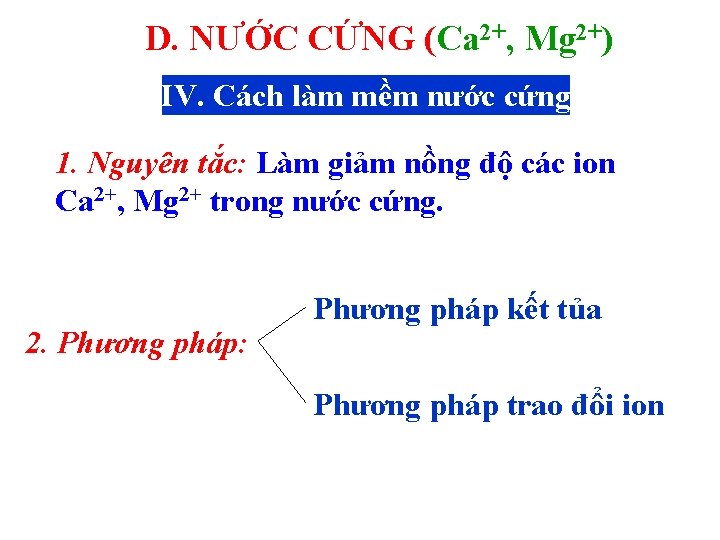
D. NƯỚC CỨNG (Ca 2+, Mg 2+) IV. Cách làm mềm nước cứng 1. Nguyên tắc: Làm giảm nồng độ các ion Ca 2+, Mg 2+ trong nước cứng. 2. Phương pháp: Phương pháp kết tủa Phương pháp trao đổi ion

D. NƯỚC CỨNG (Ca 2+, Mg 2+) Cách làm mềm nước cứng a. Phương pháp kết tủa Đối với nước cứng tạm thời: Đun sôi hoặc dùng Ca(OH)2 vừa đủ để làm mềm nước cứng tạm thời Ca(HCO 3)2 + Ca(OH)2 → 2 Ca. CO 3↓ + 2 H 2 O 0 t Ca(HCO 3)2 → Ca. CO 3↓ + CO 2 + H 2 O - Dùng Na 2 CO 3 (Na 3 PO 4) để làm mất tính cứng tạm thời và vĩnh cửu. Ca(HCO 3)2 + Na 2 CO 3 → Ca. CO 3↓ + 2 Na. HCO 3 Ca. Cl 2 + Na 2 CO 3 → Ca. CO 3↓ + 2 Na. Cl

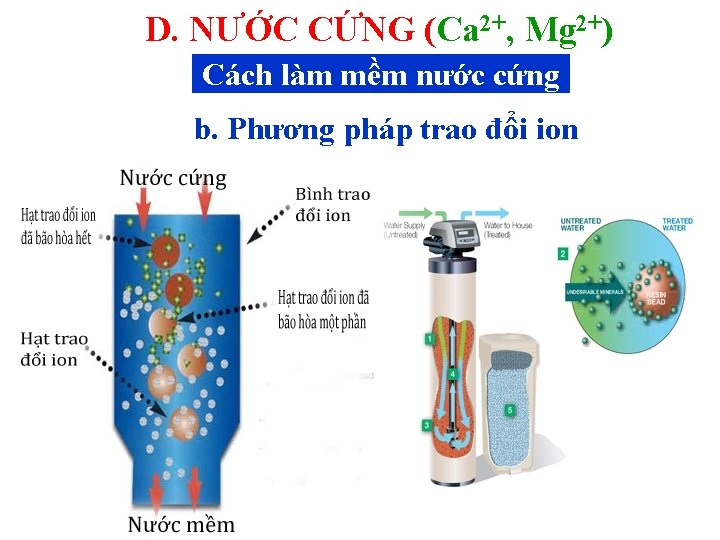
D. NƯỚC CỨNG (Ca 2+, Mg 2+) Cách làm mềm nước cứng b. Phương pháp trao đổi ion

D. NƯỚC CỨNG V. Nhận biết ion Ca 2+, Mg 2+ trong dung dịch Để chứng minh sự có mặt của Ca 2+, Mg 2+ ta dùng dd muối cacbonat (CO 32 ) sẽ tạo ra kết tủa Ca. CO 3 hoặc Mg. CO 3. Sau đó sục khí CO 2 dư thì kết tủa tan ra. Ca 2+ + CO 32 - → Ca. CO 3↓ Ca. CO 3 + CO 2 + H 2 O → Ca(HCO 3)2 (tan) Mg 2+ + CO 32 - → Mg. CO 3↓ Mg. CO 3 + CO 2 + H 2 O → Mg(HCO 3)2 (tan)

CỦNG CỐ C U HỎI TRẮC NGHIỆM Câu 1: Khi cho từ từ CO 2 đến dư vào dung dịch nước vôi trong thì hiện tượng xảy ra là A. có kết tủa xuất hiện sau đó kết tủa không tan. B. có kết tủa màu trắng xuất hiện, sau đó kết tủa tan. C. không có hiện tượng gì D. có kết tủa xuất hiện và có khí bay ra. Câu 2. Cho dd Ca(OH)2 vào dd Ca(HCO 3)2 sẽ có hiện tượng là A. có kết tủa trắng. C. có kết tủa trắng và bọt khí. B. có bọt khí thoát ra D. không có hiện tượng gì.

4 Có 3 ống nghiệm đựng các dung dịch sau: Ống 1: đựng Ca. SO 4 và Mg. Cl 2 NC vĩnh cửu Ống 2: đựng Ca(HCO 3)2 và Mg(HCO 3)2 NC tạm thời Ống 3: đựng Ca(HCO 3)2 và Ca. SO 4 NC toàn phần Nước trong từng ống nghiệm là loại nước cứng nào ?

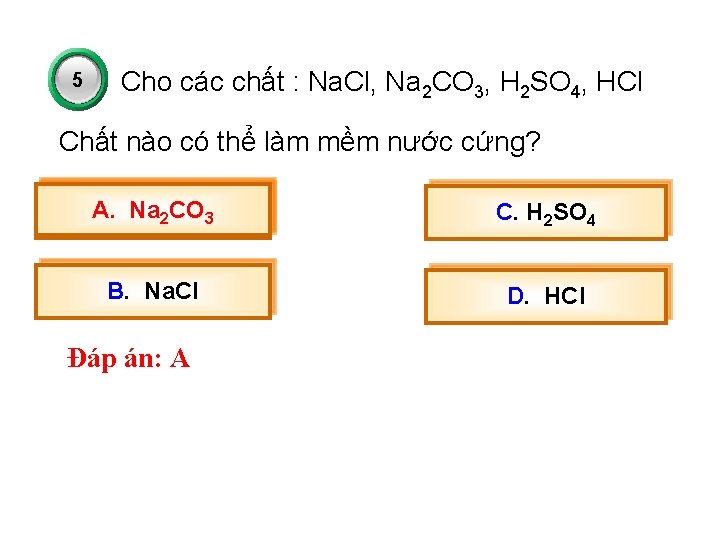
5 Cho các chất : Na. Cl, Na 2 CO 3, H 2 SO 4, HCl Chất nào có thể làm mềm nước cứng? A. Na 2 CO 3 C. H 2 SO 4 B. Na. Cl D. HCl Đáp án: A

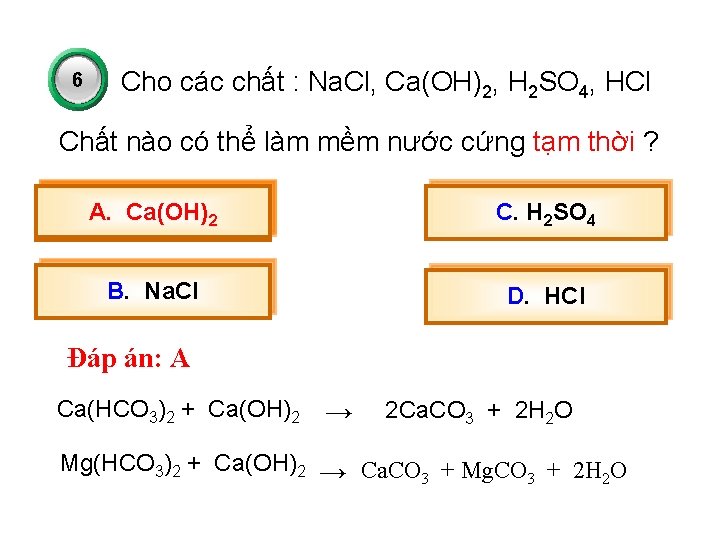
6 Cho các chất : Na. Cl, Ca(OH)2, H 2 SO 4, HCl Chất nào có thể làm mềm nước cứng tạm thời ? A. Ca(OH)2 C. H 2 SO 4 B. Na. Cl D. HCl Đáp án: A Ca(HCO 3)2 + Ca(OH)2 → 2 Ca. CO 3 + 2 H 2 O Mg(HCO 3)2 + Ca(OH)2 → Ca. CO + Mg. CO + 2 H O 3 3 2

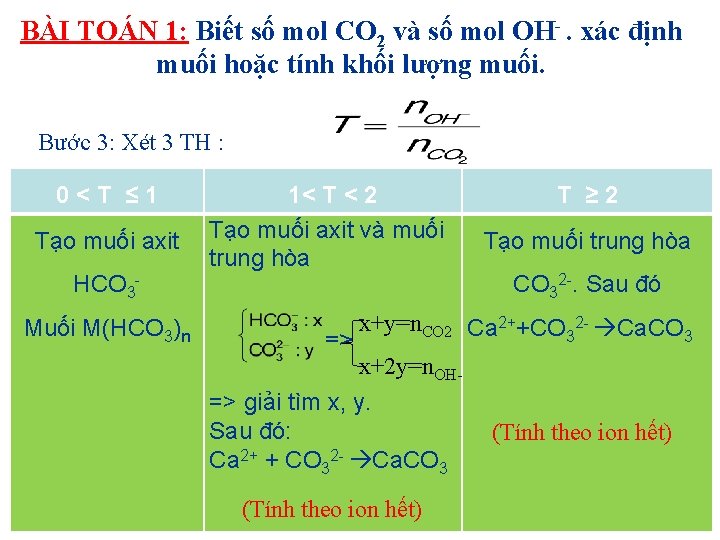
MỘT SỐ DẠNG BÀI TẬP DẠNG 1: CO 2 TÁC DỤNG VỚI DUNG DỊCH KIỀM OH (Na. OH, KOH, Ca(OH)2, Ba(OH)2). BÀI TOÁN 1: Biết số mol CO 2 và số mol OH . xác định muối hoặc tính khối lượng muối. Phương pháp giải: Bước 1: Tính n. CO 2, n. OHBước 2: Các phản ứng có thể xảy ra: CO 2 + OH- HCO 3 - (1) CO 2 + 2 OH- CO 32 - + H 2 O (2)

BÀI TOÁN 1: Biết số mol CO 2 và số mol OH . xác định muối hoặc tính khối lượng muối. Bước 3: Xét 3 TH : 0<T ≤ 1 Tạo muối axit HCO 3 Muối M(HCO 3)n 1< T < 2 Tạo muối axit và muối trung hòa T ≥ 2 Tạo muối trung hòa CO 32 -. Sau đó x+y=n. CO 2 Ca 2++CO 32 - Ca. CO 3 => x+2 y=n. OH=> giải tìm x, y. Sau đó: Ca 2+ + CO 32 - Ca. CO 3 (Tính theo ion hết)

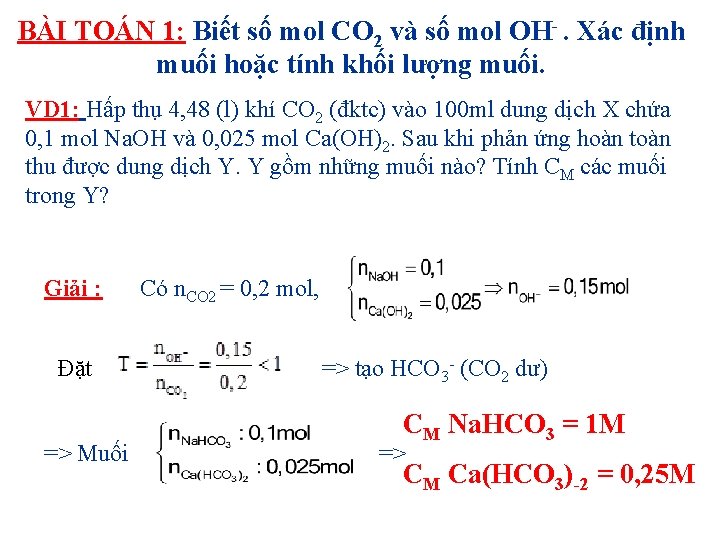
BÀI TOÁN 1: Biết số mol CO 2 và số mol OH . Xác định muối hoặc tính khối lượng muối. VD 1: Hấp thụ 4, 48 (l) khí CO 2 (đktc) vào 100 ml dung dịch X chứa 0, 1 mol Na. OH và 0, 025 mol Ca(OH)2. Sau khi phản ứng hoàn thu được dung dịch Y. Y gồm những muối nào? Tính CM các muối trong Y? Giải : Đặt => Muối Có n. CO 2 = 0, 2 mol, => tạo HCO 3 - (CO 2 dư) CM Na. HCO 3 = 1 M => CM Ca(HCO 3) 2 = 0, 25 M

BÀI TOÁN 1: Biết số mol CO 2 và số mol OH . Xác định muối hoặc tính khối lượng muối. VD 2: Sục 3, 36 (l) CO 2 (đktc) vào 100 ml dung dịch X gồm Na. OH 1 M và Ba(OH)2 2 M. Sau khi phản ứng hoàn thu được m(g) kết tủa. Tính m? Giải : Đặt => tạo CO 32 CO 2 + 2 OH- CO 32 - + H 2 O 0, 15 Ba 2+ + CO 32 - Ba. CO 3 0, 2 0, 15. 197 = 29, 55 g

BÀI TOÁN 1: Biết số mol CO 2 và số mol OH . Xác định muối hoặc tính khối lượng muối. VD 3: Hấp thụ hoàn toàn 0, 06 mol SO 2 vào dung dịch X chứa 0, 03 mol KOH và 0, 02 mol Ca(OH)2. Sau khi các phản ứng hoàn thu được m(g) tủa. Tính m ? Giải : Có n. SO 2 = 0, 06 mol; Đặt Có n. OH- = 0, 03 + 0, 04 = 0, 07 mol 1<T<2 Ca 2+ + SO 32 - Ca. SO 3 0, 02 0, 01. 120 = 1, 2 g n = n. OH- - n. CO 2 =

BÀI TOÁN 1: Biết số mol CO 2 và số mol OH . Xác định muối hoặc tính khối lượng muối. VD 3: Hấp thụ hoàn toàn 0, 06 mol SO 2 vào dung dịch X chứa 0, 03 mol KOH và 0, 02 mol Ca(OH)2. Sau khi các phản ứng hoàn thu được m(g) tủa. Tính m ? Giải : Có n. SO 2 = 0, 06 mol; Đặt n. OH- = 0, 03 + 0, 04 = 0, 07 mol 1<T<2 n = n. OH- - n. SO 2 = 0, 07 Có – 0, 06 = 0, 01 Ca 2+ + SO 32 - Ca. SO 3 0, 02 0, 01. 120 = 1, 2 g

BÀI TOÁN 1: Biết số mol CO 2 và số mol OH . Xác định muối hoặc tính khối lượng muối. VD 4 : hấp thụ hoàn toàn 0, 448 (l) CO 2 vào dung dịch Ca(OH)2 dư thu được m(g) kết tủa. Tính m ? Giải : Vì Ca(OH)2 dư nên n Ca. CO 3 = n. CO 2 = 0, 02 mol => m Ca. CO 3 = 0, 02. 100 = 2 g

BÀI TOÁN 2: Biết số mol CO 2 và kết tủa. Tính OH Phương pháp giải: Xét 2 TH: TH 1: Nếu n. CO 2 ≠ nkết tủa Ca. CO 3 thì loại. TH 2: Tạo 2 ion HCO 3 - và CO 32 - thì n. OH- = n. CO 2 + n. CO 3 2 -(Ca. CO 3)

BÀI TOÁN 2: Biết số mol CO 2 và kết tủa. Tính OH VD 5: Hấp thụ 4, 48 lít khí CO 2(đktc) vào V ml dung dịch Ca(OH)2 0, 25 M. Kết thúc phản ứng thu được 10 g kết tủa. Thể tích V cần dùng là? A. 600 ml Giải: B. 300 ml C. 500 ml D. 100 ml TH 1: n. CO 2 = 0, 2 mol ≠ 0, 1 mol = n. Ca. CO 3 (loại) TH 2: Tạo 2 ion HCO 3 - và CO 32 - thì n. OH- = n. CO 2 + n. CO 3 2 -(Ca. CO 3) = 0, 2 + 0, 1 = 0, 3 mol Mà n. OH- = 0, 25. 2. V = 0, 5 V = 0, 3 =>V = 600 ml

Bài toán 3 : Biết số mol OH và kết tủa. Tính thể tích CO 2 Phương pháp giải: Xét 2 TH: TH 1: n. CO 2 = nkết tủa Ca. CO 3 => V 1 CO 2 = n 1. 22, 4(lít) TH 2: Tạo 2 ion HCO 3 - và CO 32 - thì n. CO 2 = n. OH- + n. CO 3 2 -(Ca. CO 3) => V 2 CO 2= n 2. 22, 4 (lít) Kết luận: VCO 2= V 1 hoặc VCO 2 = V 2

Bài toán 3 : Biết số mol OH và kết tủa. Tính thể tích CO 2 VD 5: Hấp thụ hoàn toàn V(l) khí CO 2 (đktc) vào dung dịch X gồm 0, 3 mol Na. OH và 0, 2 mol Ca(OH)2. Kết thúc phản ứng thu được 15 g kết tủa. Tính VCO 2? Giải: n. Na. OH = 0, 3; n. Ca(OH)2 = 0, 2 n. OH- = 0, 7 mol TH 1: n. CO 2 = n. Ca. CO 3 = 0, 15 V 1 CO 2 = 3, 36 (lít) TH 2: Tạo 2 ion HCO 3 - và CO 32 - thì n. CO 2 = n. OH- + n. CO 3 2 -(Ca. CO 3) = 0, 7 – 0, 15 = 0, 55 mol => V 2 CO 2= n 2. 22, 4 = 0, 55. 22, 4 = 12, 32 (lít) Vậy: VCO 2 = 3, 36 lít hoặc 12, 32 lít

DẶN DÒ Lên Shub classroom làm bài tập
