Chng 6 KIM LOI KIM KIM LOI KIM











- Slides: 13

Chương 6 KIM LOẠI KIỀM, KIM LOẠI KIỀM THỔ, NHÔM

BÀI 25: KIM LOẠI KIỀM VÀ HỢP CHẤT QUAN TRỌNG CỦA KIM LOẠI KIỀM NỘI DUNG BÀI HỌC A. KIM LOẠI KIỀM I. Vị trí trong bảng tuần hoàn, cấu hình electron nguyên tử II. Tính chất vật lí III. Tính chất hóa học IV. Ứng dụng, trạng thái tự nhiên và điều chế

A. KIM LOẠI KIỀM I. Vị trí trong bảng tuần hoàn, cấu hình electron nguyên tử KLK thuộc nhóm IA trong bảng tuần hoàn tuần Liti(Li), cho. Natri(Na), biết tên và Kali(K), kí hiệu. Rubidi(Rb), hoá học của Dựa Gồmvào cácbảng nguyên tố: hoàn Xesi(Cs), các nguyên. Franxi(Fr) tố kim loại kiềm? ? Hãy viết cấu hình e của nguyên tử Li(Z=3), Na(Z=11), K(Z=19) Li(Z=3): 1 s 22 s 1 Na(Z=11): 1 s 22 p 63 s 1 K(Z=19): 1 s 22 p 63 s 23 p 64 s 1 Cấu hình electron nguyên tử: Li: [He] 2 s 1; Na: [ Ne] 3 s 1 ; K: [Ar] 4 s 1 ; Rb: [Kr] 5 s 1; Cs: [Xe] 6 s 1

A. KIM LOẠI KIỀM I. Vị trí trong bảng tuần hoàn, cấu hình electron nguyên tử KLK thuộc nhóm IA, gồm các nguyên tố: Li, Na, K, Rb, Cs Cấu hình e lớp ngoài cùng: ns 1 ( n là số thứ tự của lớp ) II. Tính chất vật lý v. Kim loại kiềm có màu trắng bạc, có ánh kim, dẫn điện tốt, nhiệt độ nóng chảy, sôi, độ cứng thấp, khối lượng riêng nhỏ. §. Nhận xét sự biến đổi 1 số hằng số vật lý quan trọng của kim loại kiềm từ Li đến Cs ? v. Từ Li đến Cs: Nhiệt độ nóng chảy, nhiệt độ sôi, độ cứng nói chung giảm dần Khối lượng riêng tăng dần TN

A. KIM LOẠI KIỀM I. Vị trí trong bảng tuần hoàn, cấu hình electron nguyên tử KLK thuộc nhóm IA, gồm các nguyên tố: Li, Na, K, Rb, Cs Cấu hình e lớp ngoài cùng: ns 1 ( n là số thứ tự của lớp ) II. Tính chất vật lý v. Kim loại kiềm có màu trắng bạc, có ánh kim, dẫn điện tốt, nhiệt độ nóng chảy, sôi, độ cứng thấp, khối lượng riêng nhỏ Tính chất vật lý của kim loại kiềm từ Li đến Cs biến đổi có quy luật là do chúng chỉ có 1 kiểu mạng tinh thể ( lập phương tâm khối) v. Kim loại kiềm có nhiệt đô nóng chảy, nhiệt độ sôi, độ cứng thấp, khối lượng riêng nhỏ do kim loại kiềm có mạng tinh thể lập phương tâm khối, cấu trúc tương đối rỗng. v. Kim loại kiềm có nhiệt độ nóng chảy, nhiệt độ sôi, độ cứng thấp do trong mạng tinh thể các nguyên tử và ion liên kết với nhau bằng lực liên kết kim loại yếu.

A. KIM LOẠI KIỀM I. Vị trí trong bảng tuần hoàn, cấu hình electron nguyên tử KLK thuộc nhóm IA, gồm các nguyên tố: Li, Na, K, Rb, Cs Cấu hình e lớp ngoài cùng: ns 1 ( n là số thứ tự của lớp ) II. Tính chất vật lý: sgk III. Tính chất hóa học §v. Dựa. Cácvào nguyên vị trí tử vàkim đặc điểm loại kiềm cấu tạo có năng nguyên lượng tử của ionkim hoáloại nhỏ, vì kiềmkim vậy nêuloại tínhkiềm chất có hoá tính họckhử ? giải rấtthích mạnh. Tính khử tăng dần từ Li đến Cs

A. KIM LOẠI KIỀM I. Vị trí trong bảng tuần hoàn, cấu hình electron nguyên tử KLK thuộc nhóm IA, gồm các nguyên tố: Li, Na, K, Rb, Cs Cấu hình e lớp ngoài cùng: ns 1 ( n là số thứ tự của lớp ) II. Tính chất vật lý: sgk III. Tính chất hóa học Kim loại kiềm có tính khử rất mạnh: M § Tính chất hoá học chung của kim loại ? v Tác dụng với phi kim v. Tác dụng với axit v. Tác dụng với nước M+ + e

A. KIM LOẠI KIỀM I. Vị trí trong bảng tuần hoàn, cấu hình electron nguyên tử KLK thuộc nhóm IA, gồm các nguyên tố: Li, Na, K, Rb, Cs Cấu hình e lớp ngoài cùng: ns 1 ( n là số thứ tự của lớp ) II. Tính chất vật lý: sgk III. Tính chất hóa học Kim loại kiềm có tính khử rất mạnh: 1. Tác dụng với phi kim M M+ + e a. Tác dụng với oxi 4 Na + O 2 2 Na 2 O kk khô ở toc thường (natri oxit) Na 2 O 2 khí oxi khô (natri peoxit)

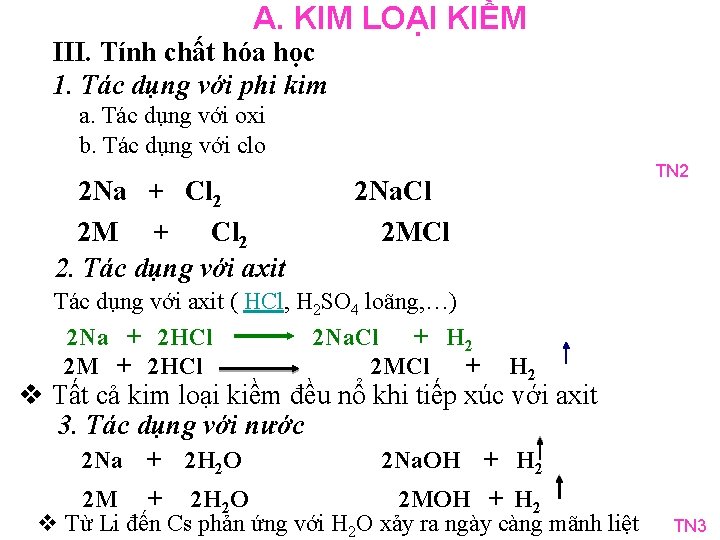
A. KIM LOẠI KIỀM III. Tính chất hóa học 1. Tác dụng với phi kim a. Tác dụng với oxi b. Tác dụng với clo 2 Na + Cl 2 2 M + Cl 2 2. Tác dụng với axit TN 2 2 Na. Cl 2 MCl Tác dụng với axit ( HCl, H 2 SO 4 loãng, …) 2 Na + 2 HCl 2 Na. Cl + H 2 2 M + 2 HCl 2 MCl + H 2 v Tất cả kim loại kiềm đều nổ khi tiếp xúc với axit 3. Tác dụng với nước 2 Na + 2 H 2 O 2 Na. OH + H 2 2 M + 2 H 2 O 2 MOH + H 2 v Từ Li đến Cs phản ứng với H 2 O xảy ra ngày càng mãnh liệt TN 3

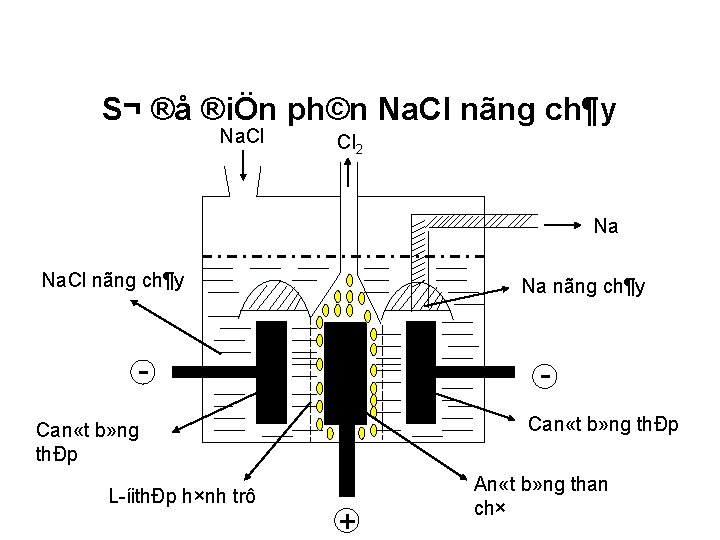
A. KIM LOẠI KIỀM IV. Ứng dụng – Trạng thái tự nhiên - Điều chế 1. Ứng dụng 2. Trạng thái chế tự nhiên 3. Điều ChÕ t¹o hîp kim v tắc: Khử kim ion kim kiềm cácở hợp v Nguyên Trong tự nhiên loại kiềm chỉ trong tồn tại dạng chất hợp chất: chủ yếu ở ChÊt dạng trao muối®æi clorua, nhiÖtsilicat, (K, Na) Kim lo¹i kiÒm + M + e M aluminat ChÕ t¹o tÕ bµo quang ®iÖn (Cs VD: Điện phân nóng chảy Na. Cl 2 Na. Cl đpnc 2 Na + Cl 2 §iÒu chÕ kim lo¹i hiÕm…

S¬ ®å ®iÖn ph©n Na. Cl nãng ch¶y Na. Cl Cl 2 Na Na. Cl nãng ch¶y Na nãng ch¶y Can «t b» ng thÐp L íithÐp h×nh trô + An «t b» ng than ch×

v Kim loại kiềm ở nhóm IA : Li, Na, K, Rb, Cs, Fr v Có nhiệt độ nóng chảy, nhiệt độ sôi, độ cứng thấp, khối lượng riêng nhỏ • Tác dụng với phi kim: O 2, Cl 2, … CỦNG CỐ v. Tính chất hoá học • Tác dụng vối axít: HCl, H 2 SO 4 , …gây nổ • Tác dụng với H 2 O v Ứng dụng • Chế tạo hợp kim có nhiệt độ nóng chảy thấp, hợp kim siêu nhẹ • Cs làm tế bào quang điện vĐiều chế • M+ + e MO • Phương pháp: Quan trọng là điện phân nóng chảy muối halogenua kim loại kiềm Bài tập về nhà: 1, 2, 3, 4, 5 (trang 111/sgk)

BÀI TẬP CỦNG CỐ Câu 1: Cấu hình electron lớp ngoài cùng của kim loại kiềm là? A. ns 1 B. ns 2 C. ns 2 np 1 D. (n-1)dxnsy Câu 4: Có hiện phương tượng hoá xảyhình học ra khi cho. KNa tác vào dụng dung lần cùng lượt dịch Câu 3: 2: Viết Cation M+trinh cógìcấu electron lớp ngoài với H 2 cation O trìnhnào Cu. SO viết hoásau học minh hoạ. 6. 2 SO +4, la 24, H là 2 s. Cl 22 p Mphương đây? A. Ag+ B. Cu+ C. Na+ D. K+

























