Ch KIM LOI KIM TH V MT S






















- Slides: 25

Chủ đề KIM LOẠI KIỀM THỔ VÀ MỘT SỐ HỢP CHẤT QUAN TRỌNG Tiết 1

NỘI DUNG A. KIM LOẠI KIỀM B. KIM LOẠI KIỀM THỔ C. HỢP CHẤT QUAN TRỌNG CỦA CANXI D. NƯỚC CỨNG I. VỊ TRÍ TRONG BẢNG TUẦN HOÀN, CẤU HÌNH ELECTRON NGUYÊN TỬ II. TÍNH CHẤT VẬT LÍ III. TÍNH CHẤT HÓA HỌC IV. ĐIỀU CHẾ - ỨNG DỤNG

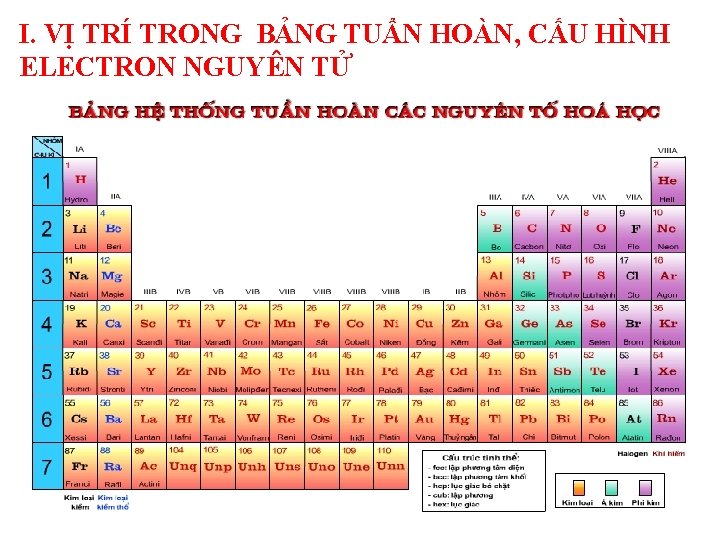
I. VỊ TRÍ TRONG BẢNG TUẨN HOÀN, CẤU HÌNH ELECTRON NGUYÊN TỬ

A. KIM LOẠI KIỀM ( KLK ) Nhóm IA (ns 1) Li ( liti) 2 s 1 B. KIM LOẠI KIỀM THỔ ( KLKT ) Nhóm IIA (ns 2) Be ( beri) 2 s 2 Na ( natri) 3 s 1 Mg ( magie) 3 s 2 K Ca ( canxi) ( kali) 4 s 1 Rb ( rubiđi) 5 s 1 Sr Cs ( xesi) Ba ( bari) 6 s 1 ( stronti) 4 s 2 5 s 2 6 s 2

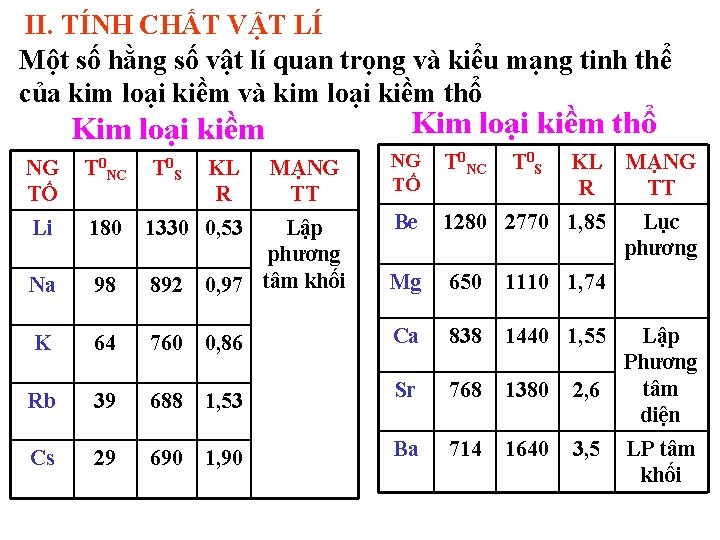
II. TÍNH CHẤT VẬT LÍ Một số hằng số vật lí quan trọng và kiểu mạng tinh thể của kim loại kiềm và kim loại kiềm thổ Kim loại kiềm NG TỐ T 0 NC Li 180 Na T 0 S KL R MẠNG TT NG TỐ T 0 NC KL R MẠNG TT Lục phương T 0 S Be 1280 2770 1, 85 98 Lập phương 892 0, 97 tâm khối Mg 650 1110 1, 74 K 64 760 0, 86 Ca 838 1440 1, 55 Rb 39 688 1, 53 Sr 768 1380 2, 6 Cs 29 690 1, 90 Ba 714 1640 3, 5 1330 0, 53 Lập Phương tâm diện LP tâm khối

BÀI TẬP CỦNG CỐ Câu 1: Cấu hình electron lớp ngoài cùng của kim loại kiềm là? A. ns 1 B. ns 2 C. ns 2 np 1 D. (n-1)dxnsy Câu 2: Cation M 2+ có cấu hình electron lớp ngoài cùng là 2 s 22 p 6. M 2+ là cation nào sau đây? A. Ca 2+ B. Cu 2+ C. Mg 2+ D. Na+

III. TÍNH CHẤT HÓA HỌC - Các nguyên tử KLK, KLKT có ít electron ở lớp ngoài cùng nên có tính khử mạnh. * KLK: Tính khử tăng dần từ Li đến Cs. M → M+ + 1 e Trong hợp chất KLK có số oxi hóa +1 * KLKT: Tính khử tăng dần từ Be đến Ba. M → M 2+ + 2 e Trong hợp chất KLKT có số oxi hóa +2

III. TÍNH CHẤT HÓA HỌC 1. Tác dụng với phi kim: O 2, Cl 2. . . 2. Tác dụng với axit: HCl, H 2 SO 4. . . 3. Tác dụng với nước H 2 O. . .

III. TÍNH CHẤT HÓA HỌC Tính khử mạnh 1. Tác dụng với phi kim: O 2, Cl 2. . . 4 M + n. O 2 → 2 M 2 On (oxit) 2 M + n. Cl 2 → 2 MCln (muối) KLKT KLK 4 Na + O 2→ 2 Na 2 O 2 K + Cl 2 → 2 KCl TN đốt Mg Mg+ Cl 2→Mg. Cl 2 2 Mg+ O 2→ 2 Mg. O

III. TÍNH CHẤT HÓA HỌC Tính khử mạnh 2. Tác dụng với axit: HCl, H 2 SO 4. . . 2 M + 2 n. H+ → 2 Mn+ + n. H 2 KLK 2 Na + 2 HCl→ 2 Na. Cl +H 2↑ 2 K + H 2 SO 4→K 2 SO 4 + H 2↑ KLKT Mg+2 HCl→Mg. Cl 2+H 2↑ Ca+H 2 SO 4→Ca. SO 4+H 2↑ Tác dụng với axit: HNO 3 , H 2 SO 4 đặc. . . 4 Mg +10 HNO 3 (l)→ 4 Mg(NO 3)2 + NH 4 NO 3+ 3 H 2 O 4 Mg + 5 H 2 SO 4đ → 4 Mg. SO 4 + H 2 S + 4 H 2 O

III. TÍNH CHẤT HÓA HỌC Tính khử mạnh 3. Tác dụng với nước 2 M + 2 n H 2 O → 2 M(OH)n + n H 2 KLKT KLK khử mạnh với nước Be không khử Mg khử chậm với nước nóng Ca, Sr, Ba, khử mạnh 2 Na +2 H 2 O → 2 Na. OH + H 2↑ TN KLK td với nước Ba +2 H 2 O →Ba(OH)2+H 2↑ TN KLKT td với nước

IV. ĐIỀU CHẾ Nguyên tắc: M n+ + ne → M Phương pháp: Điện phân nóng chảy muối halogen MXn Khử ion KL: VD: 2 Na. Cl Ca. Cl 2 2 Na + Cl 2 Ca + Cl 2

Câu hỏi Câu 1. Chọn câu sai khi nói về KLK và KLKT A. Cùng khử phi kim thành ion âm B. Cùng khử H+ trong HCl, H 2 SO 4 loãng thành H 2 C. Cùng khử nước rất mạnh ở điều kiện thường D. Cùng được điều chế bằng phương pháp đpnc

Câu 2: Tính chất hóa học đặc trưng của kim loại kiềm thổ? A. Tác dụng với axit chỉ tạo ra khí H 2. B. Dễ nhận electron để trở thành các ion dương. C. Có tính khử mạnh, tính khử tăng dần từ Be đến Ba. D. Đều phản ứng với nước giải phóng khí H 2. .

V. ỨNG DỤNG Trong tự nhiên KLK và KLKT có ở đâu và được ứng dụng làm gì?

Một số hình ảnh ứng dụng của hợp chất Na


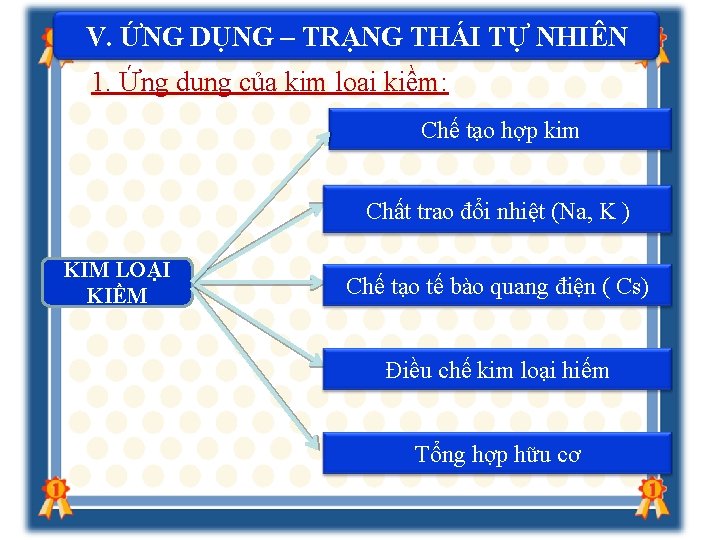
V. ỨNG DỤNG – TRẠNG THÁI TỰ NHIÊN kiềm: 1. Ứng dụng của kim loại Chế tạo hợp kim Chất trao đổi nhiệt (Na, K ) KIM LOẠI KIỀM Chế tạo tế bào quang điện ( Cs) Điều chế kim loại hiếm Tổng hợp hữu cơ

Trạng thái tự nhiên của KLKT Đá xây dựng Vỏ ốc chứa nhiều Ca Magie Thực phẩm chứa canxi và Vitamin

BÀI TẬP CỦNG CỐ Câu 1. Công dụng nào sau đây không phải của Na. Cl ? A. Làm gia vị B. Điều chế Cl 2, HCl, nước Gia-ven C. Khử chua cho đất D. Làm dịch truyền trong y tế Đáp án D

BÀI TẬP CỦNG CỐ BT 2: Cho 4, 4 (g) hỗn hợp hai kim loại nhóm IIA kế tiếp nhau tác dụng với dung dịch HCl dư thì thu được 3, 36 (lit) H 2 đkc. Hai kim loại là A. Ca, Sr C. Mg, Ca B. Be, Mg D. Sr, Ba Đáp án: C Số mol H 2 = 3, 36 : 22, 4=0, 15 mol Số mol hh kim loại = số mol H 2 (theo pư) Mtb KL= 4, 4 : 0, 15 = 29, 333 (Mg 24 và Ca 40)

BÀI TẬP CỦNG CỐ BT 3. Hoà tan hoàn toàn 14, 5 g hỗn hợp gồm Mg, Fe, Zn bằng dung dịch HCl dư, sau phản ứng thu được 6, 72 lít khí (đktc). Khối lượng muối clorua thu được sau phản ứng là A. 53, 8 gam C. 38, 5 gam B. 83, 5 gam D. 35, 8 gam Đáp án: D n. H 2=6, 72: 22, 4=0, 3 mol mmuô i=m. KL + 71*n. H 2= 14, 5+71*0, 3=35, 8

Tính khối lượng muối => Sử dụng định luật bảo toàn khối lượng C 1: mhh kim loại + m axit = mmuối + m khí C 2 : m muối = m kim loại + m gốc axit chú ý : n. H 2 = n. H 2 SO 4 = 1/2 n. HCl Dạng 1 KL + HCl muô i + H 2 ta có mmuô i=m. KL + 71 n. H 2. Dạng 2 Oxit KL + HCl Muô i + H 2 O ta có mmuô i=moxit + 27, 5 n. HCl Dạng 3 M + H 2 SO 4 Muô i + H 2 ta có mmuô i=m. KL + 96 n. H 2. Dạng 4 Oxit KL + H 2 SO 4 Muô i + H 2 O ta có mmuô i=moxit + 80 n. H 2 SO 4

DẶN DÒ - Tiết sau chúng ta sẽ nghiên cứu phần còn lại: + hợp chất của canxi và nước cứng + giới thiệu một số dạng bài tập - Các em vào SHub Classroom để làm bài ôn tập và kiểm tra
