AULO UEM 2013 PROFESSOR SOUZA PROPRIEDADES DA MATRIA


































- Slides: 49

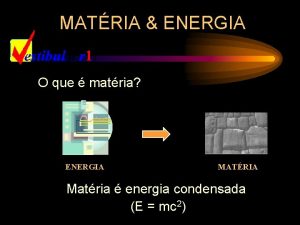
AULÃO UEM 2013 PROFESSOR SOUZA

PROPRIEDADES DA MATÉRIA

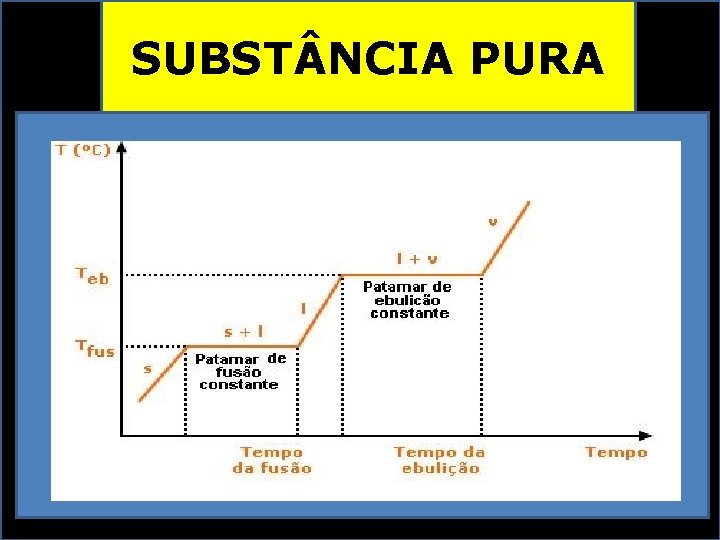
SUBST NCIA PURA PROPRIEDADES FÍSICAS CONSTANTES

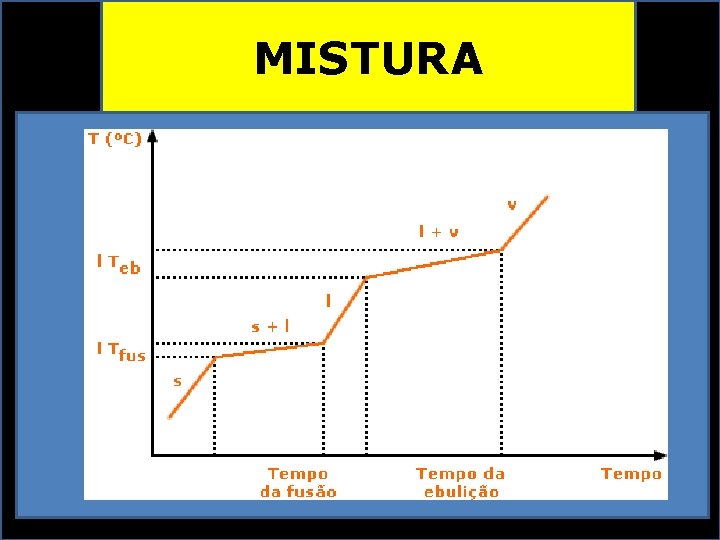
MISTURA PROPRIEDADES FÍSICAS VARIÁVEIS

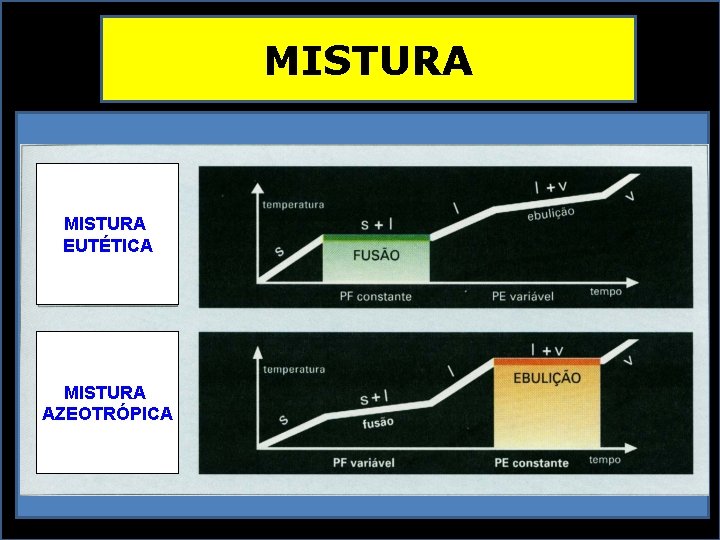
MISTURA EUTÉTICA MISTURA AZEOTRÓPICA

EQUIPAMENTOS DE LABORATÓRIO DISSOLUÇÃO DE SUBST NCIAS, AQUECIMENTO DE LÍQUIDOS E TITULOMETRIA

ESCOAMENTO DE LÍQUIDOS (TITULOMETRIA) E MEDIDA DE VOLUMES

MEDIDAS DE PRECISÃO DE VOLUMES DE LÍQUIDOS

UTILIZADOS PARA SEPARAÇÃO DE SÓLIDOS DE LÍQUIDOS

ACOPLADO AO KITASSATO UTILIZADO NAS FILTRAÇÕES A VÁCUO.

FILTRAÇÃO A VÁCUO.

SEPARAÇÃO DE LÍQUIDOS IMISCÍVEIS

MEDIDIDAS DE VOLUMES LÍQUIDOS

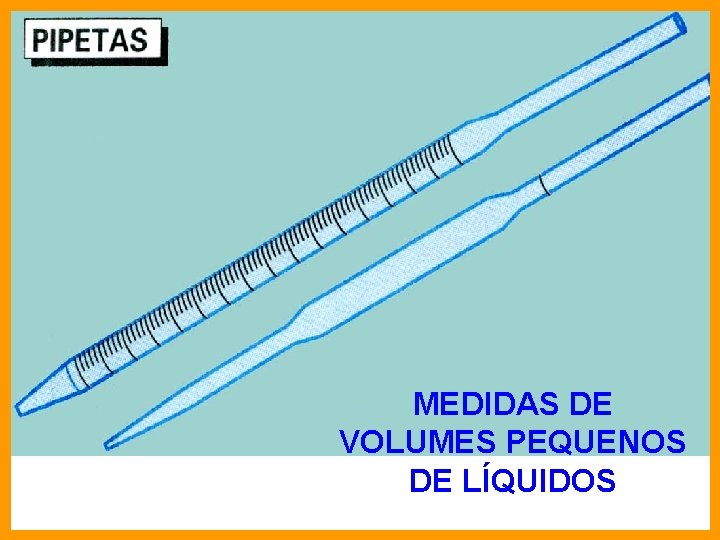
MEDIDAS DE VOLUMES PEQUENOS DE LÍQUIDOS

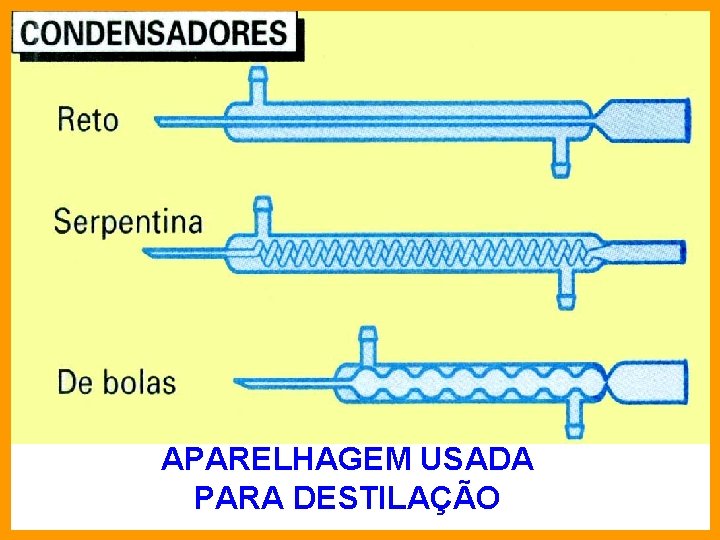
USADO NOS PROCESSOS DE DESTILAÇÃO

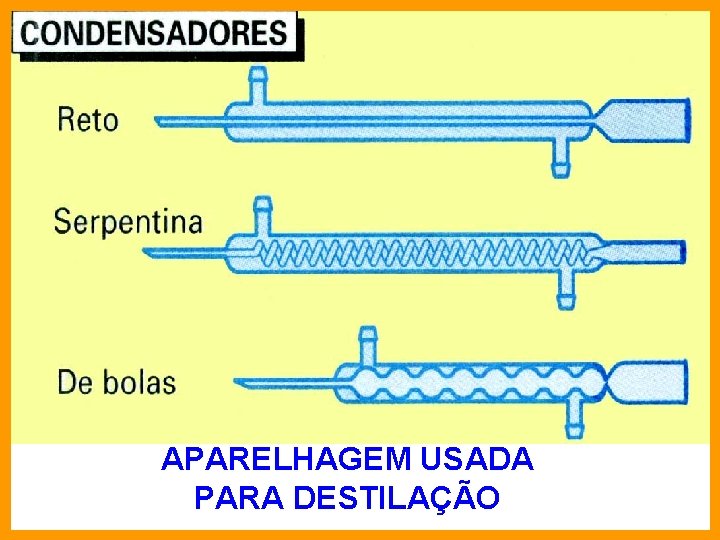
APARELHAGEM USADA PARA DESTILAÇÃO

APARELHAGEM USADA PARA DESTILAÇÃO

USADO PARA AQUECER SÓLIDOS A ALTAS TEMPERATURAS

SEPARAÇÃO DOS SISTEMAS HETEROGÊNEOS SÓLIDO X SÓLIDO DISSOLUÇÃO FRACIONADA SÓLIDO X LÍQUIDO FILTRAÇÃO LÍQUIDO X LÍQUIDO DECANTAÇÃO

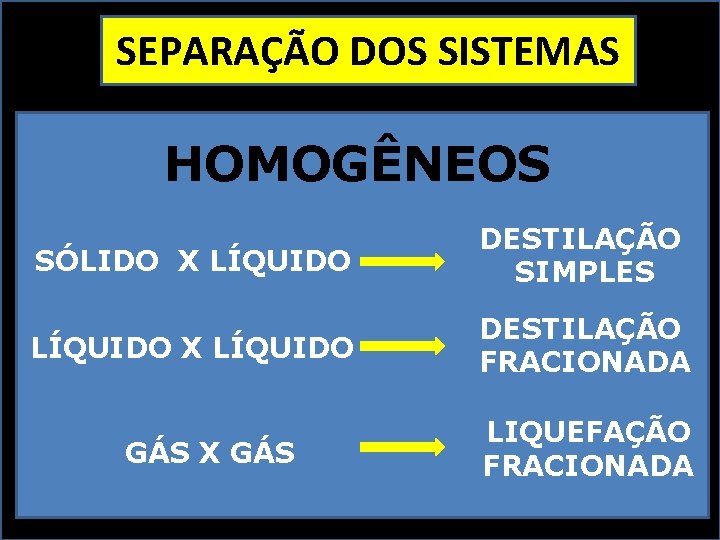
SEPARAÇÃO DOS SISTEMAS HOMOGÊNEOS SÓLIDO X LÍQUIDO DESTILAÇÃO SIMPLES LÍQUIDO X LÍQUIDO DESTILAÇÃO FRACIONADA GÁS X GÁS LIQUEFAÇÃO FRACIONADA

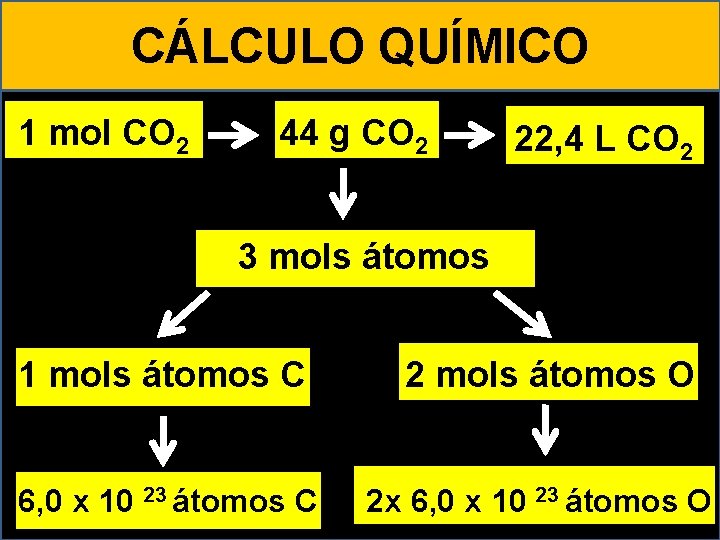
CÁLCULO QUÍMICO 1 mol CO 2 44 g CO 2 22, 4 L CO 2 23 moléculas 3 mols átomos 6, 0 x 10 1 mols átomos C 6, 0 x 10 23 átomos C 2 mols átomos O 2 x 6, 0 x 10 23 átomos O

CÁLCULO QUÍMICO RESOLUÇÃO A dose diária recomendada de vitamina C (C 6 H é 23 moléc. 8 O 6) ----- 6, 0 x 10 176 g C H O 6 70 8 mg. 6 aproximadamente Quando uma pessoa ingere 500 x 10 500 -3 mg g C 6 de H 8 O 6 ----- x moléc. vitamina C, o número de moléculas ingeridas foi de: 21 X = 1, 7 x 10 moléculas C 6 H 8 O 6 Dados: M(C 6 H 8 O 6 ) = 176 g/mol; Número de Avogadro: 6, 0 X 10 23

Cada m. L de Pepsamar Gel contém 0, 06 g de hidróxido de alumínio. A massa de ácido clorídrico do suco gástrico que é neutralizada, quando uma pessoa ingere 6, 50 m. L desse medicamento: 1 ml de Gel ---- 0, 06 g Al(OH)3 6, 5 ml Gel ----- x X = 0, 39 g Al(OH)3 3 HCl + 1 Al(OH)3 → 1 Al. Cl 3 + 3 H 2 O 3 x 36, 5 g HCl -- 1 x 78 g Al(OH)3 X ------- 0, 39 g Al(OH)3 X = 0, 54 g HCl

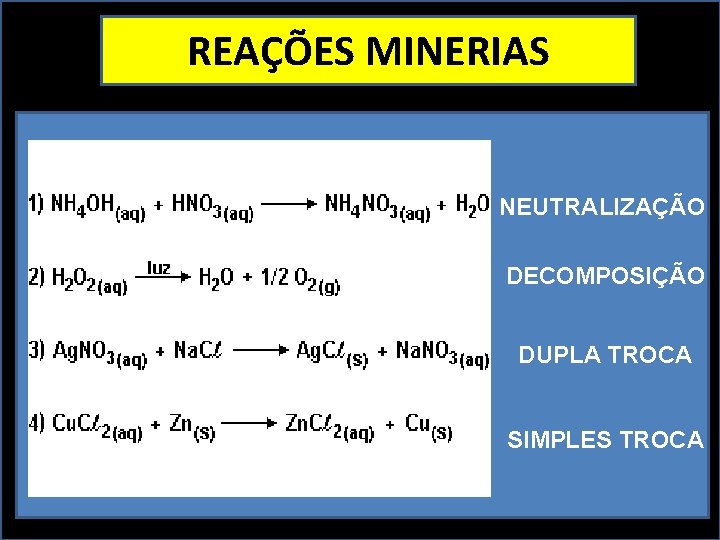
REAÇÕES MINERIAS NEUTRALIZAÇÃO DECOMPOSIÇÃO DUPLA TROCA SIMPLES TROCA

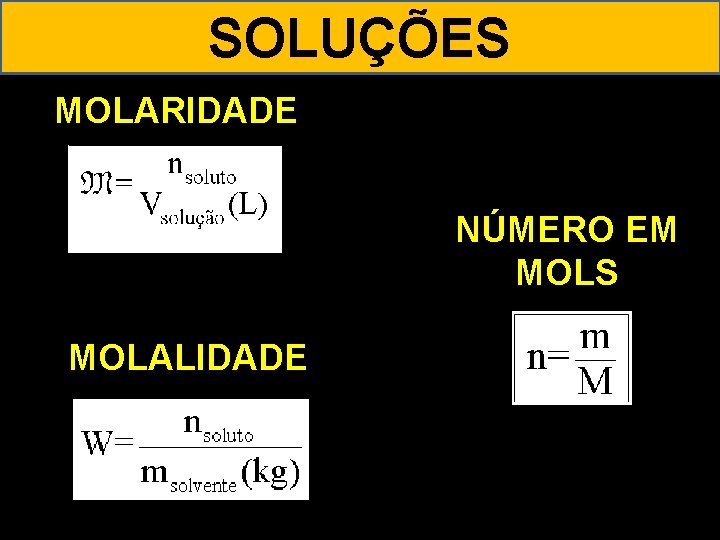
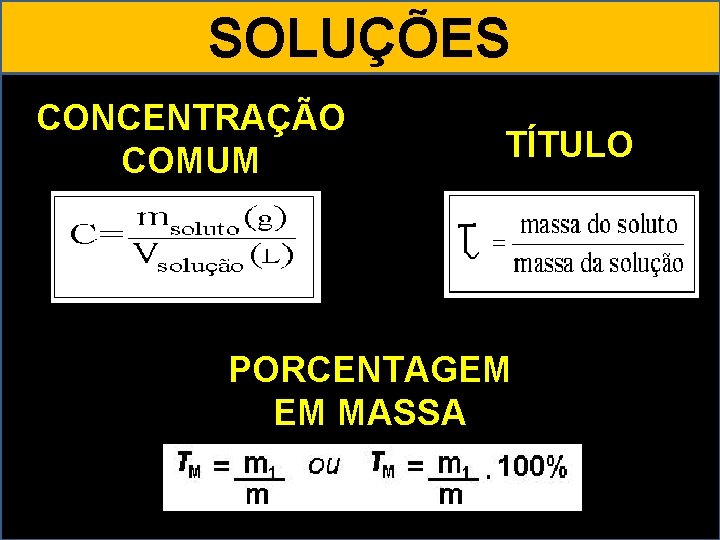
SOLUÇÕES MOLARIDADE NÚMERO EM MOLS MOLALIDADE

SOLUÇÕES CONCENTRAÇÃO COMUM TÍTULO PORCENTAGEM EM MASSA

MOLARIDADE RESOLUÇÃO Qual é a molaridade da solução de ácido clorídrico, de densidade 1, 18 g/m. L e com 36, 5 % de HCl em massa: M. M 1 = T. d. 1000 M HCl. 36, 5 = 0, 365. 1, 18. 1000 MHCl = 11, 8 mols/L

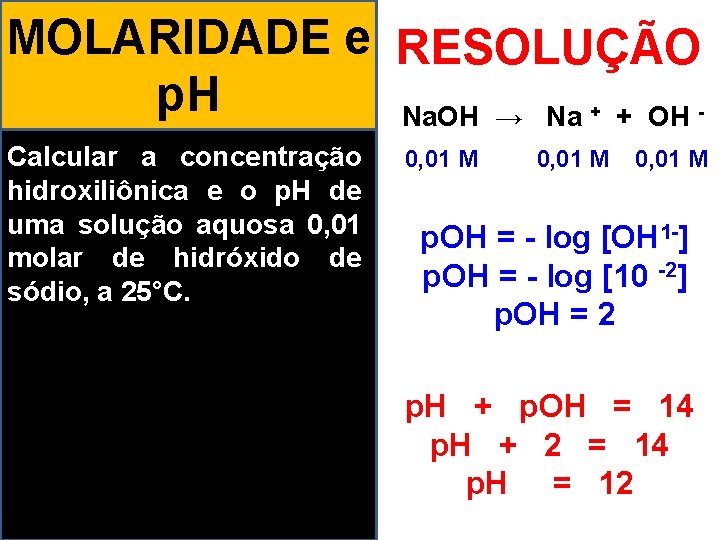
MOLARIDADE e RESOLUÇÃO p. H Na. OH → Na + OH + - Calcular a concentração 0, 01 M hidroxiliônica e o p. H de uma solução aquosa 0, 01 p. OH = - log [OH 1 -] molar de hidróxido de -2] p. OH = - log [10 sódio, a 25°C. p. OH = 2 p. H + p. OH = 14 p. H + 2 = 14 p. H = 12

DILUIÇÃO Ci. Vi = Cf. Vf ou Mi. Vi = Mf. Vf MISTURA DE SOLUÇÕES Cf. Vf = CA. VA + CB. VB Mf. Vf = MA. VA + MB. VB

DILUIÇÃO Para preparar 1, 2 litros de solução 0, 4 M de HCl, a partir do ácido concentrado (16 M), o volume de água, em litros, a ser utilizado será de: RESOLUÇÃO M 1 . V 1 = M 2. V 2 16. V 1 = 0, 4. 1, 2 V 1 = 0, 03 Litros V água = V 2 - V 1 V água = 1, 2 – 0, 03 V água = 1, 17 Litros

TITULOMETRIA RESOLUÇÃO Qual será o volume, em mililitros (m. L), de uma solução aquosa de hidróxido de sódio 0, 10 +. M . V = M . V . OHH 1 1 2 2 mol/L necessário para neutralizar 25 m. L de uma solução aquosa de ácido 1. 0, 3. 25 = 0, 1. V 2 . 1 clorídrico 0, 30 mol/L? V Na. OH = 75 m. L

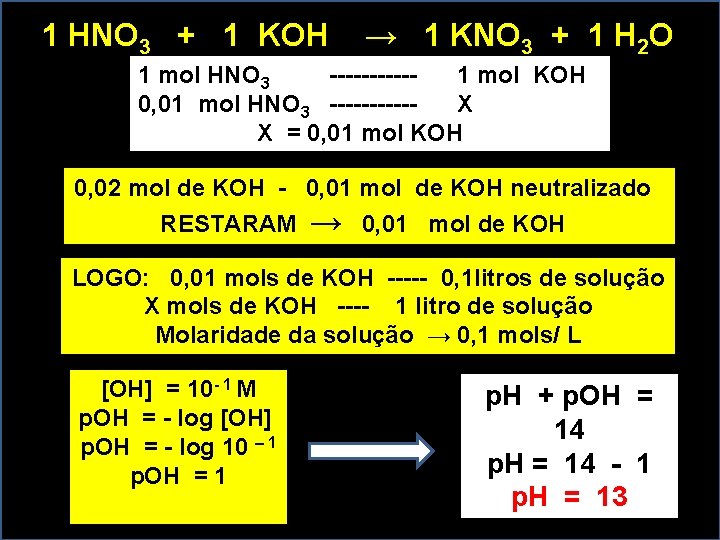
1 HNO 3 + 1 KOH → 1 KNO 3 + 1 H 2 O 1 mol HNO 3 ------ 1 mol KOH 0, 01 mol HNO 3 ------ X X = 0, 01 mol KOH 0, 02 mol de KOH - 0, 01 mol de KOH neutralizado RESTARAM → 0, 01 mol de KOH LOGO: 0, 01 mols de KOH ----- 0, 1 litros de solução X mols de KOH ---- 1 litro de solução Molaridade da solução → 0, 1 mols/ L [OH] = 10 - 1 M p. OH = - log [OH] p. OH = - log 10 – 1 p. OH = 1 p. H + p. OH = 14 p. H = 14 - 1 p. H = 13

80, 0 m. L de uma solução aquosa de hidróxido de potássio de concentração 0, 250 mol/L são parcialmente neutralizados por 20 m. L de uma solução aquosa de ácido nítrico de concentração 0, 5 mol/L. Calcule o p. H da solução resultante. HNO 3 20 m. L e 0, 5 M KOH 80 m. L e 0, 250 M n HNO 3 =0, 5. 0, 02 n KOH = 0, 250. 0, 08 n HNO 3 = 0, 01 mols n KOH = 0, 02 mols

+2 +5 -2 +4 -2 0 +2 +4 -2 +2 -2 0 2 Ca 3 6 (PO 4)2 + Si. O 2 +10 C 6 Ca. Si. O +10 CO +1 P 3 REDUÇÃO ∆ = 5. 4 = 20 ( 10 ) OXIDAÇÃO ∆ = 2. 1 = 2 ( 1 ) V F V V V F 4 1 10 O carbono sofreu uma oxidação. O Nox do silício variou de 4 unidades. O fosfato de cálcio é o agente oxidante. O Nox do fósforo no Ca 3 (PO 4) 2 é +5. Após o balanceamento da equação, os menores coeficientes inteiros encontrados foram 2, 6, 10, 1. O silício sofreu uma oxidação.

PROPRIEDADES COLIGATIVAS QUANTO MAIOR O NÚMERO E PARTÍCULAS NA SOLUÇÃO MAIOR O EFEITO COLIGATIVO

EFEITOS COLIGATIVOS TONOSCOPIA EBULIOSCOPIA CRIOSCOPIA OSMOSCOPIA

TONOSCOPIA PRESSÃO MÁXIMA DE VAPOR EBULIOSCOPIA TEMPERATURA DE EBULIÇÃO

CRIOSCOPIA TEMPERATURA DE CONGELAMENTO OSMOSCOPIA PRESSÃO OSMÓTICA

V 1) A passagem do solvente, através de uma membrana semipermeável, para a solução mais concentrada é chamada de osmose. 02) A pressão osmótica é a pressão que deve ser aplicada em sentido oposto ao fluxo do solvente para evitar a osmose. V F F V F 04) A pressão osmótica depende da quantidade de partículas e da natureza do soluto. 08) Uma solução aquosa 1, 0 mol/L de Na. Cl apresentará mesma pressão osmótica que uma solução aquosa 0, 5 mol/L de Ca. Cl 2. 16) À pressão constante, uma solução aquosa de Al. Cl 3 congelará a uma temperatura menor que da água pura. 32) À pressão constante, a pressão de vapor de uma solução aquosa de etileno glicol é maior que a pressão de vapor da água pura.

δ ( ) possuem alto poder de penetração, podendo causar danos irreparáveis ao ser humano. β ( ) são partículas leves com carga elétrica negativa e massa desprezível. δ ( ) são radiações eletromagnéticas semelhantes aos raios X, não possuem carga elétrica nem massa. α ( ) são partículas pesadas de carga elétrica positiva que, ao incidirem sobre o corpo humano, causam apenas queimaduras leves.

VI - As radiações gama são ondas eletromagnéticas de elevado poder de penetração. FII - O número atômico de um radionuclídeo que emite radiações alfa aumenta em duas unidades. V III - As radiações beta são idênticas aos elétrons e possuem carga elétrica negativa. V IV - O número de massa de um radionuclídeo que emite radiações beta não se altera. V - As radiações gama possuem carga nuclear +2 e F número de massa 4.

LEIS DA RADIOATIVIDADE 1ª Lei da Radioatividade (lei de Soddy) "Quando um núcleo emite uma partícula alfa (a) , seu número atômico diminui de duas unidades e seu número de massa diminui de quatro unidades. " 235 U 92 4 + a 2 231 Th 90

2º Lei da Radioatividade (Soddy-Fajans-Russel) “ Quando um núcleo emite uma partícula beta, seu número atômico aumenta de uma unidade e seu número de massa não se altera. “ 234 Th 90 0 -1 + 234 Pa 91

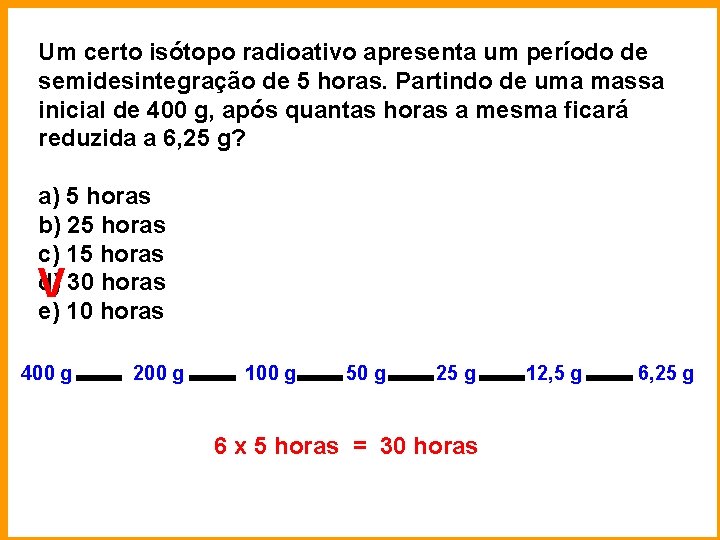
Um certo isótopo radioativo apresenta um período de semidesintegração de 5 horas. Partindo de uma massa inicial de 400 g, após quantas horas a mesma ficará reduzida a 6, 25 g? a) 5 horas b) 25 horas c) 15 horas d) 30 horas e) 10 horas V 400 g 200 g 100 g 50 g 25 g 12, 5 g 6, 25 g 6 x 5 horas = 30 horas

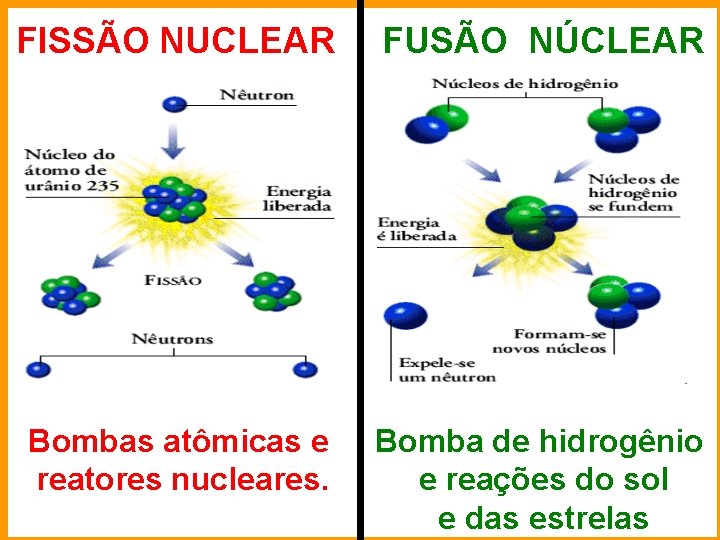
FISSÃO NUCLEAR FUSÃO NÚCLEAR Bombas atômicas e reatores nucleares. Bomba de hidrogênio e reações do sol e das estrelas

E os resultados? ? ? O concorrente. . .


E o nosso aluno ALFA. . .

 Aulo persio flacco
Aulo persio flacco Matria
Matria Promotion from assistant to associate professor
Promotion from assistant to associate professor Resposta interpretativa argumentativa
Resposta interpretativa argumentativa Gerador
Gerador Como fazer uma carta resposta argumentativa
Como fazer uma carta resposta argumentativa Dispersões
Dispersões What are the 4 strands of sexuality
What are the 4 strands of sexuality Dra mirella gastropediatra
Dra mirella gastropediatra Paula souza
Paula souza Marcone jamilson freitas souza
Marcone jamilson freitas souza Laringotraqueomalacia
Laringotraqueomalacia Val de souza
Val de souza Marcone jamilson freitas souza
Marcone jamilson freitas souza Elvira souza lima livros
Elvira souza lima livros Guido lemos de souza filho
Guido lemos de souza filho Repudio positivista de wundt
Repudio positivista de wundt Irineu de souza francisco
Irineu de souza francisco Hansel d'souza
Hansel d'souza Mirella gomes de souza
Mirella gomes de souza Paula souza
Paula souza Alfred souza
Alfred souza El comedor paulo souza
El comedor paulo souza Marcone jamilson freitas souza
Marcone jamilson freitas souza Marcone jamilson freitas souza
Marcone jamilson freitas souza Edilece souza couto
Edilece souza couto Cronograma projeto de tese doutorado
Cronograma projeto de tese doutorado Otimização combinatória
Otimização combinatória Mirella gomes de souza
Mirella gomes de souza Souza instrumentos musicais
Souza instrumentos musicais Anita d'souza md
Anita d'souza md Antonio francisco de paula souza
Antonio francisco de paula souza Jonathan dsouza
Jonathan dsouza Mabel
Mabel Marcone jamilson freitas souza
Marcone jamilson freitas souza Luiz vicente de souza queiroz
Luiz vicente de souza queiroz Matriz
Matriz Propriedades específicas da matéria
Propriedades específicas da matéria Log
Log Limite e continuidade de funções
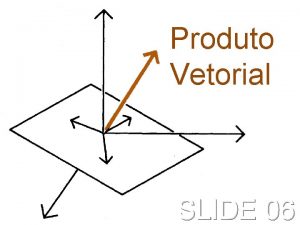
Limite e continuidade de funções Produto vetorial propriedades
Produto vetorial propriedades Perispírito formação propriedades e funções
Perispírito formação propriedades e funções Tonoscopia
Tonoscopia Propriedades logaritmo
Propriedades logaritmo Propiedades aperiodicas
Propiedades aperiodicas Produto escalar de vetores
Produto escalar de vetores Paralelogramos
Paralelogramos Propriedades dos minerais
Propriedades dos minerais Quais são as propriedades básicas da pantomima?
Quais são as propriedades básicas da pantomima? Propriedades probabilidades
Propriedades probabilidades