Termoqumica Turma 201202 Professor Luiz Antnio Tomaz Matria



























- Slides: 34

Termoquímica Turma 201/202 Professor Luiz Antônio Tomaz

Matéria x Energia Matéria e energia são noções que explicam praticamente tudo que ocorre na natureza.

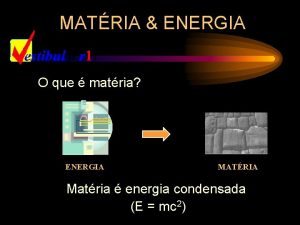
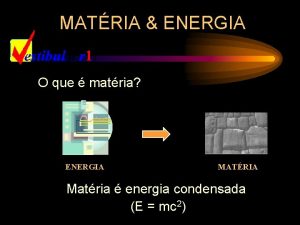
Matéria x Energia A noção de matéria é simples de ser compreendida, quando se manuseia objetos sólidos. . . *Matéria é tudo que possui massa e volume.

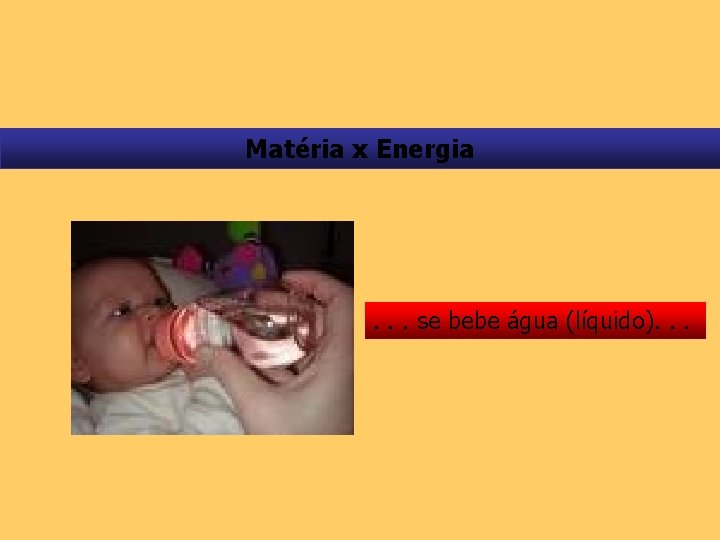
Matéria x Energia . . . se bebe água (líquido). . .

Matéria x Energia. . . ou se enche um balão (gasoso).

Matéria x Energia já é um conceito mais amplo, que envolve fenômenos naturais ou atividades como aquecer ou resfriar, puxar ou empurrar um objeto.

Matéria x Energia Os físicos dizem que energia é tudo aquilo que é capaz de produzir trabalho. Daí. . .

Calor é energia. . . Interessa-nos, no momento, a energia convertida em calor, elevando assim a temperatura do próprio sistema ou do ambiente.

Unidades de medida Energia, trabalho e calor são todos expressos nas mesmas unidades: calorias(cal), joules (J).

O que é caloria? Uma caloria é a quantidade de energia ou calor necessário para elevar a temperatura de 1 grama de água em 1ºC (de 14, 5ºC para 15, 5 ºC). Uma caloria corresponde a 4, 184 joules.

O que é calorimetria? Calorimetria é a medida das quantidades de calor absorvidas ou liberadas durante uma transformação química.

Calor x Temperatura Qual é a diferença entre quantidade de calor e temperatura?

Conceito de Calor é o nome dado à energia térmica quando ela é transferida de um corpo a outro, motivada por uma diferença de temperatura entre os corpos.

Conceito de temperatura Temperatura é a grandeza física que permite medir quanto um corpo está quente ou frio. Está relacionada à energia cinética das partículas de um corpo, à energia de movimento das partículas.

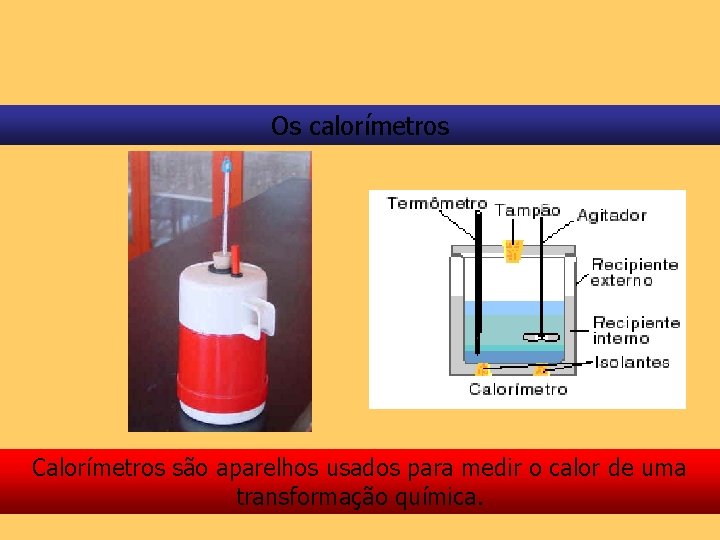
Os calorímetros Calorímetros são aparelhos usados para medir o calor de uma transformação química.

A quantidade de calor liberada ou absorvida Q = m. c. t ou Q =(m + K). t onde: Q= quantidade de calor da transformação m= massa da substância (em gramas) c= calor específico da substância (cal/g. ºC) t= variação da temperatura. K = capacidade calorífica do calorímetro (cal/ºC)

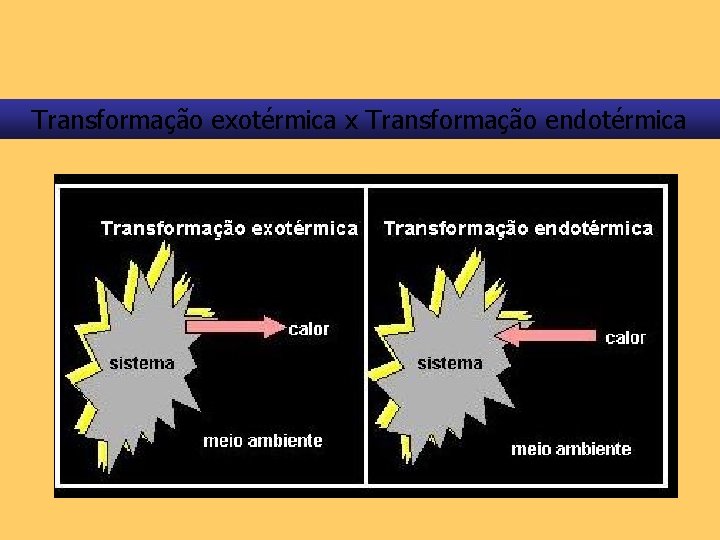
As transformações termoquímicas podem ser. . . Transformações endotérmicas são aquelas que absorvem energia. Exemplo: Ba(OH)2 + NH 4 SCN

As transformações termoquímicas podem ser. . . Transformações endotérmicas são aquelas que absorvem energia. Exemplo: Na 2 SO 3 + Na. CℓO

Transformação exotérmica x Transformação endotérmica

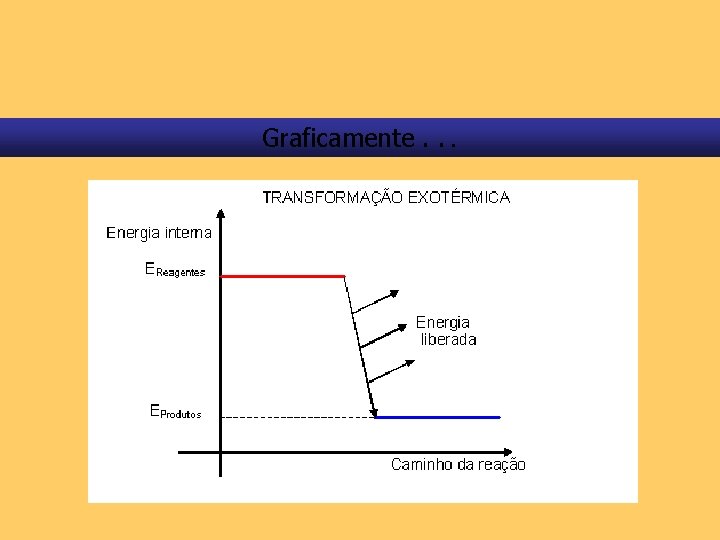
Graficamente. . .

Graficamente. . .

Ilustrando transformações* endotérmicas e exotérmicas. . . *termofísicas

Energia interna (E) e entalpia (H) O calor total armazenado nos sistemas (energia interna), á pressão constante, recebe o nome de entalpia e é representado pela letra “H”.

Assim. . . Para reações endotérmicas Hprodutos > Hreagentes Para reações exotérmicas Hprodutos < Hreagentes

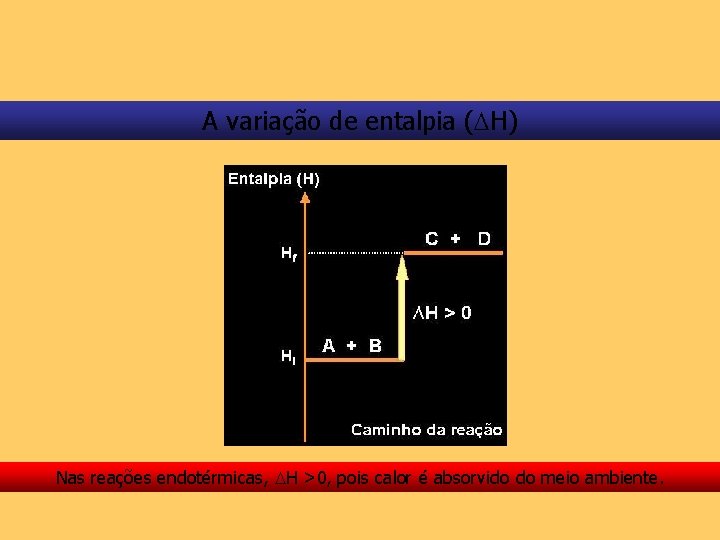
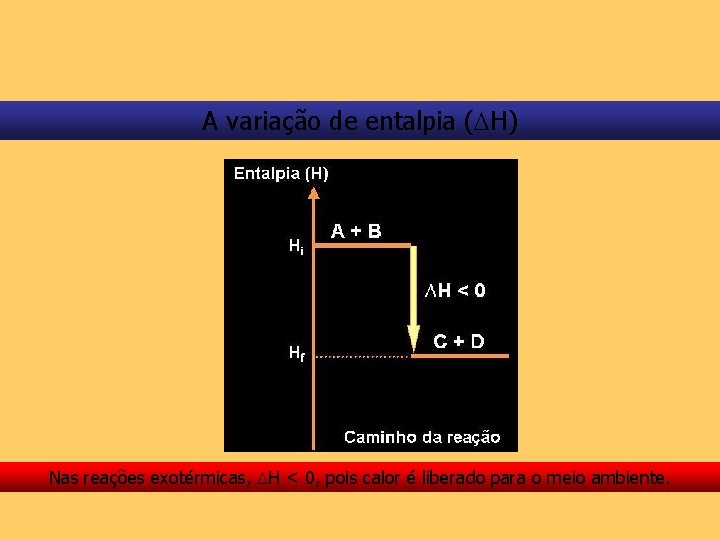
A variação de entalpia ( H) Nas transformações químicas, na realidade, interessa-nos conhecer a variação de entalpia, ou seja, a quantidade de calor liberada ou absorvida à pressão constante.

A variação de entalpia ( H) Daí. . . H = Hfinal – Hinicial ou H = Hp – Hr

A variação de entalpia ( H) Nas reações endotérmicas, H >0, pois calor é absorvido do meio ambiente.

A variação de entalpia ( H) Nas reações exotérmicas, H < 0, pois calor é liberado para o meio ambiente.

A variação de entalpia ( H) Equacionamento químico de reações endotérmicas: Ca. CO 3(s) Ca. O(s) + CO 2(g) H = + 177, 8 k. J ou Ca. CO 3(s) + 177, 8 k. J Ca. O(s) + CO 2(g)

A variação de entalpia ( H) Equacionamento químico de reações exotérmicas: C 4 H 10(g) + 6, 5 O 2(g) 4 CO 2(g) + 5 H 2 O (l) H = - 2656, 3 k. J ou C 4 H 10(g) + 6, 5 O 2(g) 4 CO 2(g) + 5 H 2 O (l) + 2656, 3 k. J

A variação de entalpia ( H) Perceba alguns cuidados no equacionamento: 1. º - A indicação do estado físicos ou formas alotrópicas dos reagentes e dos produtos; 2. º - O balanceamento obrigatório.

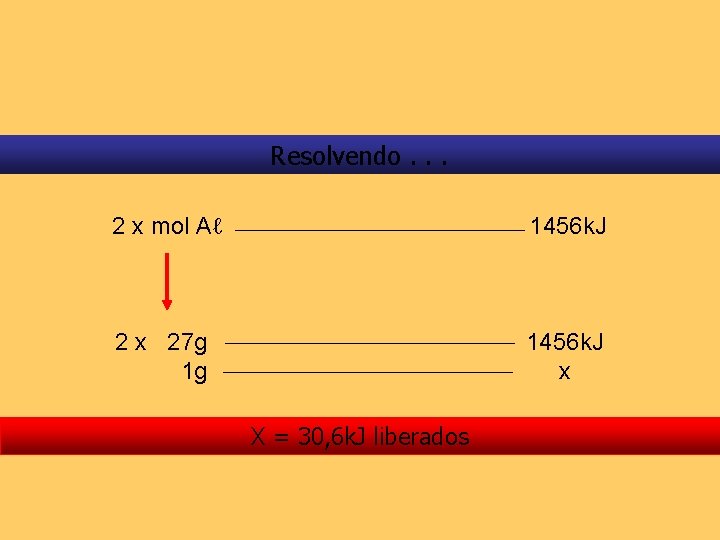
Exercício resolvido. . . Em alguns fogos de artifício, alumínio metálico em pó é queimado, liberando luz e calor. Esse fenômeno pode ser representado como: 2 Aℓ (s) + 1, 5 O 2(g) Aℓ 2 O 3(s) + 5 H 2 O (l) H = -1653 k. J Qual a quantidade de calor, à pressão constante, desprendida na reação de 1 g de alumínio? Dados: Aℓ = 27 g/mol

Resolvendo. . . 2 x mol Aℓ 1456 k. J 2 x 27 g 1 g 1456 k. J x X = 30, 6 k. J liberados

F i m da T e r m o q u í m i c a ! (por enquanto)
 Matria
Matria Tomaz tadeu da silva
Tomaz tadeu da silva Tomaž smrekar
Tomaž smrekar Tomaz garcez
Tomaz garcez Melani tomaz
Melani tomaz Na reação de dissociação térmica do hi
Na reação de dissociação térmica do hi Promotion from assistant to associate professor
Promotion from assistant to associate professor Quantas prendas as três turmas levaram na primeira semana
Quantas prendas as três turmas levaram na primeira semana Boa noite turma
Boa noite turma Nome comuns
Nome comuns A turma da professora carla
A turma da professora carla Fernando luiz pellegrini pessoa
Fernando luiz pellegrini pessoa Luiz marcio cysneiros
Luiz marcio cysneiros O jeito barsi de investir
O jeito barsi de investir Marcos luiz mucheroni
Marcos luiz mucheroni Fernando luiz pellegrini pessoa
Fernando luiz pellegrini pessoa Antônio luiz seabra
Antônio luiz seabra Ronir raggio luiz
Ronir raggio luiz Marcos luiz mucheroni
Marcos luiz mucheroni Rodrigo aranha
Rodrigo aranha Luiz di marcello
Luiz di marcello Pedro luiz de castro
Pedro luiz de castro Washington luiz ferreira rios
Washington luiz ferreira rios Luiz pareto
Luiz pareto Ronilson de souza luiz
Ronilson de souza luiz Luiz pizarro
Luiz pizarro Luiz gonzaga assum preto
Luiz gonzaga assum preto Fabio luiz de oliveira
Fabio luiz de oliveira Angélica nascimento bussunda
Angélica nascimento bussunda Piçarras celk
Piçarras celk Baiuca
Baiuca Ricardo luiz menezes da silva
Ricardo luiz menezes da silva Luiz moutinho
Luiz moutinho Marcos luiz mucheroni
Marcos luiz mucheroni Luiz vicente de souza queiroz
Luiz vicente de souza queiroz