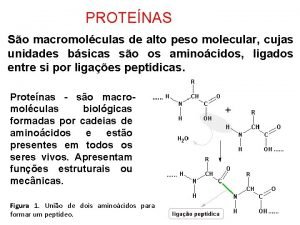
PROPRIEDADES FUNCIONAIS DAS PROTENAS Propriedades Funcionais das Protenas










































































- Slides: 92

PROPRIEDADES FUNCIONAIS DAS PROTEÍNAS

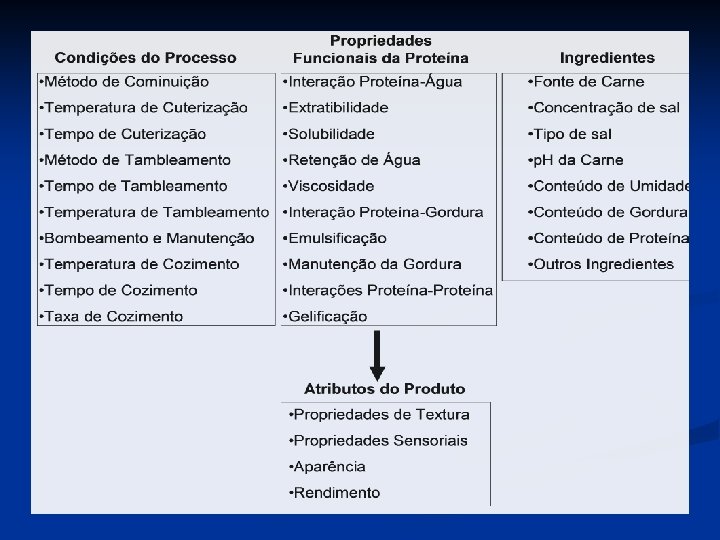
Propriedades Funcionais das Proteínas As propriedades físico-químicas que influenciam no desempenho das proteínas durante processamento, armazenamento, preparo e consumo: . - contribuem com os atributos de qualidade e sensorial; - utilização efetiva para obter novos ingredientes; - desenvolvimento de novos produtos; - modificação de produtos existentes; - controle do consumo de energia durante o processamento • As proteínas tem grande influencia sobre os atributos sensoriais dos alimentos.

Propriedades Funcionais da Proteína As propriedades físico-químicas que influenciam no desempenho das proteínas durante processamento, armazenamento, preparo e consumo: - controlam a funcionalidade proteica incluem tamanho, n - composição e sequência de aminoácidos; - carga líquida e sua distribuição; - relação hidrofobicidade/hidrofilicidade; - estruturas primária, secundária, terciária e quaternária; - flexibilidade/rigidez; - habilidade de reagir com outros componentes.

Classificação das propriedades funcionais: A) Propriedades de hidratação: - dependentes das interações proteína-água. - ex: absorção e retenção de água, umidecimento, inchamento, adesão, dispersabilidade, solubilidade e a viscosidade. B) Propriedades relacionadas com interações proteína-proteína: - precipitação e formação de géis e várias outras estruturas. C) Interações proteína-gordura: - tensão superficial , emulsificação e característica espumantes


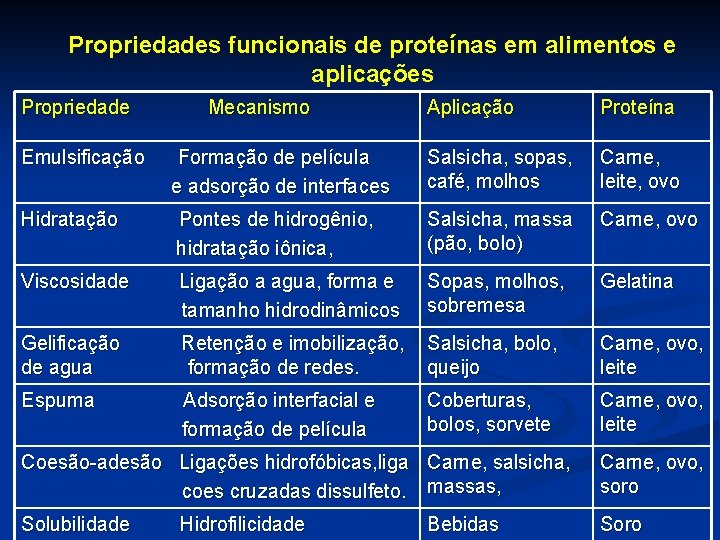
Propriedades funcionais de proteínas em alimentos e aplicações Propriedade Mecanismo Aplicação Proteína Emulsificação Formação de película e adsorção de interfaces Salsicha, sopas, café, molhos Carne, leite, ovo Hidratação Pontes de hidrogênio, hidratação iônica, Salsicha, massa (pão, bolo) Carne, ovo Viscosidade Ligação a agua, forma e tamanho hidrodinâmicos Sopas, molhos, sobremesa Gelatina Gelificação Retenção e imobilização, Salsicha, bolo, de agua formação de redes. queijo Carne, ovo, leite Espuma Adsorção interfacial e formação de película Carne, ovo, leite Coberturas, bolos, sorvete Coesão-adesão Ligações hidrofóbicas, liga Carne, salsicha, coes cruzadas dissulfeto. massas, Carne, ovo, soro Solubilidade Hidrofilicidade Soro Bebidas

Solubilidade • Propriedades funcionais + afetadas : - espessamento - formação de espuma -emulsificação - gelificacão • Manifestação termodinâmica do equilíbrio entre proteína-proteína e proteína –solvente Proteína – Proteína + Agua Proteína-Agua • Principais interações influenciam as características de solubilidade das proteínas são - natureza hidrofóbica - natureza iônica interações proteína – solvente ( ↑ Solubilidade)

• Os resíduos iônicos introduzem 2 tipos de forca de repulsão entre as moléculas proteicas em solução: 1º repulsão eletrostática entre as moléculas de proteína (carga + e -) em qualquer p. H ≠ p. H isoelétrico 2º repulsão entre as camadas de hidratação ao redor dos grupos iônicos • Solubilidade proteica é ditada : - hidrofilicidade - hidrofobicidade media da superfície da proteína que entra em contato com a agua circundante • Menor o numero de segmentos hidrofóbicos na superfície > solubilidade.

Classificação das proteínas em base as características de solubilidade: - Albuminas : proteínas solúveis em agua em p. H 6, 6 Ex. albumina sérica, ovoalbumina e α-lactoalbumina - Globulinas : solúveis em soluções salinas diluídas em um p. H de 7, 0 Ex. glicinina, faseolina e β-lactoglobulina. - Glutelinas : solúveis apenas em soluções acidas de p. H de 2, 0 e soluções alcalinas de p. H 12. Ex. glutelinas do trigo - Prolaminas : solúveis em etanol a 70%. Ex, zeina gliadinas

Quantidade de proteína de uma amostra dissolvida em solução. - proteína para ser solúvel deve interagir com o dissolvente enlaces H, dipolo-dipolo e interações iônicas • Depende primariamente da distribuição de aa hidrofílicos e hidrofóbicos na superfície da proteína e interações termo dinâmicas de proteína-água • alta solubilidade protéica - boa dispersabilidade de moléculas ou partículas de proteína - permite a formação de um sistema fino, dispersão coloidal

• Solubilidade protéica é influenciada: - composição e sequência de aminoácidos; - conformação; - peso molecular; - conteúdo de grupos polares e apolares nos aminoácidos; - presença de substâncias não-protéicas como fosfatos, carboidratos e lipídeos. • É afetada através de fatores: - força iônica - tipo de solvente - p. H - temperatura - condições de processamento

Fatores ambientais que influenciam: • p. H mudanças do p. H, influência sobre a ionização e a magnitude da carga da molécula protéica. • p. H ↑ ou ↓ do PI carga liquida + ou – • repulsão eletrostática e hidratação dos resíduos carregados promovem solubilidade da proteína. * Proteína em sistema aquoso PI = carga zero - proteína tem menos solubilidade - interações proteína-proteína são máximas no PI (p. H de 4 -5) - condição favorável para as proteínas agregar-se e possivelmente precipitar por meio de interações hidrofóbicas. - solubilidade máxima em p. H alcalino.

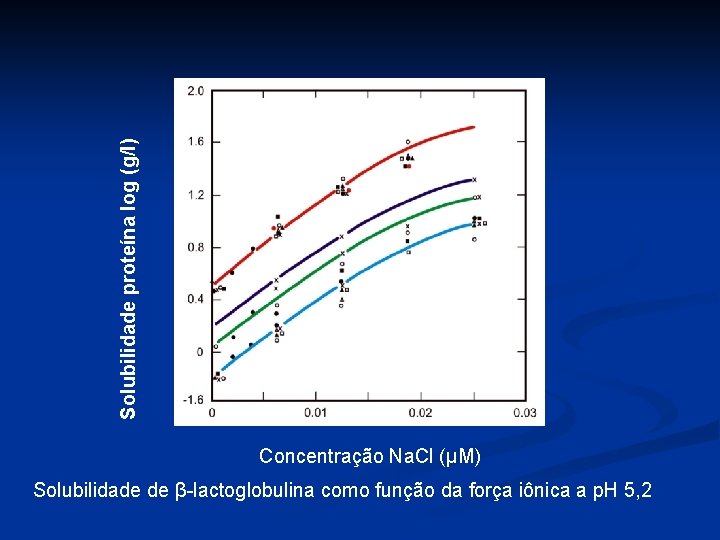
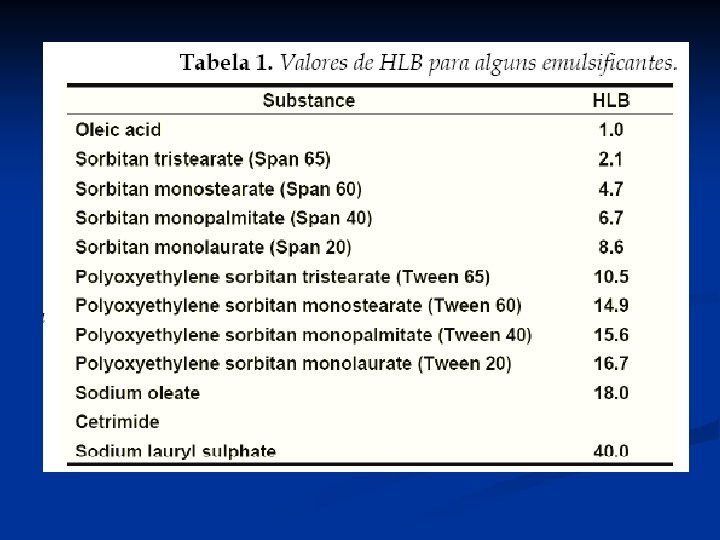
Solubilidade proteína log (g/l) Concentração Na. Cl (μM) Solubilidade de β-lactoglobulina como função da força iônica a p. H 5, 2

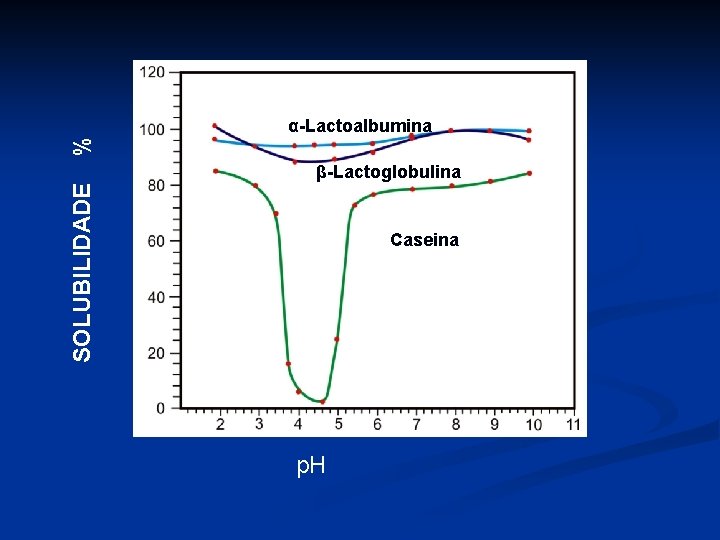
% α-Lactoalbumina SOLUBILIDADE β-Lactoglobulina Caseina p. H


Fatores que afetam a solubilidade de proteínas • Força iônica - em sistemas biológicos, a força iônica é 0, 15 M Na Cl - íons de Cl aumentam a solubilidade pela repulsão eletrostática - [C] baixas de sais neutrais em molaridades na ordem de 0, 5 – 1, 0 M pode ↑ a solubilidade das proteínas - Fase ↑ solubilidade salting in - ions de sal interaciona com grupos cargas opostas das proteínas forma dupla camada de grupos iônicos

Fatores que afetam a solubilidade de proteínas • Efeito da temperatura - alteração na solubilidade da proteína mudança conformacional na estrutura da proteína; - solubilidade de várias proteínas ↓ de forma variada com relação a To e tempo de aquecimento; - o mecanismo de precipitação da proteína ocorrendo após TT processo é irreversível - solubilidade das proteínas é influenciada pela To solubilidade aumenta: To de 0 e 40 -50 o. C solubilidade diminui : > To de 40 -50 o. C

• Proteínas são desnaturadas: - efeito da To nas ligações covalentes da estrutura 2 ra e 3 ra (ligações H+, hidrofóbica e eletrostática) - estrutura 2 ra e 3 ra da proteína são abertas grupos hidrofóbicos interagem e ↓ ligamento H 20 - Interações hidrofóbicas agregação , coagulação e precipitação - desnaturação ↓ solubilidade das proteínas - temperatura desnaturação seguido agregação depende : p. H e força iônica - A alteração do perfil de solubilidade na presença da desnaturação pelo calor ↑ hidrofobicidade da superficie proteica

Solubilidade da proteína (%) Temperatura (C) Solubilidade de proteínas da clara de ovo em função da temperatura p. H 5, 5 p. H 4, 5 . p. H 3, 5 p. H 2, 5

Fatores que afetam a solubilidade de proteínas • Condições de processamento - Tais como: p. H da extração, precipitação e neutralização a priori a secagem influencia na solubilidade proteína. - A solubilidade das proteínas do alimento são designadas: proteína solúvel em água (PSA) proteína dispersa em água (PDA) índice de solubilidade proteica (ISP) índice de dispersibilidade proteica (IDP)

Solubilidade da Proteínas de Carne e Peixe • Solubilidade das proteínas musculares - sarcoplasmáticas são as mais solúveis - miofibrilar solúveis em soluções de sal diluída miosina solúvel a ↑ força iônica (>0, 3 M) - proteínas do estroma menos solúveis • Miosina maior proteína miofibrilar é solúvel a força iônica elevada >0, 3 M • Maturação da carne afeta a solubilidade das proteínas e qualidade da carne: - aumento na extrabilidade da proteína com a maturação durante os primeiros 14 -16 dias; - solubilidade das proteínas miofibrilares para L. dorsi armazenado a 2 o. C tende a ser maior através do tempo.

Solubilidade da Proteínas de Carne e Peixe • Solubilidade das proteínas em produtos cárneos processados - carnes reestruturada e cominuída: * solubilidade de proteínas contractil + Na. Cl * miosina + actomiosina cozidas em ↑força iônica sal = rede tridimensional forte e coesa • Fatores de processamento que influenciam na extratibilidade: - Tratamento mecânicos * misturador *tumbleamento *massageamento * amaciamento mecânico T. mecânico divisão e quebra com liberação das proteínas miofibrilares e outras Na. Cl ↑ capacidade de ligação de proteínas Fosfatos incorporado em emulsões de carne crua ↑ solubilidade proteína

Solubilidade da Proteínas de Carne e Peixe • Efeito do congelamento e armazenamento: - desnaturação da proteína fator de deterioração qualidade - grau de desnaturação e insolubilização durante congelamento: * pré-tratamento antes do congelamento; * grau do processo autolítico antes do congelamento; * faixa de congelamento; * temperatura de congelamento e armazenamento; * tempo de armazenamento; * estabilidade das condições de armazenamento (To e métodos de descongelamento e condições); - proteínas do músculos de peixes + sensíveis ao congelamento que proteínas da carne.

Solubilidade da Proteínas do Leite • Propriedades funcionais das proteínas do leite - composição química - condições de processamento - armazenamento • Solubilidade das proteínas do leite aumentam com ↑p. H • Proteínas do soro é composto: - α-lactoalbumina - albumina soro bovino - β-lactoglobulina - imunoglobulina - proteosa peptona são estáveis ao ácido sensíveis ao calor especialmente β-lactoglobulina

Solubilidade da Proteínas do Leite • Tratamento pelo calor influência funcionalidade protéica - pasteurização e esterilização - desnaturação térmica das proteínas do soro do leite é sensível ao p. H e p. I~ 4, 6 recupera essa proteína desnaturação de proteínas do leite comercial na faixa de 10% a 50% aquecimento ↑ 60ºC nas proteínas do leite * mudança irreversível na estrutura proteína * redução na solubilidade na caseína do leite pasteurizado UHT comparado com caseínas do HTST - leite cru taxas molares elevadas de aa alanina, ac. aspártico e cisteina caseína do leite pasteurizado UHT

Solubilidade da Proteínas do Ovo • Tratamento pelo calor influência funcionalidade protéica - funcionalidade do ovo proteínas do ovo coagulam • Solubilidade das proteínas a 25 C ↑ ºC - p. H na faixa de 2, 0 a 8, 0 - concentração Na. Cl na faixa de 1% a 3% • Viscosidade indicador de mudança da proteína pelo cozimento

Hidratação Proteica • Propriedades reológicas e texturais dos alimentos dependem: - interação da H 20 com outros constituintes do alimento - a agua modifica as propriedades físico-químicas das proteínas, - Muitas propriedades funcionais da proteína dependem das interações entre agua e proteína: ▪ dispersibilidade ▪ umectabilidade ▪ solubilidade ▪ espessamento; viscosidade ▪ CRA ▪ gelificacão ▪ coagulação ▪ emulsificação ▪ formação de espuma • Propriedades térmicas de Gelificacão - equilíbrio adequado de interações proteína-proteína e proteína -água

HIDRATACAO PROTEICA • As moléculas de agua ligam-se a diversos grupos nas proteínas: - grupos carregados (interações íon-dipolo) - grupos peptídicos da cadeia principal - grupos amida de Asn e Gln - grupos hidroxila dos resíduos de Ser, Thr e Tyr (interações dipolo-dipolo) - resíduos não polares (interação dipolo-dipolo induzida e hidratação hidrofóbica) • A capacidade da ligação com agua - os resíduos de aa com grupos carregados ligam-se cerca de 6 moles de H 20 por resíduo. - os resíduos polares não carregados ligam-se a cerca de 2 moles por resíduo - os grupos apolares ligam-se em cerca de 1 mol por resíduo

Hidratação proteica Capacidade de Retenção de Água (CRA) - a interação proteína-água pode ser expressado: hidratação e retenção de água, água ligada, água embebida, adsorção de água e outros - CRA dos alimentos: habilidade de manter sua própria água durante a aplicação de forças, pressão, centrifugação, ou aquecimento. - Capacidade de ligação de água (CLA): habilidade do alimento de reter a água adicionada - CRA das proteínas é habilidade de reter água contra a gravidade específica e físico-química - CRA função principal na formação da textura do alimento, cor e propriedades sensoriais dos produtos. •

Hidratação proteica Fatores que afetam o CRA - Concentração da proteína adsorção de água e viscosidade ↑ exponencialmente com ↑ do conteúdo protéico a quantidade de água retida pelas proteínas depende: * composição de aa, especialmente do número de grupos polares expostos para ligar água. * conformação das proteínas; * hidrofobicidade superficial; * histórico do processamento. proteínas animais apresenta melhor CRA que proteínas vegetais •

INTERAÇÃO PROTEÍNA - ÁGUA Fatores que afetam o CRA - Efeito do p. H CRA é influenciada fortemente pelo p. H tende a ser menor no PI : interação proteína-proteína é máximo * composição de aa, especialmente do número de grupos polares expostos para ligar água. * conformação das proteínas * hidrofobicidade superficial * histórico do processamento proteínas animais apresentam melhor CRA que proteínas vegetais. mudanças do p. H pode afetar a conformação das proteínas resultando na exposição dos lugares de ligação da água •


INTERAÇÃO PROTEÍNA - ÁGUA • Fatores que afetam o CRA - Efeito da força iônica Adição de sais influencia o ligamento da água pelas proteínas efeitos de suas interações eletrostáticas [C] de sais > 2, 0 M diminui CRA altas [Cs] de Na. Cl desidratação das proteínas - Efeito do aquecimento Hidratação das proteínas e CRA mudança conformacional de proteínas durante processamento de alimentos. CRA pela proteína frequentemente ↓ com ↑ da To afeta as condições do tratamento de processamento e origem do produto

Efeito do sal e o p. H nas interações proteína- água Sal Ligamento de água aumenta mais rapidamente 0, 3 (1, 8%) a 0, 6 M (3, 4%) de Na. Cl • Adição de sal reduz interações eletrostáticas entre as moléculas de proteína • Massageamento da carne + sal fibras musculares absorvem H 20 e ficam intumescidos > viscosidade • Filamentos do sarcômero são quebrados • Proteínas extraídas: miosina liga H 20 e viscosidade da massa de carne: estabiliza a gordura dispersa. p. H • p. H da massa influencia na extratibilidade, solubilidade e CRA • Proteínas ~ PI se associam e formam agregados •

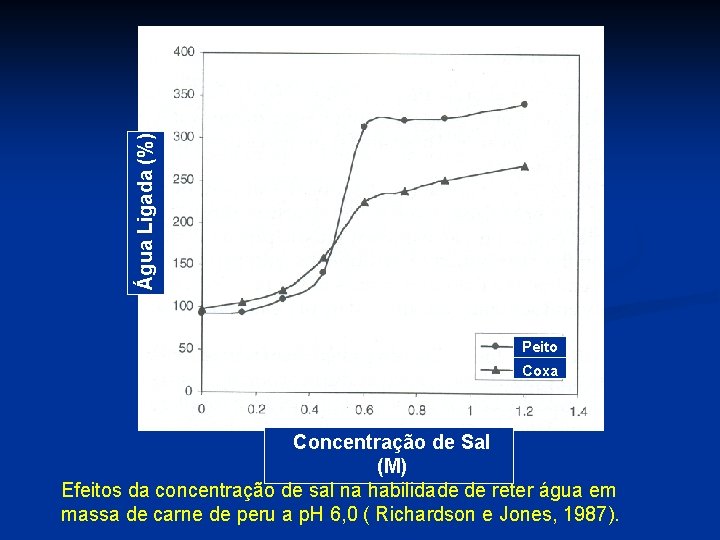
Água Ligada (%) Peito Coxa Concentração de Sal (M) Efeitos da concentração de sal na habilidade de reter água em massa de carne de peru a p. H 6, 0 ( Richardson e Jones, 1987).

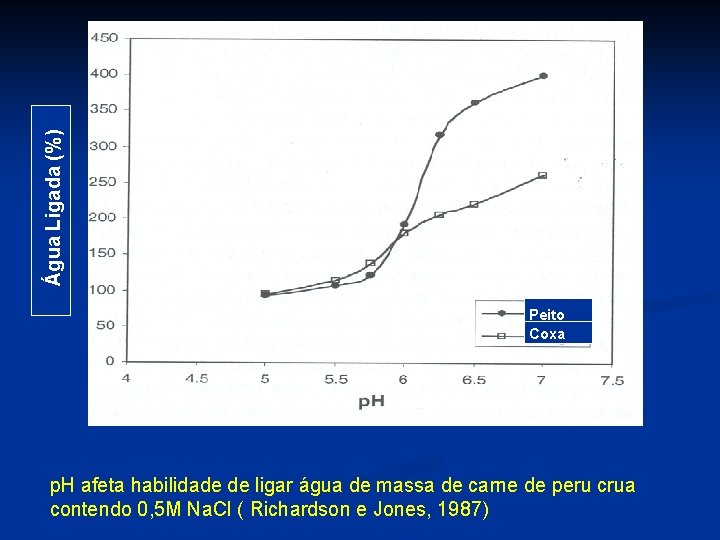
Água Ligada (%) Peito Coxa p. H afeta habilidade de ligar água de massa de carne de peru crua contendo 0, 5 M Na. Cl ( Richardson e Jones, 1987)

Efeito do sal e o p. H nas interações proteína- água p. H • • • Extratibilidade e solubilidade da proteína são baixos perto do PI das proteínas miofibrilares A p. H proteínas carregam (-) Fosfatos alcalinos são utilizados aumentam o p. H de 0, 1 a 0, 4. Processamento afetando as interações proteína-água • Tempo e To de cuterização das carnes e massageamento de produtos cominuídos : controlados • Excessiva cuterização e massageamento: desnaturação das proteínas

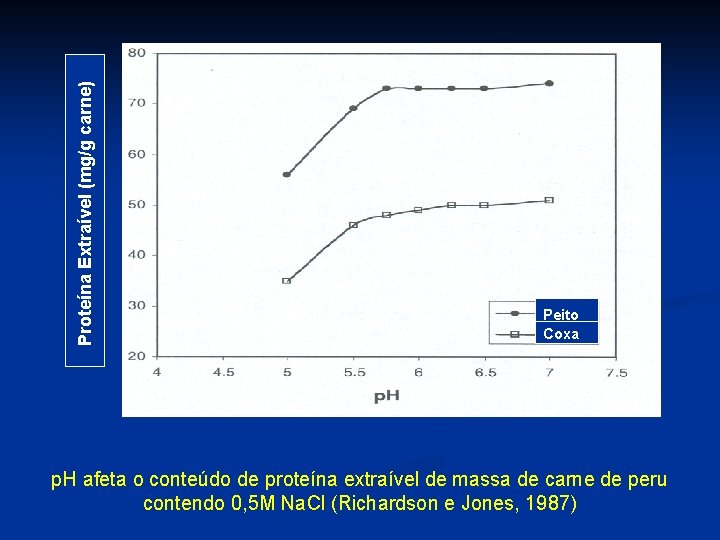
Proteína Extraível (mg/g carne) Peito Coxa p. H afeta o conteúdo de proteína extraível de massa de carne de peru contendo 0, 5 M Na. Cl (Richardson e Jones, 1987)

CRA DAS PROTEÍNAS: PROTEÍNAS DE VEGETAIS Proteínas da soja - a utilização desta proteína ↑ devido a vários fatores como: abundância, baixo custo, propriedades funcionais (CRA e qualidade nutricional); - desnaturação parcial da proteína de soja durante a extração e secagem pode afetar CRA e outras propriedades funcionais da proteína concentrada de soja (PCS) e proteína isolada de soja (PIS); - a hidratação da PCS é normalmente a 75% de umidade; - a PCS é hidratada normalmente á 75% de umidade (18% de proteína); - Proteína de soja: interações de água afeta as propriedades funcionais (inchamento, viscosidade, geleificação, emulsificação e espuma) •

Reologia dos fluidos n É estudada, principalmente, através da medida da viscosidade ou seu inverso, fluidez. n Viscosidade: resistência ao movimento (deformação)

Viscosidade n Fluidos newtonianos n n n Bebidas destiladas Refrigerantes Leite Óleos Fluidos não-newtonianos n n n Sopas cremosas Maionese Soluções de gomas e derivados de celulose

VISCOSIDADE • Resistência de um material a fluir; • Influência na estabilidade da carne crua a priori ao cozimento; • Viscosidade da massa de carne aumenta durante a cominuição quando as fibras enchem e absorvem água; • Proteínas extraídas são grandes, fibrosas e altamente solúveis, tais como a miosina aumenta viscosidade da solução. • A viscosidade da massa deve ser alta o suficiente para estabilizar o produto cru.

VISCOSIDADE • Mudanças induzidas pelo processamento em proteínas: polimerização, agregação e hidrólises afetam à viscosidade de alimentos - agregação da proteína do leite calor desnaturação e interação proteína - polimerização das proteínas do leite e/ou ovo calor - hidrólise pelo coalho de moléculas de α–caseína nas miscellas da caseina do leite polimerização - efeito do p. H, To, e composição iônica na viscosidade de caseinato comercial e soluções de proteína isolada de soja

INTERAÇÃO PROTEÍNA-GORDURA - Propriedades hidrofóbicas e hidrofílicas das proteínas - Propriedades emulsificantes de proteínas de origem animal e vegetal foi melhorado pela correlação: * hidrofobicidade superficial e tensão superficial - Proteínas têm um grande no de aa apolares. Ex: ↑ hidrofobicidade são ativas superficialmente. - Existe uma forte correlação entre a capacidade de emulsificação (CE) e hidrofobicidade de proteínas. - Proteínas globulares com ↑ hidrofobicidade : lisozima, ovoalbumina e proteínas soro melhora a CE pelo aquecimento moderado e desdobramento parcial das proteínas.

INTERAÇÃO PROTEÍNA-GORDURA • Emulsificantes para alimentos - emulsificante: substância capaz de ajudar na formação de uma [emistura estável de 2 substâncias imiscíveis , Ex. : Oleo/H 2 O - pertencem à classe de compostos caracterizados por: natureza ampifílica: estrutura química segmentos hidrofóbicos e hidrofílicos - emulsificantes reduzem a tensão superficial na interface das fases imiscíveis - a indústria de alimentos é considerada a maior consumidora de emulsificantes: panificação (↑ aderência do amido à proteína e viceversa)

Tensão interfacial baixa n Uso de estabilizante ou mistura eficientes. n Menor energia para formação da emulsão n Garantia de adsorção efetiva para formação do filme interfacial

EXEMPLO DA UTILIZAÇÃO DE EMULSIFICANTES EM ALIMENTOS INDUSTRIALIZADOS Produto Efeito Margarina/manteiga Estabilização da emulsão A/O Maionese/cremes/sopas Estabilização da emulsão O/A Sorvete Estabilização da emulsão O/A Salsicha Prevenção da separação da gordura Pães/derivados Melhorias da estrutura da casca, do volume e da inibição da retrogradação do amido Chocolate Inibição da aglomeração da gordura Pós instantáneos Solubilização Extrato de especiarias Solubilização Preparo de multivitaminas Solubilização de vitaminas lipossolúveis/hidrosolúveis

Interações Proteína-Gordura Emulsificação Características: - macroemulsões com tamanho de partículas de 0, 2 a 50 m; - representa uma mistura heterogênea de glóbulos de gordura Tipos de emulsões óleo em água (O/A): leite água em óleo (A/O): margarina e butter Definição - mistura de dois líquidos imiscíveis um dos quais se dispersa em forma de pequenas gotículas ou glóbulos no outro

Interações Proteína-Gordura Emulsificação Atividade emulsificante da proteína: -habilidade da proteína participar na formação da emulsão - estabilizar a nova emulsão criada - Características utilizadas para descrever as propriedades emulsificantes: - CE (capacidade emulsificante): quantidade de óleo (ml) que é emulsificado sob condições específicas por 1 g de proteína. Depende: 1) formar os filmes de adsorção ao redor dos glóbulos 2) baixar tensão interfacial na interface óleo-água - EE (estabilidade da emulsão): capacidade das gotas de emulsão a manter-se disperso sem separação pela coalescência, cremosidade e floculação. é área interfacial máxima (cm 2) por 1 g de proteína de emulsão estabilizada

Interações Proteína-Gordura Emulsificação Fatores químicos e físicos inter-relacionados e CE e EE: - fonte de proteína - concentração - p. H - força iônica (tipo de sal e concentração) - viscosidade do sistema Capacidade emulsificante das proteínas depende: - forma das moléculas de proteína - carga idem - hidrofobicidade idem - neutralidade dos dipolos - hidratação dos grupos polares Estabilidade da emulsão depende da magnitude dessas interações.

Características das proteínas • As proteínas são moléculas anfifílicas - migra para uma interface ar-agua ou interface óleo-agua • Migração espontânea das proteínas Vtotal de liquido para uma interface - Eo livre das proteínas < na interface que na fase aquosa total. - Quando equilíbrio e estabelecido { P ) na região interfacial > encontrada na fase aquosa total - As proteínas formam uma película altamente visco elástica em uma interface capacidade de suportar choques mecânicos (manipulação e estocagem) • As espumas emulsões estabilizadas por proteínas mais estáveis • Todas as proteínas são anfifílicas diferem em suas propriedades surfactantes fatores conformacionais de importância

Características das proteínas • fatores conformacionais de importância - estabilidade flexibilidade da cadeia polipeptídica - facilidade de adaptação no ambiente - padrão de distribuição de grupos hidrofílicos e hidrofóbicos na superfície proteica • Proteínas com propriedade surfactante possuem 3 atributos - capacidade de absorver rapidamente a interface - uma vez na interface, a capacidade de interagir com moléculas vizinhas - formar uma película coesiva e viscoelástica de macromoléculas tais como as proteínas • Padrão de distribuição dos segmentos hidrofílicos e hidrofóbicos sobre a superfície das proteínas afeta sua rapidez de adsorção a interface ar-agua ou óleo-agua. • As características moleculares da superfície proteica da proteína adsorver-se espontaneamente ou não, a uma interface - ate que ponto ela será eficaz como estabilizadores de dispersões

Características das proteínas • Diferença no modo de adsorção das proteínas e surfactantes de baixo peso molecular a uma interface - Surfactantes (fosfolipídios, monoacilglicerois) os limites conformacionais para adsorção e orientação não existem - Proteínas padrão de distribuição dos segmentos hidrofóbicos e hidrofílicos na superfície e rigidez estrutural da molécula limitações

Características das Proteínas • Nas interfaces, as cadeias polipeptídicas assumem 3 configurações distintas na fase aquosa: fileiras, alças e caudas - Fileiras segmentos que estão em contato direto com a interface - Alças segmentos do polipeptídio que estão suspensos na fase aquosa - Caudas segmentos N- e C- terminais da proteína • Propriedade molecular isolada mais importante: FLEXIBILIDADE MOLECULAR

Interações Proteína-Gordura • Instabilidade da gordura é evitada: - viscosidade da massa - membrana da célula de gordura intacta • Emulsão é composta por um sistema de 2 fases: fase dispersa ou descontinua (partículas sólidas ou líquida- gotas de gordura) fase contínua (água contendo sais e dissolvido, forma géis e proteínas suspensas) Fase dispersa ou descontinua quantidade de gordura que foi triturada; - as partículas se tornam menores; - maior área superficial total; - aumento na quantidade de agente emulsionante da carne ou de proteínas artificialmente adicionadas.

Interações Proteína-Gordura • Altas Tos e energia gordura sólida é fundida e emulsificada em pequenas gotas de líquido. • Gotas de gordura são: - esféricas: gordura são líquidas - forma irregular: gordura é sólida e cristalina • Emulsão é intrinsecamente instável tempo das gotículas (fase dispersa) pode atrair-se um a outro • Desestabilização da emulsão O/H 2 O : - floculação -coalescência - formação de crema

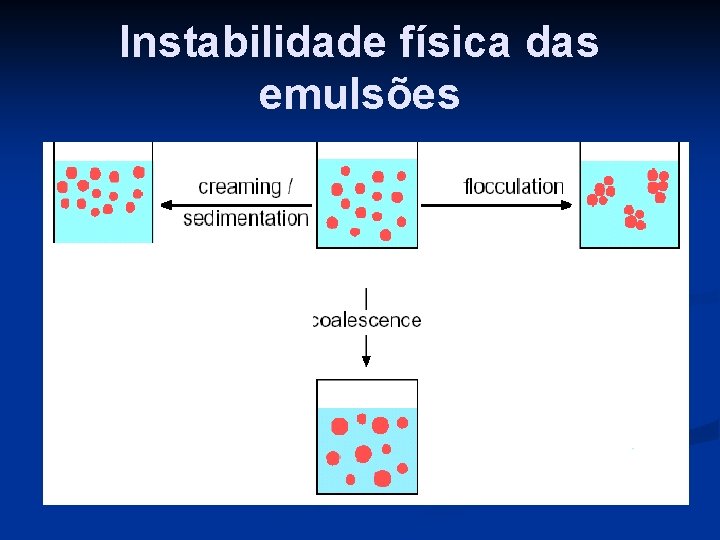
Degradação das emulsões n Sedimentação Floculação Quebra da emulsão devido a coalescência das gotículas dispersas. Inversão da emulsão n Floculação n Quebra da emulsão devido a coalescência das gotículas dispersas n Inversão da emulsão

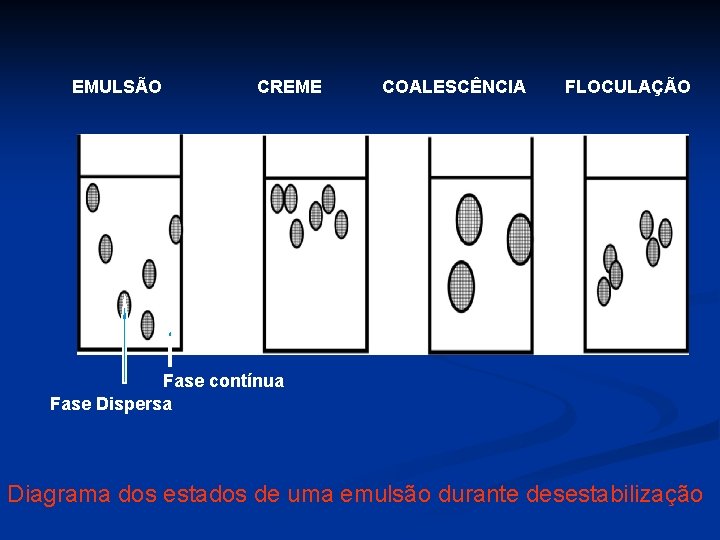
EMULSÃO CREME COALESCÊNCIA FLOCULAÇÃO Fase contínua Fase Dispersa Diagrama dos estados de uma emulsão durante desestabilização

Instabilidade física das emulsões

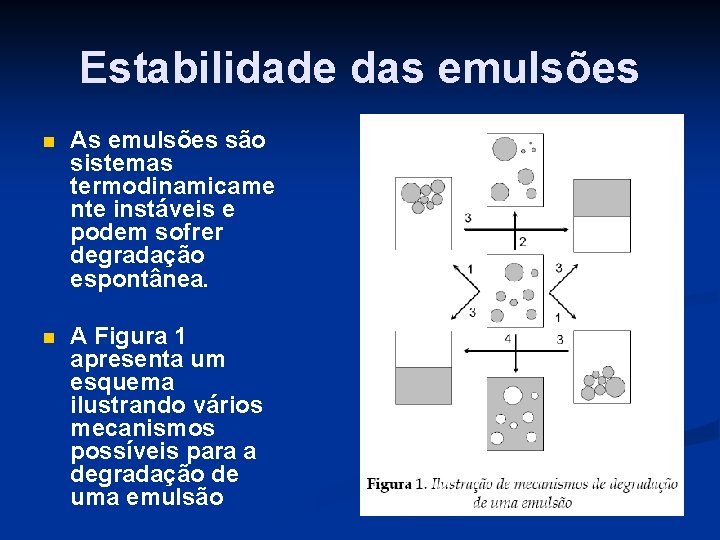
Estabilidade das emulsões n As emulsões são sistemas termodinamicame nte instáveis e podem sofrer degradação espontânea. n A Figura 1 apresenta um esquema ilustrando vários mecanismos possíveis para a degradação de uma emulsão

Instabilidade das emulsões a) Coalescência (quebra da emulsão) b) Separação de fases (macroscópica) irreversível c) Floculação d) “Creaming”: causado por diferença de densidade – pode ser revertido

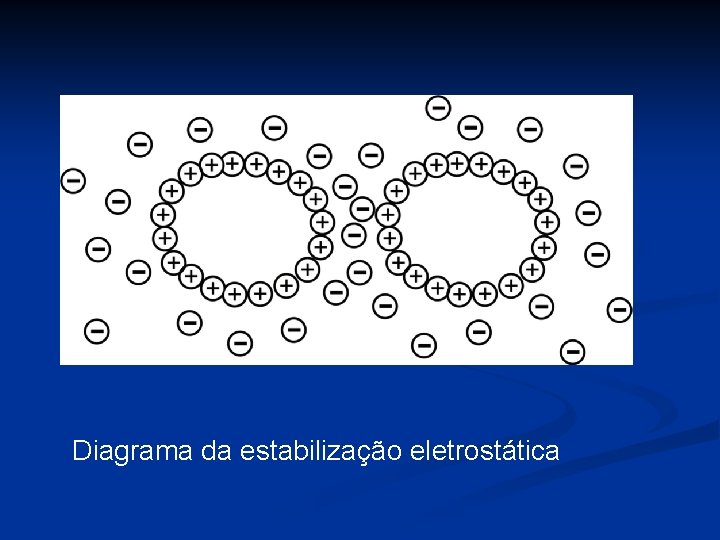
Diagrama da estabilização eletrostática

Representação dos efeitos estéricos devido a adsorção da proteína m uma interface gota de óleo

EMULSIFICAÇÃO • Forças envolvidas com emulsões a. Forças atrativas - gotículas da fase dispersa atraídos força van der Waals Va = A*a/12 h Va Potencial atrativo h= distância: gotículas A depende da distanca : partículas e To da matriz b. Forças repulsivas - emulsão estável: forças atrativas necessitam balanceamento pelas forças repulsivas eletrostáticas - cargas elétricas nas gotículas na emulsão elevado pela ionização, adsorção ou contato com fricção - ausência de emulsificadores contato por fricção capaz de gotículas mudar - emulsificador iônico (proteína) adsorve na interface líquido/líquido, íons opostos devem presentar-se na fase contínua para estabilizar o sistema - espessura da capa dupla elétrica fator importante na quantidade de força repulsiva

EMULSIFICAÇÃO c. Forças estéricas - Regiões da proteína são predominantemente hidrofôbica adotaria a posição na fase de óleo - Forças repulsivas estéricas comprimento do segmento da proteína na fase contínua - Os efeitos estéricos não são diretamente influenciados pela concentração de sal

EMULSIFICAÇÃO • As emulsões são inestáveis; Precisa um agente emulsificante ou estabilizante Afinidade com a água hidrofílica Afinidade com a gordura hidrofóbica • • Ambas partes (hidrofóbica e hidrofílica) do agente emulsionante se dispõem entre as fases lipídicas e aquosa

DIAGRAMA DE UMA EMULSÃO

Emulsionantes n n São moléculas que têm uma cabeça hidrofílica e uma cauda hidrofóbica. O mecanismo da estabilização baseia-se na formação de micelas

Escolha de emulsionantes n n BHL: balanço hidrofílico-lipofílico n Expressa a razão entre as porcentagens em peso de cada grupo na molécula Regra de Bancroft –maior solubilidade do emulsificante na fase contínua.


Fosfolipídeos n Emulsificantes naturais: O/A n n Soja: sorvete, bolos, doces, margarinas Gema ovo: maionese, molhos, bolo

Mono e di-glicerídeos

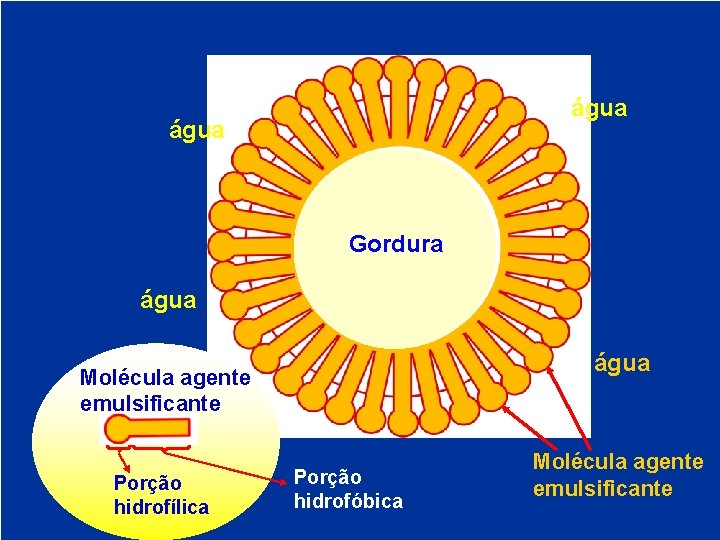
Formação da matriz da proteína e emulsificação Massa: - músculo, gordura, água e sal são misturados juntos + corte rápido massa com características de uma emulsão gordura-água. • - Acontece duas transformações básicas: intumescimento das proteínas e formação de uma matriz viscosa; emulsificação das proteínas solubilizadas, glóbulo de gordura e água.

água Gordura água Molécula agente emulsificante Porção hidrofílica Porção hidrofóbica Molécula agente emulsificante

Interações Proteína–Proteína GELIFICAÇÃO Ex. Alimentos orientais: tofu, kamaboko e fu (glúten de trigo) Definição: Fenômeno agregação proteína forças atrativas e repulsivas estão balanceadas rede ou matriz terciária ordenada • Os geis são formados em dois passos: mudança na conformação ou desnaturação parcial das moléculas de proteínas; associação gradual ou agregação de proteínas desnaturadas individuais

A B Formação da rede de gel pela conexão de moléculas lineares longas A. Formação da rede pela conexão de moléculas longas a pontos

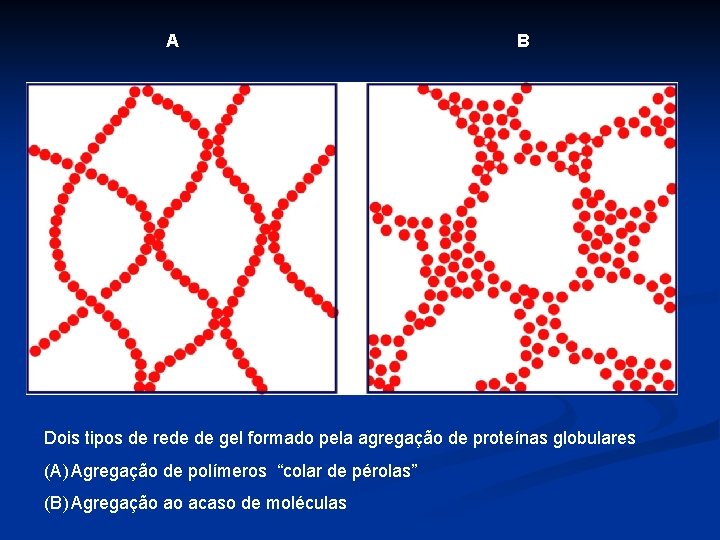
A B Dois tipos de rede de gel formado pela agregação de proteínas globulares (A) Agregação de polímeros “colar de pérolas” (B) Agregação ao acaso de moléculas

GELIFICACAO Gelificação proteica • Transformação do estado SOL GEL - calor - enzimas - cátions divalentes - tipos de interações covalentes ou não covalentes envolvidos - mecanismo de formação de rede • Os géis proteicos de alimentos: - preparada por meio de aquecimento de uma solução proteica - proteína em estado sol desnaturação pro-gel • Características : - SOL n de grupos ligação não covalente disponível nas proteínas formação da rede e limitado. • O estado pro-gel - estado liquido viscoso com desnaturação proteica e polimerização ocorreu - pontes de hidrogênio, grupos hidrofóbicos forma ligações não covalentes intermoleculares ficam expostos

Gelificacão • A conversão do SOL em PRE-GEL e irreversível ocorrem muitas interações proteína-proteína entre as moléculas desdobradas • O PRO_GEL resfriado ↓ Ec térmica facilita a formação de ligações não covalentes estáveis entre grupos funcionais • As redes do gel sustentadas por ligações não covalentes são termicamente reversíveis. • As proteínas tem carga liquida repulsão eletrostática leva a não formação de rede grupos carregados essenciais interações proteína- agua e da CRA dos géis. • Com interações hidrofóbicas são fortes em Ts ↑ redes do gel formadas por interações hidrofóbicas são termicamente irreversiveis Ex. os géis da clara de ovo. • As proteínas formam 2 tipos de géis: - géis do tipo de coagulo opacos - géis translúcidos

Etapas para formação de Gel protéico: 1. Proteínas musculares submetidas ao calor desdobramse ou desnaturam a uma To crítica; 2. Moléculas desdobradas se agregam dentro de pequenos conglomerados para formar uma solução viscosa; 3. Obter o ponto de gel agregados ligamentos cruzados se ligam para formar uma matriz de gel contínuo; 4. Gel de proteína forma por uma combinação de: - enlaces de H - interações eletrostáticas - interações hidrofóbicas - pontes dissulfeto

Gelificação • Géis de proteína mantém quantidades de H 2 O dentro da sua estrutura de rede reações químicas e entrampamento físico. • Géis formados: evitam a coalescência da gordura dentro de uma massa de carne cozida. • Diferentes tipos de matriz de gel podem ser formados: - p. H de preferência de 6, 0 a 6, 5 - concentração de sal • Proteínas miofibrilares de aves: - começa a desnaturar a 4 o. C e ponto de gel ~ 55 o. C - Endurecimento do gel e CRA durante o cozimento

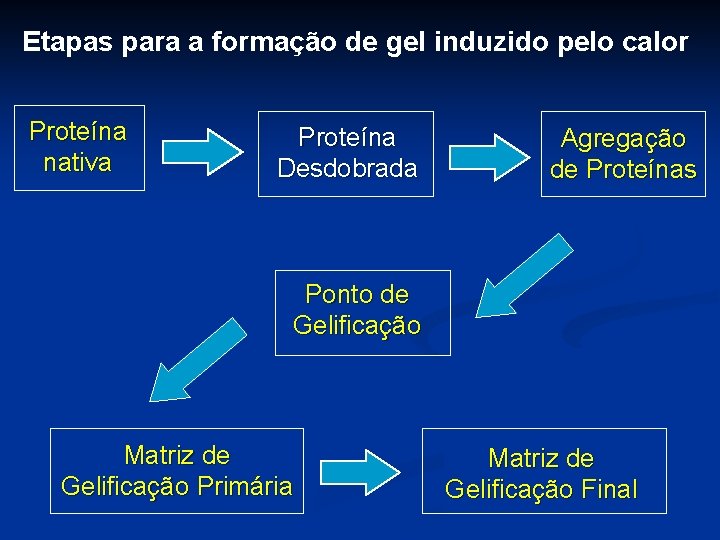
Etapas para a formação de gel induzido pelo calor Proteína nativa Proteína Desdobrada Agregação de Proteínas Ponto de Gelificação Matriz de Gelificação Primária Matriz de Gelificação Final

Fatores que influenciam na formação de uma rede de gel Os géis proteicos são sistemas altamente hidratados n Concentração da proteína – menor ponto de equivalência (LCE) LCE 8% para proteínas de soja 3% para albumina de ovo 0, 6% para gelatina n Outros fatores ambientais: - p. H ótimo 7 - 8 - proteólise limitada da proteína – Ex. queijo (clivagem da k-caseina libera porção hidrofílica glicomacropeptideo) - ligação cruzada enzimatica das proteínas em T ambiente – Ex. transglutaminase catalisa formação de ligações cruzadas de €-(ɤ -glutamil) lisil entre os grupos glutamina e lisil das proteínas - Cations divalentes: Ca+2 e Mg+2 forma géis proteicos. Ex. tofu n

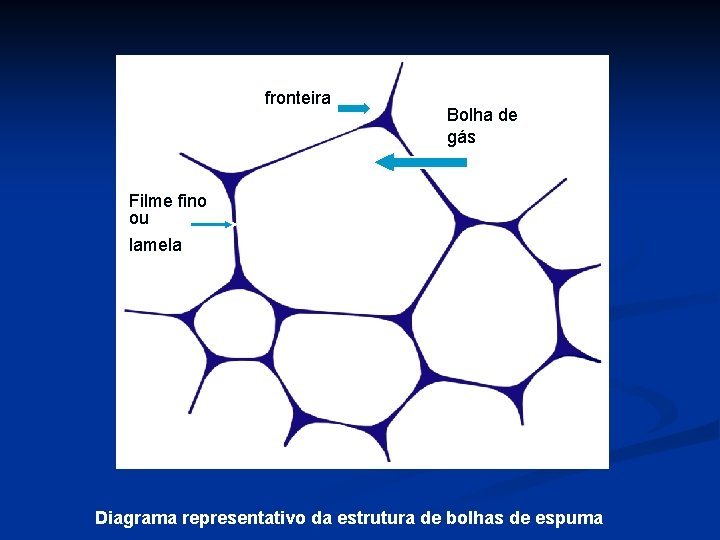
Propriedade de Formação de Espuma : Sistema de 2 fases consiste - fase continua aquosa - fase dispersa gasosa ar células de ar separados por uma camada líquida contínua fase lamelar • Espuma em alimentos é uma mistura: - gases - líquidos - sólidos - surfactantes • Distribuição do tamanho de bolhas de ar na espuma: - aparência dos produtos espumosos; - propriedades de textura. • Os agentes amplamente utilizados como agentes de espuma são: - clara de ovo - gelatinas - caseínas - outras proteínas da leite - proteínas de soja - glúten •

fronteira Bolha de gás Filme fino ou lamela Diagrama representativo da estrutura de bolhas de espuma

Formação de Espuma Capacidade de formar espuma de uma proteína - quantidade de área interfacial criada pela proteína Overrun (volume de espuma em estado estável) Overrun = Volume de espuma x 100 Volume liquido inicial Poder Espumante – expansão da espuma FP = Volume de gás incorporado x 100 Volume de liquido n

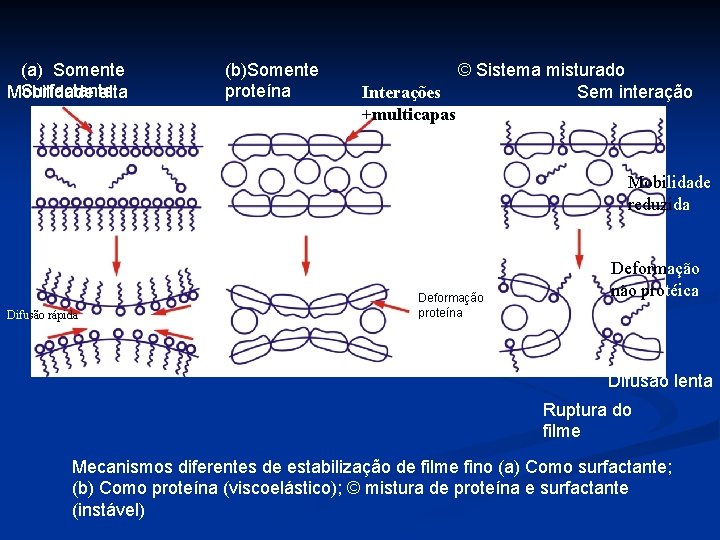
(a) Somente Surfactante Mobilidade alta (b)Somente proteína © Sistema misturado Interações Sem interação +multicapas Mobilidade reduzida Difusão rápida Deformação proteína Deformação não protéica Difusão lenta Ruptura do filme Mecanismos diferentes de estabilização de filme fino (a) Como surfactante; (b) Como proteína (viscoelástico); © mistura de proteína e surfactante (instável)

Formação de Espuma e Estabilidade • As propriedades de espuma são influenciadas: - fonte da proteína - métodos e parâmetros térmicos de processamento isolamento da proteína temperatura p. H concentração da proteína tempo de mistura método de formação de espuma

Fatores Ambientais que Influenciam a Formação e Estabilidade de Espuma p. H: - Espumas estabilizadas por proteínas são mais estáveis em p. H isoelétrico - Ocorre aumento da Q proteína adsorvida à interface no PI - Aumenta a estabilidade da espuma e a espumabilidade. Sais - Depende do tipo de sal e das características de solubilidade da proteína na solução salina - A espumabilidade e a estabilidade da espuma das proteínas globulares ↑ com a elevação de Na. CL. Lipídeos - [C > 0, 5%, lipídeos , em especial os fosfolipídeos ↓ formação de espuma - - Os lipídeos são + ativos na superfície do que as proteínas

Formação de Espuma e Estabilidade Estruturas formam 3 filmes finos ou lamelas de espuma - paredes da espuma • Interfaces da ar/ H 20 filmes finos forma ou quebra glóbulos de espuma • Fases diferentes para formação de espuma de proteínas 1) efetividade de encapsulação do gás (habilidade formação de espuma) 2) vida útil da espuma (estabilidade da espuma) • Determinantes na habilidade da formação de espuma - taxa da proteína interface gás/H 20 e adsorção •


 Requisitos não funcionais
Requisitos não funcionais Requisitos funcionais
Requisitos funcionais Requisitos não funcionais exemplos
Requisitos não funcionais exemplos O que é nfr
O que é nfr Isometrias
Isometrias Holoproteínas globulares
Holoproteínas globulares Cromoproteinas ejemplos
Cromoproteinas ejemplos Protenas
Protenas Protenas
Protenas Protenas
Protenas Proteinas simples e conjugadas
Proteinas simples e conjugadas Protenas
Protenas Colágeno estructura molecular
Colágeno estructura molecular Protenas
Protenas Protenas
Protenas Protenas
Protenas Protenas
Protenas Site:slidetodoc.com
Site:slidetodoc.com Modelo de casos de uso
Modelo de casos de uso Norma iso 9126
Norma iso 9126 Qual a unidade funcional dos seres vivos
Qual a unidade funcional dos seres vivos Vetores paralelos
Vetores paralelos Produto vetorial
Produto vetorial Conectividade textual
Conectividade textual O que e reologia
O que e reologia Matriz quadrada
Matriz quadrada Propriedades específicas da matéria
Propriedades específicas da matéria Propriedade coligativa
Propriedade coligativa Limite e continuidade de funções de várias variáveis
Limite e continuidade de funções de várias variáveis Perispírito formação propriedades e funções
Perispírito formação propriedades e funções Slide todoc.com
Slide todoc.com Tonoscopia ou tonometria
Tonoscopia ou tonometria Enxofre
Enxofre Produto escalar de vetores
Produto escalar de vetores Paralelogramos
Paralelogramos Propriedades dos minerais
Propriedades dos minerais Napiers bone
Napiers bone Propriedades probabilidades
Propriedades probabilidades Propriedades específicas da matéria
Propriedades específicas da matéria Dado cubico equilibrado
Dado cubico equilibrado Calor especifico madeira
Calor especifico madeira Propriedade dos logaritmos
Propriedade dos logaritmos Tecido conjuntivo denso modelado
Tecido conjuntivo denso modelado Elemento neutro
Elemento neutro Ebulioscopia slide
Ebulioscopia slide Funcao crescente
Funcao crescente Propriedades da matriz
Propriedades da matriz Divisores de um número natural
Divisores de um número natural Propriedades da mediatriz
Propriedades da mediatriz Quais são as propriedades básicas da pantomima?
Quais são as propriedades básicas da pantomima? Peridicas
Peridicas Para cada exemplo de propriedade da matéria acrescente
Para cada exemplo de propriedade da matéria acrescente Das alte ist vergangen das neue angefangen
Das alte ist vergangen das neue angefangen Reflexões do poeta canto v
Reflexões do poeta canto v Mais e a vida e a vida o que é diga la meu irmao
Mais e a vida e a vida o que é diga la meu irmao Das alles ist deutschland das alles sind wir
Das alles ist deutschland das alles sind wir Ich bin die wahrheit der weg und das licht
Ich bin die wahrheit der weg und das licht Zscaler das
Zscaler das Binomische formeln wie geht das
Binomische formeln wie geht das Mahashweta das
Mahashweta das Exemplos de radical
Exemplos de radical Was das hirn alles kann
Was das hirn alles kann Imagens das fotos
Imagens das fotos Lei das expectativas iteradas
Lei das expectativas iteradas Wer ist das
Wer ist das Protoctista
Protoctista Cuestionario das
Cuestionario das A água cai das nuvens em forma de
A água cai das nuvens em forma de Historicidade das diversas modalidades esportivas coletivas
Historicidade das diversas modalidades esportivas coletivas Der die das dative
Der die das dative Das große glück noch klein zu sein
Das große glück noch klein zu sein Buenos das
Buenos das Sanjiv das santa clara university
Sanjiv das santa clara university Tamanho das pessoas
Tamanho das pessoas Dwijen das
Dwijen das Anish das sarma
Anish das sarma Frase complexa coordenação e subordinação
Frase complexa coordenação e subordinação Directia de asistenta sociala targoviste
Directia de asistenta sociala targoviste O mapa é uma das mais antigas formas gráficas
O mapa é uma das mais antigas formas gráficas Grösste land der welt
Grösste land der welt Enzima chave fechadura
Enzima chave fechadura Das leben vergeht
Das leben vergeht Revestimento duro dos caranguejos
Revestimento duro dos caranguejos Guten tag wie heißen sie
Guten tag wie heißen sie Espírito das leis
Espírito das leis Diversidade das plantas
Diversidade das plantas Sujeito simples e composto
Sujeito simples e composto Be
Be Titanik potop
Titanik potop Pluralidade das existências
Pluralidade das existências Radscho
Radscho Shunt das pentoses
Shunt das pentoses Dr kumitaa theva das
Dr kumitaa theva das