MATRIA ENERGIA O que matria ENERGIA MATRIA Matria




























- Slides: 33

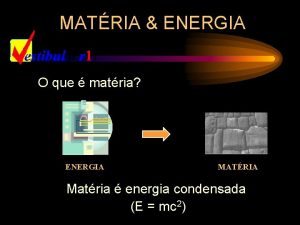
MATÉRIA & ENERGIA O que é matéria? ENERGIA MATÉRIA Matéria é energia condensada (E = mc 2)

CONVENÇÕES: • Tudo que ocupa lugar no espaço e possui massa. MATÉRIA ENERGIA • Tudo que não ocupa lugar no espaço, não possui massa e é capaz de realizar trabalho.

CONVENÇÕES: • É uma porção da matéria. CORPO • É uma porção da matéria transformada em em algo útil. OBJETO

ESTRUTURA DA MATÉRIA v MISTURAS v SUBST NCIAS v ELEMENTO QUÍMICO v ÁTOMO

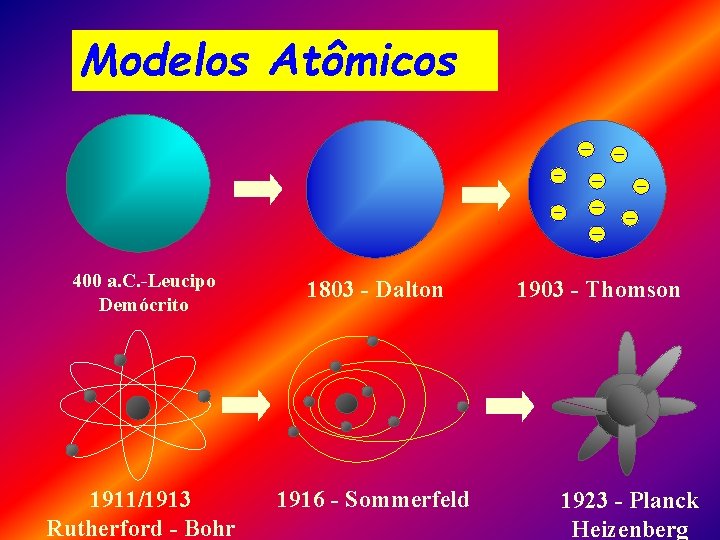
Modelos Atômicos 400 a. C. -Leucipo Demócrito 1803 - Dalton 1911/1913 Rutherford - Bohr 1916 - Sommerfeld 1903 - Thomson 1923 - Planck Heizenberg

Teoria Atômica - Dalton v A matéria é formada por partículas indivisíveis chamadas ÁTOMOS. • LEI DE LAVOISIER: Lei da conservação das massas. • LEI DE PROUST: Lei das proporções constantes. • LEI DE DALTON: Lei das proporções múltiplas.

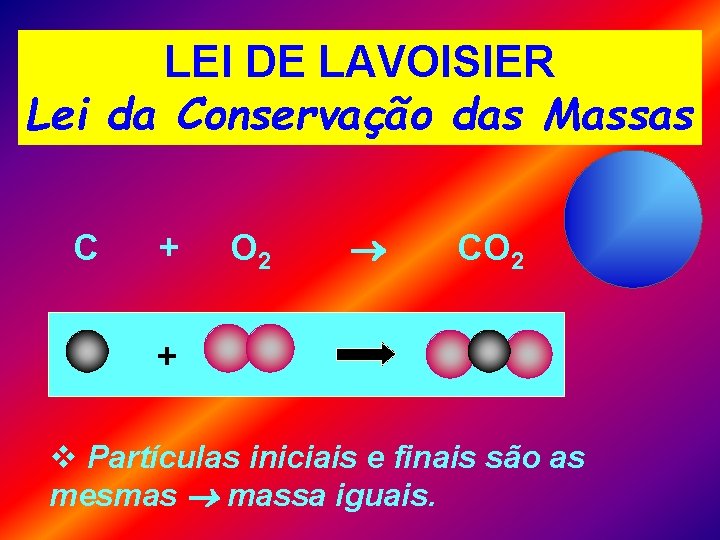
LEI DE LAVOISIER Lei da Conservação das Massas C + O 2 CO 2 + v Partículas iniciais e finais são as mesmas massa iguais.

LEI DE PROUST Lei das Proporções Constantes C + O 2 2 O 2 CO 2 + 2 CO 2 + v Duplicando a quantidade de átomos todas as massas dobrarão.

LEI DE DALTON Lei das Proporções Múltiplas C + O 2 CO 2 + 2 CO + v Mudando a reação, se a massa de um participante permanecer constante, a massa do outro varia segundo valores múltiplos.

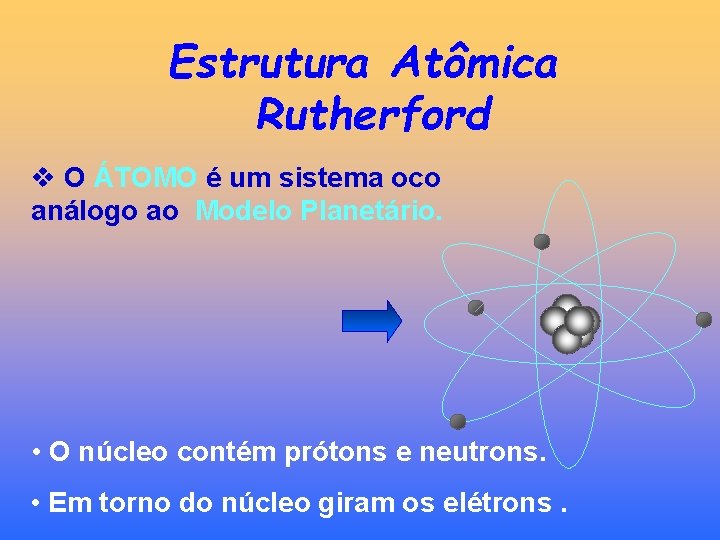
Estrutura Atômica Rutherford v O ÁTOMO é um sistema oco análogo ao Modelo Planetário. • O núcleo contém prótons e neutrons. • Em torno do núcleo giram os elétrons.

Características das partículas subatômicas: Partícula Próton Carga +1 Massa 1 Elétron -1 1/1840 Nêutron 0 1 • O átomo é eletricamente neutro (p = e-). • A massa do átomo está concentrada no núcleo. • O núcleo é cerca de 10000 X menor que o átomo.

Notação Química do Átomo: • Número Atômico (Z): n° prótons (p) • Número de Massa (A): A = p + n (neutrons) N° atômico A X z N° de massa Símbolo do elemento

Íons: • Definição: é o átomo que perdeu ou ganhou elétrons. • Classificação: Cátion (+): átomo que perdeu elétrons. Ex. átomo: 11 Na 23 cátion Na+1 + e nion (-): átomo que ganhou elétrons. Ex. átomo: 17 Cl 35 + e- ânion Cl-1

Exercícios de fixação: 1. Dê o número de Prótons, elétrons e nêutrons das espécies a seguir: ESPÉCIES p e- n 56 26 Fe 56 (+2) 26 Fe 31 (-3) P 15 2. (UCSal) O que decide se dois átomos quaisquer são de um mesmo elemento químico ou de elementos químicos diferentes é o número de: a) prótons b) d) carga. b) nêutrons c) elétrons e) oxidação.

Exercícios de fixação: 3. O elemento de número atômico 16 é constituído de vários nuclídeos, sendo que o mais abundante é o 32. Quantos prótons e nêutrons, respectivamente, possui esse nuclídeo? a) 8 e 8. b) 8 e 16. c) 16 e 8. d) 16 e) 24 e 8 Nota: núclideo é o nome dado ao núcleo.

ISÓTOPOS: v. São átomos com o mesmo número de PRÓTONS. Exemplos: 12 e C 6 14 C 6 1 H 1 15 e O 16 O 8 8 2 H 1 Hidrogênio Deutério 99, 98% 0, 02% 3 H 1 Trítio 10 -7 %

ISÓBAROS: v São átomos com o mesmo número de MASSA Exemplos: 40 e Ar 18 40 Ca 20 42 e Sc 21 42 Ti 22 ISÓTONOS: v São átomos com o mesmo número de NÊUTRONS Exemplos: 31 e P 15 32 S 16 38 e Kr 18 40 Ca 20

RESUMO: Isótopos = Z (= p), A e n Isóbaros Z ( p), = A e n ÁTOMO Isótonos Z ( p), A e = n Obs. Existem ainda as chamadas espécies isoeletrônicas, que possuem o mesmo número de elétrons. Exemplo: 23(+1) Na 11 16(-2) O 8 e 19(-1) F 9

Exercícios de fixação: 1. Dados os átomos: 80 A 40 82 B 40 80 C 42 83 D 41 a) Quais são os isótopos? b) Quais são os isóbaros? c) Quais são os isótonos? 2. Tem-se três átomos genéricos A, B e C. De acordo com as instruções: A é isótopo de B / B é isóbaro de C / A é isótono de C Calcule o n° de massa do átomo A, sabendo - se que o n° atômico de A é 21, o n° de massa de B é 45 e o número atômico de C é 22.

Exercícios de fixação: 3. Tem - se dois átomos genéricos e isótopos A e B, com as seguintes características: Determine a soma total do número de nêutros dois átomos. (n. A + n. B)

Estrutura Atômica Atual v Bohr complementou o modelo atômico de Rutheford implementando a idéia de níveis ou camadas eletrônicas. Postulados: 1°) Os elétrons descrevem órbitas circulares em torno do núcleo atômico, sem absorverem ou emitirem energia. 2°) O elétron absorve uma quantidade definida de energia quando salta de um nível energético para outro mais externo, ao retornarem aos níveis originais, devolvem essa energia na forma de ondas eletromagnéticas. + ) ) ) - -

Números Quânticos v Números Quânticos - Definem a energia e a posição mais provável de um elétron na eletrosfera. São eles: 1. Número quântico Principal. 2. Número Quântico Secundário. 3. Número Quântico Magnético. 4. Número Quântico Spin.

Número Quântico Principal (n) v Define o nível de energia ou camada: ) ) ) ) n= K L M 1 2 3 N 4 O 5 P 6 Q 7

Número Quântico Principal (n) v Número máximo de elétrons por camada: n° max. e- = 2 n 2. Camada K L M N O P Q n 1 2 3 4 5 6 7 n° max. e- 2 8 18 32 32 18 2 Obs. A expressão n° e- = 2 n 2, na prática só é válida até a quarta camada.

Número Quântico Secundário (l) v Define o subnível de energia: l = n – 1, apenas quatro foram observados: Subnível s p d f l 0 1 2 3 n° max. e- 2 6 10 14 Obs. O Número máximo de elétrons por subnível é dado por: n° max. e- = 2(2 l +1)

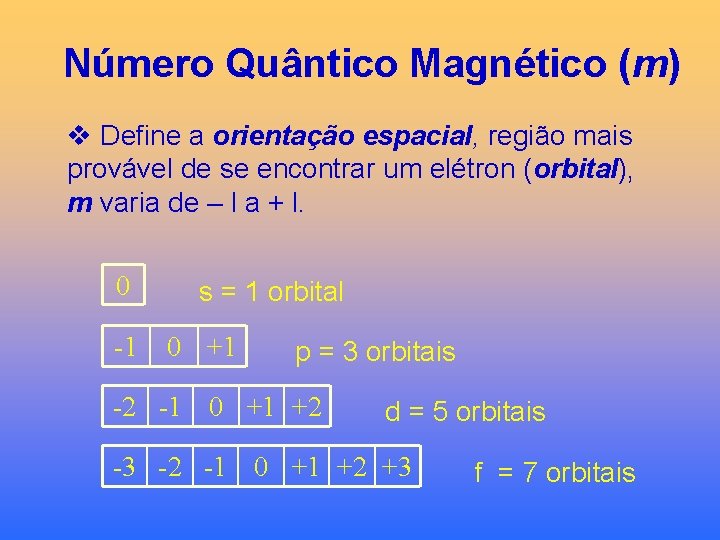
Número Quântico Magnético (m) v Define a orientação espacial, região mais provável de se encontrar um elétron (orbital), m varia de – l a + l. 0 -1 s = 1 orbital 0 +1 p = 3 orbitais -2 -1 0 +1 +2 d = 5 orbitais -3 -2 -1 0 +1 +2 +3 f = 7 orbitais

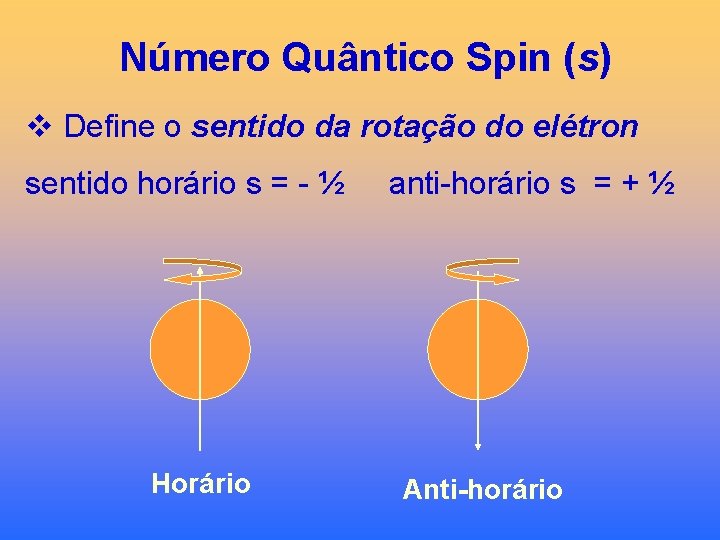
Número Quântico Spin (s) v Define o sentido da rotação do elétron sentido horário s = - ½ Horário anti-horário s = + ½ Anti-horário

Distribuição Eletrônica Linus Pauling v Regras e pricípios gerais para distribuição dos elétrons no átomo: 1. Energia total do elétron: E = n + l. 2. O elétron tende a ocupar as posições de menor energia. 3. Princípio da Exclusão de Pauling – o átomo não pode conter elétrons com números quânticos iguais. 4. Regra de Hund – em um subnível os orbitais são preenchidos parcialmente com elétrons do mesmo spin depois completados com elétrons de spins contrários.

Diagrama de Linus Pauling Níveis K 1 L 2 M 3 N 4 O 5 P 6 Q 7 s p d f 1 s 2 s 3 s 4 s 5 s 6 s 7 s 2 p 3 p 4 p 5 p 6 p 3 d 4 d 5 d 6 d 4 f 5 f 2 6 10 14 Max. de e- e 2 8 18 32 32 18 2

Exercícios de fixação: 1. Indique os quatro números quânticos para os elétrons: a) b) (camada L) c) (4° nível) (nível 6) 2. Qual o número de subníveis e o número de orbitais, respectivamente, presentes no 3° nível? a) 1 e 3 b) 3 e 3 d) 9 e) 9 e 18 c) 3 e 9

Exercícios de fixação: 3. Indique qual dos conjuntos de números quânticos abaixo citados é impossível: a) 2, 0, 0, -1/2 b) 3, 2, +1/2 c) 3, 0, +1, -1/2 d) 4, 1, 0, -1/2 e) 3, 2, -1/2 Exercícios página 38 e 39 vide módulo.

Exercícios de fixação: 1. Assinale a opção que contraria a regra de Hund: a) b) d) e) c) 2. Qual o número atômico do elemento cujo elétron de diferenciação do seu átomo neutro apresenta o seguinte conjunto de números quânticos: (n = 2, l = 1, m = 0, s = + 1/2) a) 2 b) 4 c) 6 d) 8 e) 9 b) Obs. Considere como spin negativo o 1° elétron que entra no orbital.

Exercícios de fixação: 3. Para o elemento cuja configuração eletrônica de nível de valência é 3 s 2 3 p 5, pode-se afirmar: (01) Seu número atômico é 7. (02) Existem 5 elétrons desemparelhados em sua estrutura. (04) No 3° nível encontramos apenas um orbital incompleto. (08) No 3° nível existem 3 elétrons p com número quântico de spin iguais. (16) Sua configuração eletrônica poderia ser representada como 1 s 2 2 s 2 3 px 2 3 py 2 3 pz 1. (32) O elétron de diferenciação localiza-se no subnível 3 pz.
 Matria
Matria Classificação de compressores
Classificação de compressores Energia meccanica scuola primaria
Energia meccanica scuola primaria Teorema variatiei energiei potentiale
Teorema variatiei energiei potentiale é nas quedas que o rio cria energia
é nas quedas que o rio cria energia Oque e energia
Oque e energia Cuántos y cuáles son los tipos de energía que existen
Cuántos y cuáles son los tipos de energía que existen Que es la energia solar
Que es la energia solar Que es energía en física
Que es energía en física Termodinmica
Termodinmica Energia cinetica y potencial formulas
Energia cinetica y potencial formulas Trabajo mecanico
Trabajo mecanico Ejemplo de energia potencial
Ejemplo de energia potencial Qué es la hidrosfera
Qué es la hidrosfera O que é energia térmica
O que é energia térmica In the previous lesson you have learned
In the previous lesson you have learned Me gusta la gente que vibra mario benedetti
Me gusta la gente que vibra mario benedetti Plus que moins que aussi que
Plus que moins que aussi que Quien dice lo que no debe escucha lo que no quiere
Quien dice lo que no debe escucha lo que no quiere Qqq estrategia de aprendizaje
Qqq estrategia de aprendizaje No trote
No trote No me gusta la gente que
No me gusta la gente que Hmotnostny ubytok jadra
Hmotnostny ubytok jadra Urto elastico unidimensionale
Urto elastico unidimensionale Energia hidrelétrica vantagens e desvantagens
Energia hidrelétrica vantagens e desvantagens Potenziale elettrico definizione
Potenziale elettrico definizione Massa inerziale e gravitazionale zanichelli
Massa inerziale e gravitazionale zanichelli Unidades de la energia potencial
Unidades de la energia potencial 10 tipos de energía
10 tipos de energía Uda l'energia e le sue trasformazioni
Uda l'energia e le sue trasformazioni Força gravitacional formula
Força gravitacional formula Cuando la energia mecanica se conserva
Cuando la energia mecanica se conserva Nuclear concepto
Nuclear concepto Energia nucleare pro e contro
Energia nucleare pro e contro