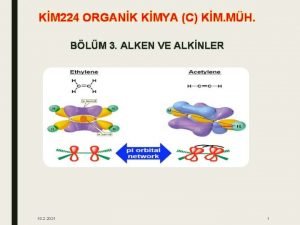
ANALTK KMYA 1 GR Analitik Kimya Fen ve
























































- Slides: 63

ANALİTİK KİMYA 1

GİRİŞ • Analitik Kimya: Fen ve yaşam bilimleri alanlarında sonucu etkileyen kimyasal maddelerin tanımlanması ve miktarlarının belirlenmesi amacıyla klasik veya ileri teknoloji yöntemleri kullanma, geliştirme ve ölçme bilimidir. • Analitik kimya, maddenin hangi bileşenlerden ve bu bileşenlerin hangi oranlarda birleşmesiyle meydana geldiğini inceleyen kimyanın bir dalıdır. • Kısaca maddenin yapısının aydınlatılmasını sağlayan bilim dalıdır. Aydınlatma, maddenin içindeki element, molekül, iyon, atom veya grupların bilinmesi olabilir. 2

• Yapının aydınlatılmasında uygulanan yöntem analizdir. Analitik kimyada yapılan analizleri nitel analiz ve nicel analiz olarak iki gruba ayırabiliriz. • Nitel analiz: Bir numunedeki bileşenlerin (element veya bileşik) neler olduğunu ortaya koyma işlemidir. • Nicel analiz: Bir numunedeki her bileşenin miktarını belirleme işlemidir. • Analit: Bir numunedeki tayin edilecek bileşenleri ifade eder. • Derişim: Başka bir maddenin hacmi ve kütlesine bağlı olarak verilen analit miktarıdır. 3

• Analitik kimyanın nitel (kalitatif) analiz ve nicel (kantitatif) analiz olmak üzere iki temel işi vardır. • Nitel analiz (kalitatif), örneğin hangi bileşik, iyon veya element içerdiğini belirlemeyi sağlar. • Nicel analiz (kantitatif) ise örnekteki bileşenlerin bağlanma miktarlarının bulunmasını sağlar. • Başka bir ifade ile, bir maddenin içinde nelerin var olduğunun araştırılması işlemine nitel analiz, ne kadar var olduğunun araştırılması işlemine nicel analiz denir. 4

• Bir analizin nitel mi yoksa nicel mi olduğu, sonucuna bakarak da anlaşılabilir. • Analiz sonucu bir sözcük, bir element veya bir bileşik ismi ile ifade edilmiş ise nitel analiz, bir rakamla ifade edilmiş ise nicel analiz olduğu anlaşılır. • Bir nicel analiz için doğru yöntemin seçilebilmesi çoğu kez nitel analiz sonuçlarına bağlıdır. • Karışım içinde hangi maddelerin bulunduğunun bilinmesi sağlıklı bir nicel analiz için zorunludur. Aksi hâlde karışımdaki maddeler, analizi olumsuz yönde etkileyebilir. 5

Bu nedenle nitel analize nicel analizin ilk basamağı olarak da bakılabilir. • Nitel analiz analitik kimyada "hangi? , Ne? Ne kadar? " " sorusuna yanıt ararken, • Nitel analiz, “numune nasıl bir madde? ; bileşik mi? karışım mı? , bu numunede hangi maddeler mevcut? ” gibi soru silsilesine, ayırma işlemleri sonrasında klasik ve aletli yöntemleri kullanarak cevap arar. • Nitel ve nicel analiz uygulamada da birlikte düşünülmesi gerekir ve birbirinin tamamlayıcısı durumundadır. • Bir nicel analiz için doğru bir yöntemin seçilebilmesi çoğu kez nitel analiz sonuçlarıyla yakından ilgilidir. 6

• Nicel analiz uygulanan yöntemler yönünden klasik ve aletli (enstrümental) olmak üzere ikiye ayrılır. • Analiz yalnız organik veya inorganik kimyasal maddelerin çözeltileri kullanılarak gerçekleştirilmişse buna klasik yöntem denir • Klasik yöntemler kütle veya hacim özelliklerinin ölçümüne dayanan yöntemler olup, gravimetrik ve volumetrik yöntemler olarak sınıflandırılır. • Gravimetrik analiz: Analit veya bilinen saf bir türünün kütlesinin analitik teraziyle ölçümüne dayanan analiz yöntemidir. • Gravimetrik yöntemde analiz edilen madde (analit) veya onun bir bileşiğinin kütlesi belirlenir. 7

• Volumetrik yöntemler: Analit ile reaksiyona giren ve derişimi tam olarak bilinen bir çözeltinin hacim ölçümüne dayanır. • Volumetrik yöntemde ise analitle tam tepkime veren bir maddenin çözeltisinin hacmi bulunur. 8

• Klasik yöntemlerde maddenin nötürleşme, çökme, kompleksleşme, redoks gibi moleküler düzeydeki özelliklerinden yararlanılır. • Gravimetrik yöntemlerde bir bileşikteki ilgilenen maddenin suda çözünmeyen bileşiği oluşturulur. • Volumetrik yöntemlerde analizlenecek madde, derişimi bilinen belli hacimdeki çözeltisiyle tepkimeye sokulur. 9

Nicel (kantitatif) Analiz Basamakları • • Analiz metodu seçimi Numune alma Numune hazırlama Çözelti hazırlama Bozucu etkileri giderme Ölçme Hesaplama Güvenirlik hesabı 10

• Eğer analiz sırasında bu çözeltilerin yanısıra modern araçlar da kullanılmışsa buna da enstrumental yöntem, modern veya aletli yöntem denir. • Aletli yöntemlerde ana prensip analizlenecek maddenin elektriksel, elektro kimyasal, atomik veya molekülsel gibi bazı özelliklerinden yararlanmaktır. • Aletli yöntemler ise ışığın absorpsiyonu, emisyonu, saçılması gibi özelliklerinin analit derişimiyle değişimine veya magnetik, elektrik ve radyoaktiflik değişiminin incelenmesine dayanan, ileri teknoloji cihazların kullanıldığı pahalı ancak hızlı ve doğru analiz imkanı sunan yöntemlerdir. 11

• Özellikle son yıllarda geliştirilen spektroskopik, kromatografik ve elektroanalitik yöntemler ya da bunların birleştirilmiş yöntemleri sayesinde analitik kimya; biyoloji, kimya ve fizik tabanlı temel araştırmalardan, ilaç, gıda, zirai, maden ve malzeme teknolojilerine dayanan ürün geliştirilmesi ve kalite kontrollerine, çevresel kirliliğin izlenmesi ve önlenmesinden, doğru, hızlı tayin ve teşhis teknolojilerine, tıbbi ve klinik çalışmalardan, adli tıbba kadar uzanan birçok önemli alanlarla işbirliği içindedir. 12

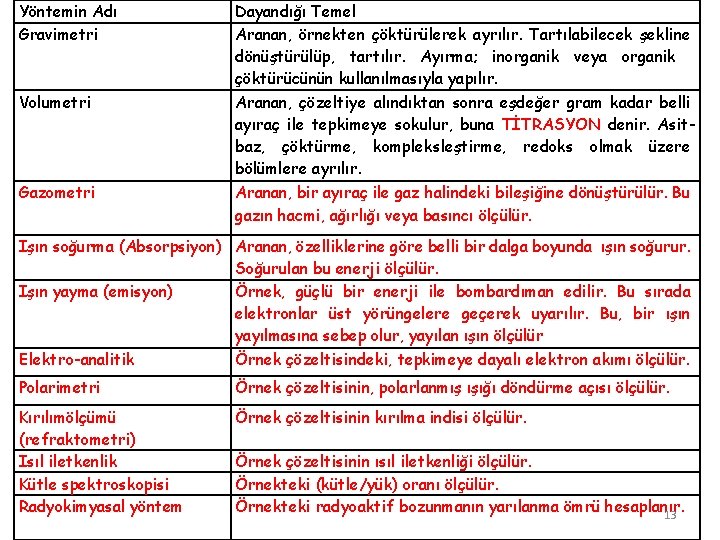
Yöntemin Adı Gravimetri Volumetri Gazometri Dayandığı Temel Aranan, örnekten çöktürülerek ayrılır. Tartılabilecek şekline dönüştürülüp, tartılır. Ayırma; inorganik veya organik çöktürücünün kullanılmasıyla yapılır. Aranan, çözeltiye alındıktan sonra eşdeğer gram kadar belli ayıraç ile tepkimeye sokulur, buna TİTRASYON denir. Asitbaz, çöktürme, kompleksleştirme, redoks olmak üzere bölümlere ayrılır. Aranan, bir ayıraç ile gaz halindeki bileşiğine dönüştürülür. Bu gazın hacmi, ağırlığı veya basıncı ölçülür. Işın soğurma (Absorpsiyon) Aranan, özelliklerine göre belli bir dalga boyunda ışın soğurur. Soğurulan bu enerji ölçülür. Işın yayma (emisyon) Örnek, güçlü bir enerji ile bombardıman edilir. Bu sırada elektronlar üst yörüngelere geçerek uyarılır. Bu, bir ışın yayılmasına sebep olur, yayılan ışın ölçülür Elektro-analitik Örnek çözeltisindeki, tepkimeye dayalı elektron akımı ölçülür. Polarimetri Örnek çözeltisinin, polarlanmış ışığı döndürme açısı ölçülür. Kırılımölçümü (refraktometri) Isıl iletkenlik Kütle spektroskopisi Radyokimyasal yöntem Örnek çözeltisinin kırılma indisi ölçülür. Örnek çözeltisinin ısıl iletkenliği ölçülür. Örnekteki (kütle/yük) oranı ölçülür. Örnekteki radyoaktif bozunmanın yarılanma ömrü hesaplanır. 13

2. GÜVENLİ ÇALIŞMA VE TEHLİKELİ KİMYASALLAR • Laboratuvarda çalışma kurallarının başında ”güvenli çalışma“ gelmektedir. • Laboratuarda alınacak güvenlik önlemlerinin en önemlileri; • Tehlike kaynakları hakkında yeterli bilgiye sahip olunmasıdır. 14

• 1. Herhangi bir nedenle tehlikeli bir durumla karşılaşıldığında yapılacak olan işlemlerin eksiksiz ve yanlışsız uygulanmasıdır. Bu nedenle çalışmaya başlamadan önce; • 2. Kullanılacak kimyasal maddelerin özellikleri iyi bilinmeli ve çalışmalar sırasında dikkatli olmalıdır. • 3. Araçların kullanım kılavuzları dikkatlice okunarak kullanım kurallarına uyulmalıdır. • 4. Araçlardan kaynaklanabilecek tehlikeler hakkında yeterli bilgiye sahip olmalıdır. Kaza anında uygulanacak ilk yardımın hızlı ve yöntemine uygun olarak yapılması da ayrıca önemlidir. 15

ZEHİRLENMELER Kimyasal analiz laboratuvarlarında sıklıkla karşılabilecek kazalardan biri de zehirlenmelerdir. Bu kazalar daha çok deneyimsiz kişilerde meydana gelir. Zehirlenmeler genelde üç şekilde meydana gelir. Bunlar; • Zehirli bir gazın solunması, • Zehirli bir kimyasal bileşiğin ağıza alınması veya yutulması, • Derinin (özellikle eller yoluyla) zehirli maddeyi absorbe etmesi şeklindedir. 16

• • Gazlardan zehirlenmede ilk yapılacak hareket kişinin gazlı ortamdan temiz havaya çıkması veya çıkartılmasıdır. Açık havaya çıkartılan hasta ayakta durmaması gerekirse suni solunum uygulanmalıdır. Sindirim sistemine bulaşan zehirli madde eğer ağız içinden mideye inmişse veya bir miktar bulaşık kısım ağızda duruyorsa hemen ağızdan çıkartılmalı ve ağız içi bol suyla yıkanmalıdır. Zehirleyici maddenin midedeki konsantrasyonunu seyreltmek bakımından yararlı olabilir. Derinin kimyasal maddeleri absorbsiyonu halinde ilk yapılacak iş derinin yüzeyinin kimyasal madde ile temasını kesmek ve yüzeyi bol su ile yıkamaktır. Her türlü zehirlenmelerde kazazede en kısa zamanda bir sağlık kurumuna götürülmelidir. Bazı tipik zehirlenmeler için belirtilen ilk yardımların yapılması çoğu kez vakit kaybını önlemek veya zehrin etkisini azaltmak açısından yararlı olur. Asetik asit zehirlenmesi; Magnezyum oksit, tebeşir, sabun çözeltisi veya yağ içirilir. Hemen açık havaya çıkarılır, gerekirse suni solunun uygulanır. Karbonmonoksit (CO) veya havagazı zehirlenmesi; Suni solunum uygulanmalı, ambulans gelene kadar suni solunuma devam edilmeli. Kloroform ve eter zehirlenmesi; Baş ve göğse soğuk su serpilmeli ve suni solunum yapılmalıdır. 17

• Hidroklorik asit, nitrik asit, fosforik asit zehirlenmeleri (asit zehirlenmeleri); Alkali karbonat, albumin, magnezyum oksit (Mg. O) bulamacı, hafif vakalarda süt içirilmelidir. • Hidrosiyaniik veya prussik asit zehirlenmeleri; Oksijenli su içirilebilir, suni solunum yapılmalıdır. Demir sülfatta kullanılabilir. Amonyak koklatılır. • İyot zehirlenmesi; Nişastalı gıdalar yenir. Süt veya albümin içerilir. Sodyum tiyosülfat, potasyum sülfat veya magnezyum sülfat süspansiyonu da içirilebilir. En uygunu midenin yıkanmasıdır. • Civa zehirlenmesi; Yumurta akı, süt veya tebeşir tozu içirilir. Ayrıca mide de yıkanmalıdır. • Sodyum hidroksit, potasyum hidroksit zehirlenmeleri (Alkali zehirlenmesi); Limon ya da portakal suyu, sıvı yağ, süt veya ayran içirilmelidir. • Metanol zehirlenmesi; Mide yıkanmalıdır. Süt, yumurta akı veya sulu nişasta içilir. Gerekirse suni solunum yapılmalıdır. 18

ASİTLER VE ÖZELLİKLERİ • Deriye temas ettiğinde, solunduğunda, ağız yoluyla alındığında kuvvetli tahriş edici maddelerdir. Asit çözeltilerinin derişimi arttıkça tahriş edici özellikleri de artar. • **Derişik asitler seyreltme amacıyla suyla karıştırılınca ekzotermik tepkime sonucu çok büyük ısı açığa çıkar ve sıçramalara neden olur. • 1. Asitler birçok metal kapları, bazı plastik kapları kolayca çözerler. • 2. Giysilere bulaştığında yakıcı, delici özellik gösterirler. 19

• 3. Bazıları (HCN gibi) zehirlidirler. H 2 SO 4, HF, HCl gibi asit buharları solunum yolları ve göz mukozasını tahriş ederek aşırı tahribatlara neden olurlar. • 4. Halojenler, Ag, Hg, alkali metaller gibi maddelerle temas ettiklerinde ısı açığa çıkaran patlayıcı tepkimeler verirler. • Bu nedenle asitlerle çalışırken yukarıda belirtilen özellikler dikkate alınarak çalışılmalıdır. 20

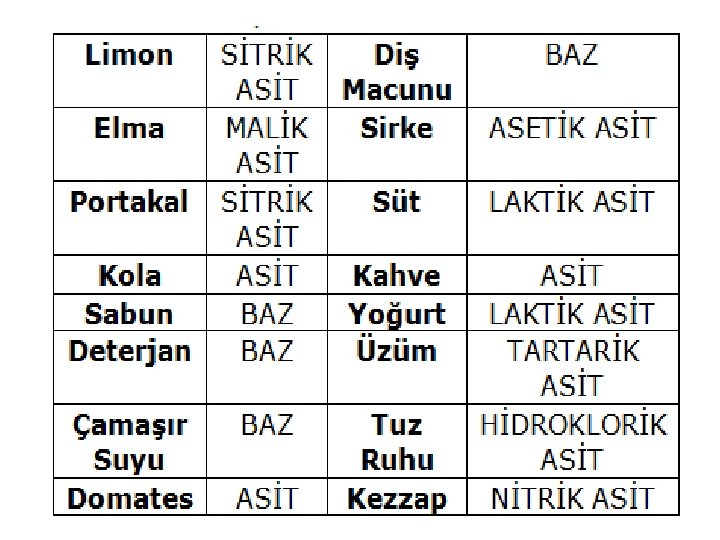
ASİTLERİN GENEL ÖZELLİKLERİ 1 -Asitler suda iyonlaşarak çözünürler. Çözeltileri elektrik akımını iletir. HCl(s) + H 2 O(s)→ H 3 O(suda)+ + Cl(suda) 2 - Tadları ekşidir. Ekşi tada sirkede asetik asit, limonda sitrik asit, yoğurt suyunda laktik asit neden olur. 3 - İndikatör maddelerin rengini değiştirirler. İndikatör (belirteç), ortamın asidik veya bazik olmasına göre renk değiştirebilen maddelere verilen addır. Turnusol kağıdı, fenolftalein çözeltisi, metil oranj bu tür maddelerdendir. Asitler mavi turnusol kağıdını ve sarı renkli metil oranjı kırmızıya çevirirler. Renksiz fenolftalein çözeltisinin rengini değiştirmezler. 4 - Asitler metaller ile metalin elektron verme isteğine göre etkileşirler. Aşağıda elektron verme isteği hidrojenden büyük ve küçük olan metaller verilmiştir. Elektron verme isteği H’den büyük olanlar : K, Na, C, a Mg, Al, Zn, Fe Elektron verme isteği H’den küçük olanlar : H Cu Ag Hg Au Pt (Soy metaller) Elektron verme isteği hidrojenden büyük olan metaller asidin hidrojeni ile yer değiştirerek H 2 gazı üretirler. Elektron verme isteği hidrojenden küçük olan metallere HCl, HI gibi oksijensiz asitler etki etmez. Soy metaller oksijenli asitlerle tepkimeye girerler, fakat H 2 gazı oluşmaz. Asidin yapısı parçalanarak SO 2, NO 2, 21 NO gibi gazlar oluşur.

5 - Bazlarla birleşerek genellikle tuz ve su oluştururlar. Asit ve bazların birleşerek tuz ve su oluşturması olayına nötürleşme reaksiyonları denir. • HCl + Na. OH → Na. Cl + H 2 O • Asit Baz Tuz Su 6 - Asitler karbonatlı bileşiklere etki ederek CO 2 gazı üretirler. 7 - Asitlerin hemen hepsi kuvvetleri ile doğru orantılı olarak tahriş edici ve parçalayıcıdır Bazılarının zehirli olması sebebiyle laboratuvarlarda çalışırken doğrudan temastan kaçınılmalı, koklanmamalı ya da teneffüs edilmemelidirler 22

ASİTLİK KUVVETİ • Suda çözündüklerinde kolay iyonlaşabilen asitlere kuvvetli asitler denir. Asitlerin kuvveti iyonlaşma yüzdelerine bağlıdır. İyonlaşma yüzdesi arttıkça asitlik kuvveti artar. Bir asidin iyonlaşma yüzdesi, asitlik hidrojeninin moleküle bağlanma kuvveti ile ilişkilidir. Asitlik hidrojeninin moleküle bağlanma kuvveti ne kadar zayıf ise, molekülden o kadar kolay ayrılabilir (iyonlaşabilir). • H 2 SO 4, HCl, HNO 3, HCl. O 4 gibi asitler, tamamen iyonlaşabildikleri için kuvvetli asitlerdir. İyonlaşma denklemleri tek yönlü gösterilir. Suda çözündüklerinde %100 ya da %100’e yakın iyonlaşabilen asitlere kuvvetli asit denir. Kuvvetli asitlerin sulu çözeltileri kuvvetli elektrolit özellik gösterir. • Elektrik akımını iyi iletebilen çözeltilere kuvvetli elektrolit, elektrik iletkenleri zayıf olan çözeltilere zayıf elektrolit denir. • Suda çözündüklerinde çok az iyonlaşabilen asitlere zayıf asitler denir. Bunların sulu çözeltileri zayıf elektrolittir. HF, HCN, HCOOH, CH 3 COOH gibi asitler zayıftır. 23

• Asitlik kuvvetini belirlemede aşağıdaki bilgilerden yararlanılabilir: 1) Periyodik sistemde aynı grupta yukarıdan aşağıya doğru inildikçe, elementlerin atom hacimleri büyür ve hidrojenli bileşiklerde hidrojenin moleküle bağlanma gücü zayıflar. İyonlaşma kolaylaşır. Asitlik kuvveti artar. 2)Periyodik cetvelde aynı periyod da soldan sağa doğru gidildikçe elementlerin atom çapı küçülür, elektronegatiflik artar. Hidrojenli bileşiklerde, hidrojen ile diğer elementlerin elektronegatiflik farkı artacağından, bileşiğin iyonik karakteri ve iyonlaşma yüzdesi artar. Asitlik kuvveti artar. Atom çapı ve elektronegatiflik farkı ile belirlenen asitlik kuvveti çelişiyormuş gibi gözükse de asitlik kuvvetinde atom hacmi daha üstün bir etkiye sahiptir. 3) Aynı elementlerden oluşmuş inorganik oksijenli asitlerde (oksi asitler) oksijen sayısı arttıkça H+ iyonunun kopması kolaylaşacağından, asitlik kuvveti artar. • Örneğin; asitlik kuvveti • HNO 2 < HNO 3 H 2 SO 3 < H 2 SO 4 H 3 PO 3 < H 3 PO 4 • HCl. O < HCl. O 2 < HCl. O 3 < HCl. O 4 şeklinde sıralanır. • –COOH grubu taşıyan asitlere organik asit denir. Organik asitler genel olarak zayıftırlar. Bu asitlerde C sayısı arttıkça asitlik kuvveti azalır. Karboksilik asitlerin ilk üç üyesi suda iyi çözünür. Bileşikteki C sayısı arttıkça sudaki çözünürlükleri azalır. • Örneğin; HCOOH > CH 3 COOH > C 2 H 5 COOH> C 3 H 5 COOH> • formik asit > asetik asit> propionik asit> bütirik asit • Karboksilik asitlerde (-COOH) grubu polar yapılı, alkil grubu apolar yapılıdır. Molekül 24 büyüdükçe apolar kısım büyümektedir. Dolayısı ile çözünürlük azalmaktadır.

• • • KUVVETİ ASİTLER: Güçlü elektrolit çözelti oluştururlar HCl: Hidrojen klorür (Oda sıcaklığında moleküler gazdır) HCl: Hidroklorik asit (Mide asidinde bulunur) HBr: Hidrobromik asit HI: Hidroiyodik asit HCN: Hidrosiyanik asit H 2 CO 3: Karbonik asit (Gazlı içecekler, kola, meyve suları) HNO 3: Nitrik asit H 2 SO 4: Sülfürik asit (Akü asidi) HCl. O 3: Klorik asit HCl. O 4: Perklorik asit H 3 PO 4: Fosforik asit (Kola benzeri içeceklerde de bulunur) 25

• • • ZAYIF ASİTLER: Zayıf elektrolit çözelti oluştururlar CH 3 COOH: Asetik asit (Sirkede bulunur) HC 9 H 7 O 4: Asetilsalisilik asit (Aspirin) H 2 C 6 H 6 O 6: Askorbik asit (C vitamini) H 3 C 6 H 5 O 7: Sitrik asit (Limon suyunda bulunur) C 3 H 6 O 3 : Laktik Asit (Süt ürünleri, Et ürünleri) HF: Hidroflorik asit H 2 S: Hidrosülfurik asit (hidrojen sülfür) HCl. O: Hipoklorik asit HNO 2: Nitröz asit

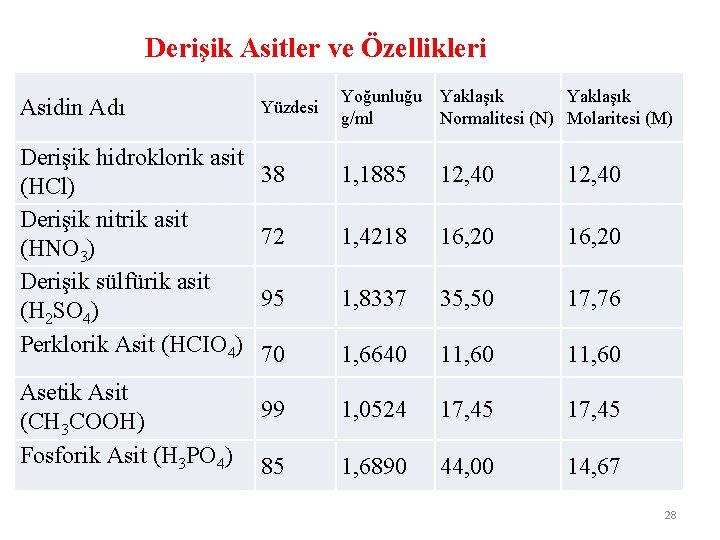
****Derişik Asitler En Fazla Molekül Kütlesi Kadar Yüzdede Olur. Derişik HCl kütlece % 36, 5’luktur (Doymuş HCl çözeltisi). Derişik H 2 SO 4 kütlece % 98’liktir (Doymuş H 2 SO 4 çözeltisi). Derişik HNO 3 kütlece % 63’lüktür (Doymuş HNO 3 çözeltisi). (H: 1, Cl: 35, 5, O: 16, S: 32, N: 14) Derişik HCl, derişik H 2 SO 4, derişik HNO 3 denince; yalnız yukarıda belirtilen yüzdelerdeki asitler anlaşılmalıdır. Diğer çözeltilerde olduğu gibi; çözeni az, çözüneni çok olan çözelti anlaşılmamalıdır. 27

Derişik Asitler ve Özellikleri Asidin Adı Derişik hidroklorik asit (HCl) Derişik nitrik asit (HNO 3) Derişik sülfürik asit (H 2 SO 4) Perklorik Asit (HCIO 4) Asetik Asit (CH 3 COOH) Fosforik Asit (H 3 PO 4) Yüzdesi Yoğunluğu Yaklaşık g/ml Normalitesi (N) Molaritesi (M) 38 1, 1885 12, 40 72 1, 4218 16, 20 95 1, 8337 35, 50 17, 76 70 1, 6640 11, 60 99 1, 0524 17, 45 85 1, 6890 44, 00 14, 67 28

BAZLAR VE ÖZELLİKLERİ • Na. OH, KOH gibi anorganik bazlar ve birçok organik bazın derişik çözeltileri kuvvetli tahriş edici ve aşındırıcı maddelerdir. • Bunlarla çalışırken deriye temas etmemesine dikkat edilmelidir. Eğer temas ettiyse kaza anında bol su ile yıkanarak temizlenmeli veya % 1’lik seyreltik asetik asit çözeltisi ile nötrleştirilmelidir. 29

BAZLARIN GENEL ÖZELLİKLERİ 1 - Bazlar suda iyonlaşarak çözünürler, çözeltileri elektrik akımını iletir. 2 - Tadları acıdır. Biberin, kireç kaymağı ve sabun köpüğünün tadlarının acı olma sebebi bazik oluşlarındandır. 3 - Ele kayganlık hissi verirler. Sabun, sodyum bikarbonat ve kostik soda gibi 4 - Kuvvetli bazlar yakıcı ve tahriş edicidir. 5 - Asitlerle nötrleşme reaksiyonu vererek genellikle tuz ve su oluştururlar. 6 - Kırmızı turnusol kağıdını maviye, renksiz fenolftalein çözeltisini pembeye çevirirler. 7 - Genel olarak metallere etki etmezler. Ancak Na. OH, KOH gibi kuvvetli bazlar Zn, Al gibi amfoter metallerle H 2 gazı üretirler. • 2 Al + 6 Na. OH → 2 Na 3 Al. O 3 + 3 H 2 Zn + 2 KOH → K 2 Zn. O 2 + H 2 30

BAZLIK KUVVETİ • Bazların kuvvetleri iyonlaşma yüzdelerine bağlıdır. İyonlaşma yüzdeleri arttıkça bazlık kuvveti artar. Bir bazın bazlık kuvveti, asitlere benzer şekilde OH- iyonunun moleküle bağlanma kuvveti ile ilişkilidir. OH- iyonunun moleküle bağlanma kuvveti ne kadar zayıf ise molekülden o kadar kolay ayrılabilir (iyonlaşabilir). • Suda çözündüklerinde %100 ya da %100’e yakın iyonlaşabilen bazlara kuvvetli baz denir. Kuvvetli bazların sulu çözeltileri kuvvetli elektrolit özellik gösterir. • Suda çözündüklerinde çok az iyonlaşabilen bazlara zayıf baz denir. • NH 3, C 6 H 5 NH 2, NH 2 OH gibi bazlar zayıftır. 31

• • • KUVVETLİ BAZLAR: Güçlü elektrolit çözelti oluştururlar Li. OH: Lityum hidroksit Na. OH: Sodyum hidroksit (Lavabo açıcı olarak kullanılır) KOH: Potasyum hidroksit Ca(OH)2: Kalsiyum hidroksit (Harç yapımında kullanılır) Sr(OH)2: Stronsiyum hidroksit Ba(OH)2: Baryum hidroksit ZAYIF BAZLAR: Zayıf elektrolit çözelti oluştururlar NH 3: Amonyak (Çözeltisi temizlik amaçlı kullanılır) Mg(OH)2: Magnezyum hidroksit (Laksatıf ilaçlarda bulunur) Sodyum metali gibi çok reaktif maddeler su ile etkileştiğinde hızla patlarlar ve bu nedenle sudan uzaktutulmalıdırlar. 32

33

ASİT VE BAZLARIN DEĞERLİĞİ • Asit Değerliği Bir molekül asidin sulu çözeltisine verebileceği H+ iyonu sayısına, o asidin değerliği denir. Asit formülü Adı Değerliği HCl Hidroklorik asit 1 H 2 SO 4 Sülfürik asit 2 HNO 3 Nitrik asit 1 H 2 CO 3 Karbonik asit 2 H 3 PO 4 Fosforik asit 3 HCOOH Formik asit 1 CH 3 COOH Asetik asit 1 HNO 2 Nitroz asit 1 • Bazı asit molekülleri birden fazla hidrojen atomu içermesine rağmen, sulu çözeltilerine daha az sayıda H+ iyonu verir. Bu moleküldeki asitliği belirten hidrojen atomuyla ilgilidir. • Örneğin; CH 3 COOH (asetik asit) 4 mol hidrojen içermesine rağmen çözeltisine 1 mol H+ iyonu verebilir. Çünkü asit hidrojeni –COOH grubundaki 34

Baz Değerliği • Bir molekul bazın sulu çözeltisine verebileceği OH- (hidroksit) iyonu sayısına o bazın değerliği denir. • Örneğin; 1 molekul Na. OH’in sulu çözeltisine verebileceği OH- iyonu sayısı 1 olduğundan değerliği 1'dir. • Na. OH(suda) → Na+(suda) + OH-(suda) • Baz formülü Adı Değerliği • KOH Potasyum hidroksit 1 • Ca(OH)2 Kalsiyum hidroksit 2 • Al(OH)3 Aluminyum hidroksit 3 • Ba(OH)2 Baryum hidroksit 2 • C 6 H 5 NH 2 Anilin 1 • NH 3 Amonyak 1 • NH 3, OH- iyonu taşımadığı hâlde 1 değerlidir. Çünkü 1 mol NH 3 suda çözündüğünde 1 mol OH- oluşturur. • NH 3(g) + H 2 O(s) NH 4+(suda) + OH-(suda) 35

LABORATUVARDA ÇALIŞMA KURALLARI • Çalışma Alanlarının Temizlenmesi • 1. Laboratuvarda çalıştığınız alanı her zaman temiz tutunuz. • 2. Laboratuvar çalışmalarının bitiminde, kullanılan tezgahlar ve cam malzemeler mutlaka temiz bırakılmalıdır. • 3. Laboratuvar ortamına numune/kimyasal madde dökülmesi durumunda temizlenmeli ve gerekirse laboratuvar sorumlusuna haber verilmelidir. • 4. Laboratuvar çalışmalarından çıkan atıklar, Laboratuvar Yönetimi’nce tanımlanan kurallar doğrultusunda uzaklaştırılmalıdır. • 5. Laboratuvar malzemelerinin temizliği sırasında eldiven ve gerekli olması durumunda gözlük kullanılması zorunludur. 36

• 6. Laboratuvarda tek başına çalışılmamalıdır. • 7. Laboratuvarda herhangi birşey yenilip içilmemeli (özellikle sigara), çalışırken eller yüze sürülmemeli, ağıza herhangi birşey alınmamalıdır. • 8. Cam kapaklı şişeler açılmazlarsa, böyle hallerde şişe kapağına bir tahta parçası ile hafifçe vurularak gevşetilir. Bu fayda etmediği taktirde camın genişlemesi için küçük bir alevle şişe döndürülerek boğazı dikkatlice ısıtılır veya şişe bir müddet su içinde batırılmış vaziyette bırakılır. Kapaklı ve tıpa ile kapatılmış kaplardaki madde kesinlikle ısıtılmamalı, üzerinde ateşe dayanıklı işareti taşımayan kaplarda ısıtma ve kaynatma yapılmamalıdır. (Pyrex: borcam, ısıya dayanıklı cam) 37

Çözelti Hazırlama • 1. Çözelti hazırlarken kimyasal maddelerin “Güvenlik Bilgi Formlarında (Material Safety Data Sheet, MSDS)” belirtilen güvenlik önlemleri alınmalıdır. • 2. Korozif maddelerle çözelti hazırlanması sırasında mutlaka koruyucu gözlük ve eldiven kullanılmalıdır. • 3. Laboratuarda yanıcı ve toksik maddelerle çalışılırken mutlaka çeker ocak kullanılmalıdır. • **4. Asidin üzerine kesinlikle su ilave edilmemeli, asit suya azar karıştırılarak ilave edilmelidir. 38

• 5. Çözeltiler ihtiyaca uygun miktarlarda hazırlanmalıdır. • 6. Çözelti için kullanılacak kimyasal maddeler, stok kabından gerekli miktarda alınmalı ve artan kimyasal madde stok kabına tekrar geri konulmamalıdır. • 7. Stok şişesine pipet daldırılmamalıdır. • 8. Pipet kullanırken mutlaka puar kullanılmalıdır. Kesinlikle ağız ile kimyasal madde çekilmemelidir. 39

Kimyasal Madde Stoklama • 1. Laboratuvar yönetimi tarafından alınan her türlü kimyasal madde “kimyasal madde saklama odası”nda stoklanmalıdır. Araştırma/uygulama projelerine ait kimyasal maddelerin bu durumları üzerlerindeki etikette ve envanterde belirtilmelidir. • 2. Kimyasal maddeler alfabetik olarak raflarda sıralanmalıdır ve kullanıldıktan sonra yerlerine geri konulmalıdır. • 3. Satın alınan kimyasal maddeler envantere kaydedilmeli ve Güvenlik Bilgi Formları, MSDS dosyasına eklenmelidir. 40

• 4. Azalan kimyasal maddeler envanterde ayrılan açıklama bölümüne kaydedilmeli ve laboratuvar sorumlusuna bildirilmelidir. • 5. Korozif maddeler çelik dolaplarda saklanmalıdır. • 6. Uçucu özelliğe sahip kimyasal maddeler +4°C odasında veya buzdolabında saklanmalıdır. • 7. Kimyasal madde miktarı ihtiyaca göre belirlenmeli ve maddenin raf ömrü göz önünde bulundurularak satın alınmalıdır. • 8. Oda sıcaklığında bozulabilecek numuneler, standartlar ve yüksek uçuculuğa sahip olan kimyasallar buzdolabında ağzı kapalı şişelerde saklanmalıdır. 41

Etiketleme*** • 1. Kimyasallar, numuneler, çözeltiler mutlaka • • • etiketlenmelidir. Etiket üzerinde, Hazırlanma tarihi, Saklama süresi, Numune sahibi, Çözeltinin/numunenin özellikleri Konsantrasyonu ve diğer gerekli olabilecek bilgiler yer almalıdır. 2. Numunenin/çözeltinin yeni bir kaba aktarılması durumunda da yeni kabın etiketlenmesi unutulmamalıdır. 42


Atıkların Uzaklaştırılması • 1. Laboratuvarda oluşan atıklar, kimyasal özelliklerine göre sınıflandırılarak uzaklaştırılmaktadır. • 2. Atık kutularında belirtilen sınıflara dikkat ederek atıklar uzaklaştırılmalıdır. • 3. Çatlak ve kırık cam malzemeler kullanılmamalıdır etiketlenmiş olan bu malzemenin cinsi (erlen, balon joje vb. ) ve laboratuvar kodu (S 6 gibi) laboratuvar sorumlusuna bildirilmelidir. • 4. Laboratuvarlarda etiketsiz malzemeler bulundurulmamalıdır. Etiketsiz malzeme, çözelti ve kimyasallar atılır. 44

45

Kimyasal güvenliğin altın kuralları. . . ASLA dolaplara etiketsiz şişeleri koymayın! Etiketleri okuyun! 46

• • GÜVENLİK BİLGİ FORMU Güvenlik Bilgi Formlarının amacı laboratuvarda kullanılan kimyasal maddelerle ilgili bilgiye çabuk erişim sağlamaktır. Formların laboratuvar yönetiminden veya internetten temin edilmesi ve herhangi bir kimyasal madde ile çalışmaya başlamadan önce MSDS mutlaka gözden geçirilmelidir. Üretici firmalar ürünleri için bu formları üretmek ve dağıtmakla yükümlüdür. Laboratuvar yönetimi kullanılan her kimyasal madde için formları kullanıcıya temin etmekle yükümlüdür. Güvenlik Bilgi Formlarının her kimyasal madde için aşağıda verilen bilgileri içerir. 47

• • • • • - KİMYASAL MADDE/KARIŞIMIN ADI VE İÇERİĞİ Üretici firma bilgileri Zararlı madde içerikleri FİZİKSEL VE KİMYASAL ÖZELLİKLERİ Yangın ve patlama bilgileri Sağlığa zararlılık bilgileri İlkyardım bilgileri DEPOLAMA BİLGİLERİ REAKTİVİTE VE STABİLİTE BİLGİLERİ Dökülme veya sızma olması ile ilgili bilgileri Ekolojik ve toksikolojik özellikler Özel tedbirleri Özel korunma bilgileri Taşıma bilgileri Uzaklaştırma bilgileri Yönetmelikler ile ilgili bilgiler Diğer bilgiler 48

49

50

51

52

53

54

55

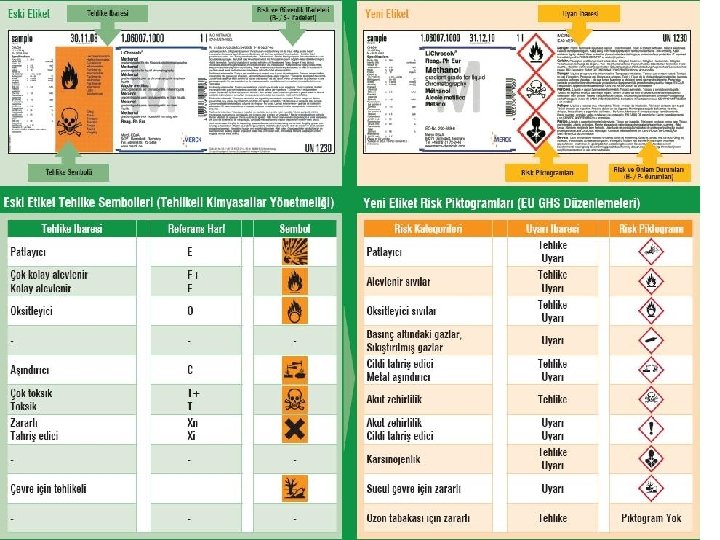
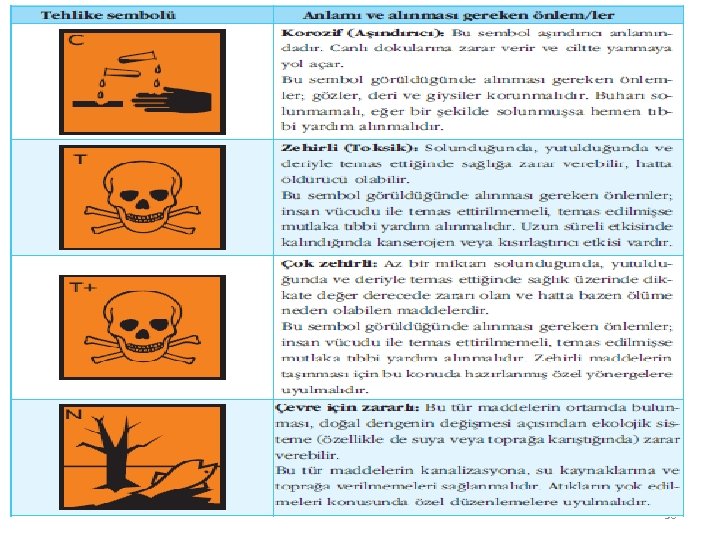
Tehlikeli kimyasallar; Ø Patlayıcı Ø Oksitleyici Ø Alevlenir, Kolay alevlenir, Çok kolay alevlenir Ø Toksik, Çok toksit Ø Zararlı Ø Aşındırıcı Ø Tahriş edici Ø Alerjik Ø Kanserojen Ø Mutajen Ø Üreme için toksik 56

57

58

59

60

61

62

63
 Kimya nedir
Kimya nedir Kantitatif rubrik nedir
Kantitatif rubrik nedir Zafer açıkgözoğlu
Zafer açıkgözoğlu Anlamlı sayılar kimya
Anlamlı sayılar kimya Modern atom teorisi çıkmış sorular
Modern atom teorisi çıkmış sorular Molekülerite katı sıvı yazılır mi
Molekülerite katı sıvı yazılır mi Uç alkin nedir
Uç alkin nedir Entropi kimya
Entropi kimya Trihidrojen mono nitrür formülü
Trihidrojen mono nitrür formülü Kimya r sabiti 0 082
Kimya r sabiti 0 082 Atom
Atom Froma kimya
Froma kimya Organik kimya solomon ders notları
Organik kimya solomon ders notları Yaygın bileşikler ve formülleri
Yaygın bileşikler ve formülleri Gksel
Gksel Kir nedir kimya
Kir nedir kimya Sabun molekülünün hidrokarbon zinciri
Sabun molekülünün hidrokarbon zinciri Aromatik kimya
Aromatik kimya Kimya gaz kanunları
Kimya gaz kanunları Alifatik nedir
Alifatik nedir Froma kimya
Froma kimya Sınırlayıcı tepken nedir
Sınırlayıcı tepken nedir Ersağ kazanç tablosu
Ersağ kazanç tablosu Artan madde problemleri kimya
Artan madde problemleri kimya Halojenasyon
Halojenasyon Gaz kanunları
Gaz kanunları Molar derişim formülü
Molar derişim formülü 7. sınıf kimya
7. sınıf kimya Organik kimya orto para meta
Organik kimya orto para meta Sikloalkin
Sikloalkin Alkolmetre sıcaklık düzeltmesi
Alkolmetre sıcaklık düzeltmesi üniform korozyon
üniform korozyon Heterojen nedir
Heterojen nedir Can kimya
Can kimya Organik kimya adlandırma öncelik sırası
Organik kimya adlandırma öncelik sırası 6. sınıf fen bilimleri göz
6. sınıf fen bilimleri göz Kidspration
Kidspration Fen
Fen She is a fen of stagnant water figure of speech
She is a fen of stagnant water figure of speech Kavram ağı kavram haritası farkı
Kavram ağı kavram haritası farkı Poetry essay on london 1802
Poetry essay on london 1802 2013 fen bilimleri öğretim programı
2013 fen bilimleri öğretim programı Bir fen laboratuvarında sıcaklık eksi 4 derecedir
Bir fen laboratuvarında sıcaklık eksi 4 derecedir Slentrol discontinued
Slentrol discontinued Fen36
Fen36 çözümleme tablosu
çözümleme tablosu Fen bilimleri alt dalları
Fen bilimleri alt dalları Fen öğretim yöntemleri nelerdir
Fen öğretim yöntemleri nelerdir Yi fen chen
Yi fen chen Hacettepe fen bilimleri
Hacettepe fen bilimleri Tollund fen
Tollund fen Canlılar dünyası bitkiler
Canlılar dünyası bitkiler Fttç nedir
Fttç nedir Hakan sevim fen lisesi
Hakan sevim fen lisesi Kurulko
Kurulko Kavram haritası kavram ağı farkı
Kavram haritası kavram ağı farkı 6.sınıf fen maddenin tanecikli yapısı test
6.sınıf fen maddenin tanecikli yapısı test Fen ohen
Fen ohen Akçadağ fatih fen lisesi
Akçadağ fatih fen lisesi Nem fen
Nem fen Osman murat kalaycı
Osman murat kalaycı Model analitik
Model analitik Pendekatan prospektif adalah
Pendekatan prospektif adalah Studi epidemiologi analitik
Studi epidemiologi analitik