11 17 Ractions des Alcnes Ractions dAddition 1






























- Slides: 88

11. 17 Réactions des Alcènes: Réactions d’Addition 1 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

Réactions des Alcènes La réaction caractéristique des alcènes est l’addition sur la double liaison. C C + A—B A C C B 2 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

11. 18 Hydrogénation des Alcènes 3 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

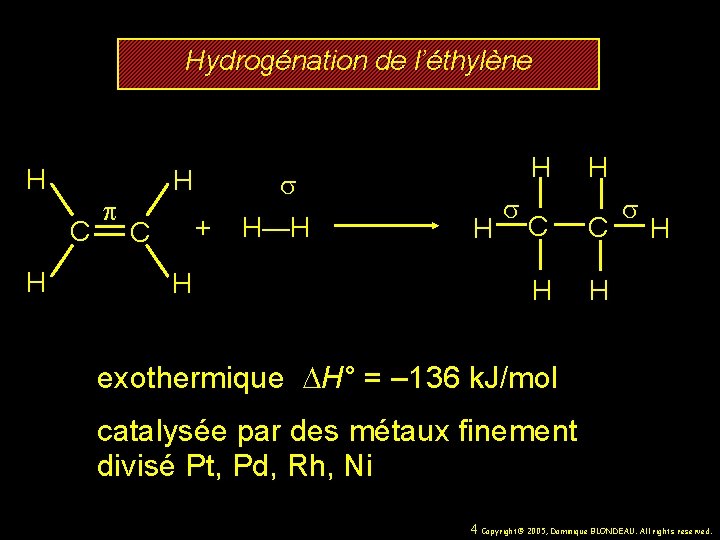
Hydrogénation de l’éthylène H C H p H s + H—H C H H H s H C C H H s H exothermique DH° = – 136 k. J/mol catalysée par des métaux finement divisé Pt, Pd, Rh, Ni 4 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

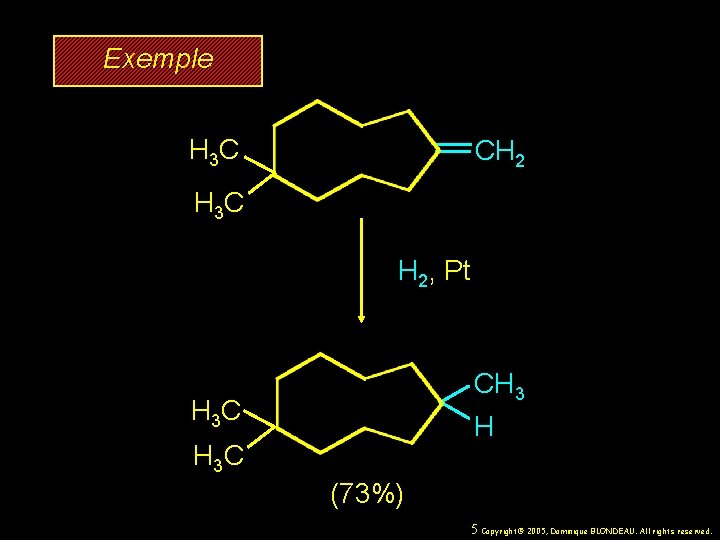
Exemple H 3 C CH 2 H 3 C H 2, Pt CH 3 H 3 C H H 3 C (73%) 5 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

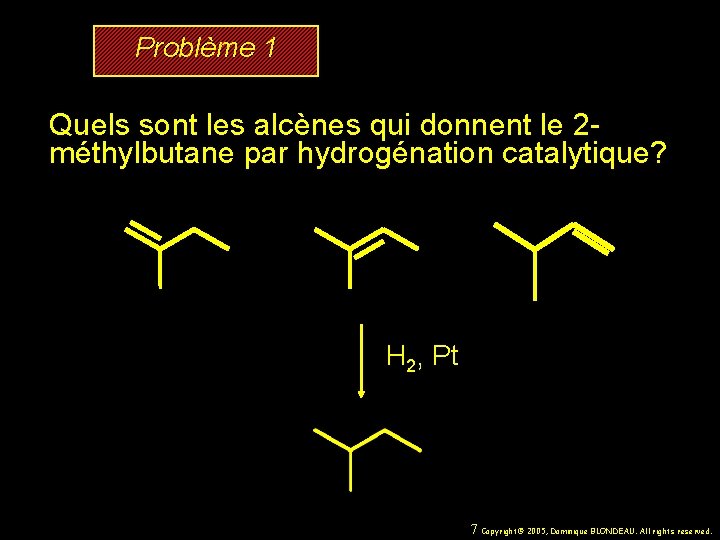
Problème 1 Quels sont les alcènes qui donnent le 2 méthylbutane par hydrogénation catalytique? 6 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

Problème 1 Quels sont les alcènes qui donnent le 2 méthylbutane par hydrogénation catalytique? H 2, Pt 7 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

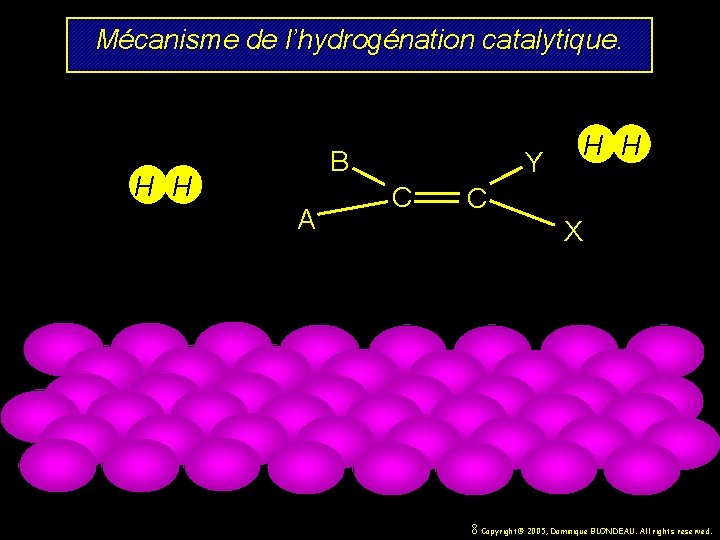
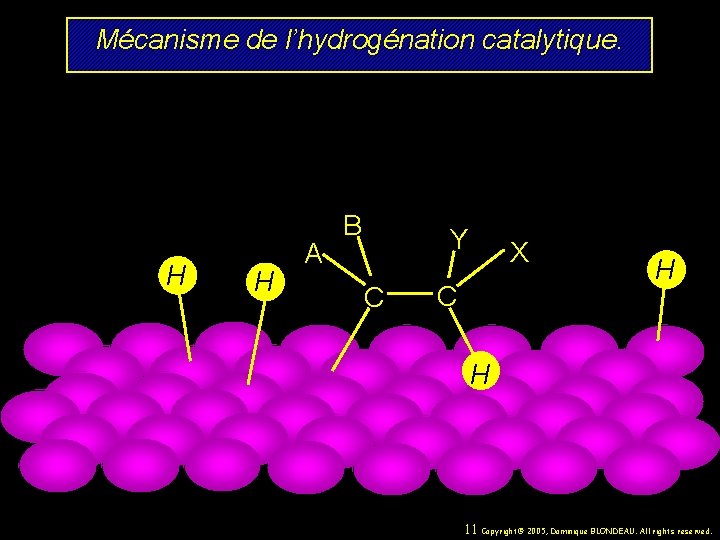
Mécanisme de l’hydrogénation catalytique. B H H A H H Y C C X 8 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

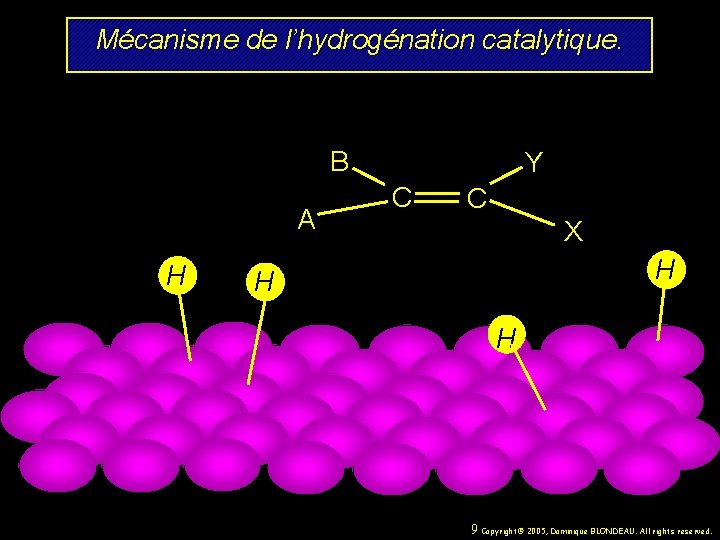
Mécanisme de l’hydrogénation catalytique. B A H Y C C X H H H 9 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

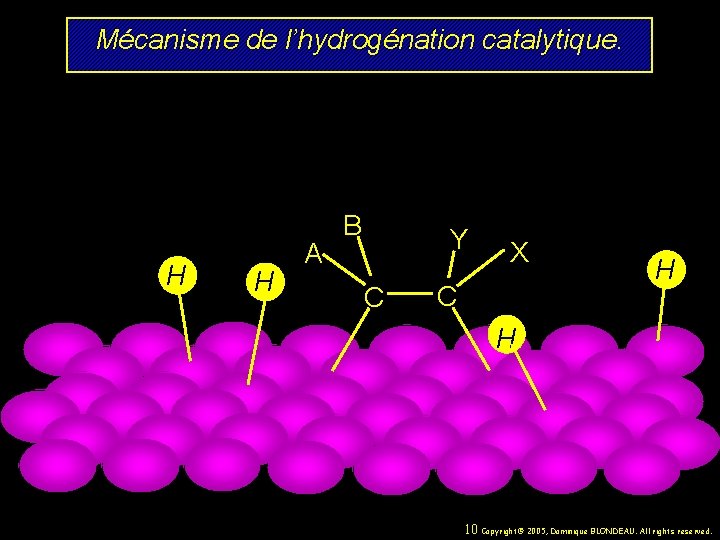
Mécanisme de l’hydrogénation catalytique. H H A B Y C X C H H 10 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

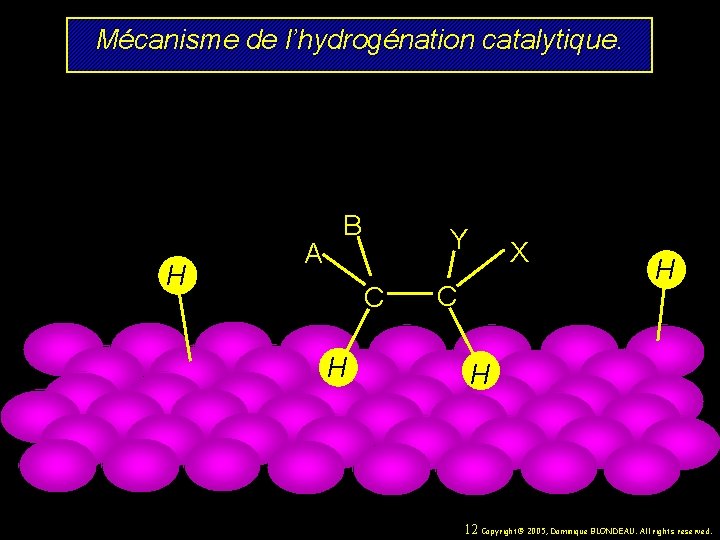
Mécanisme de l’hydrogénation catalytique. H H A B Y C X C H H 11 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

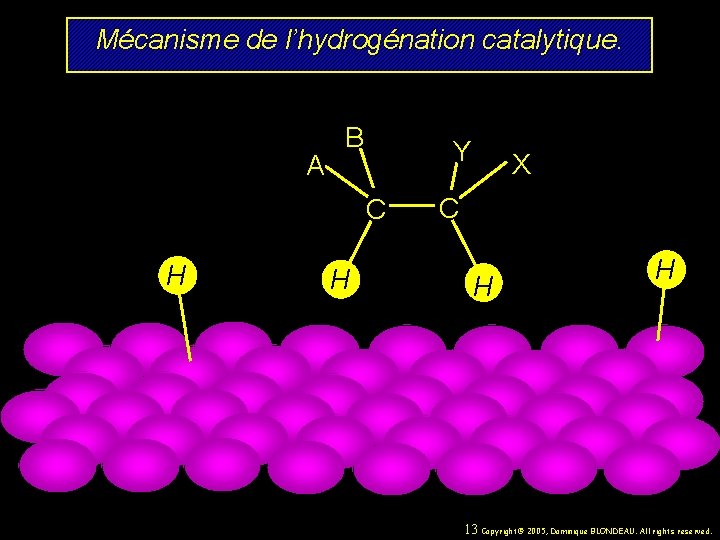
Mécanisme de l’hydrogénation catalytique. H A B Y C H X C H H 12 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

Mécanisme de l’hydrogénation catalytique. A B Y C H H X C H H 13 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

11. 19 Chaleurs de la réaction d’Hydrogénation peut être utilisé pour mesurer la stabilité relative des alcènes isomères corrélation avec la structure est la même que lors de l’utilisation des chaleurs de combustion 14 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

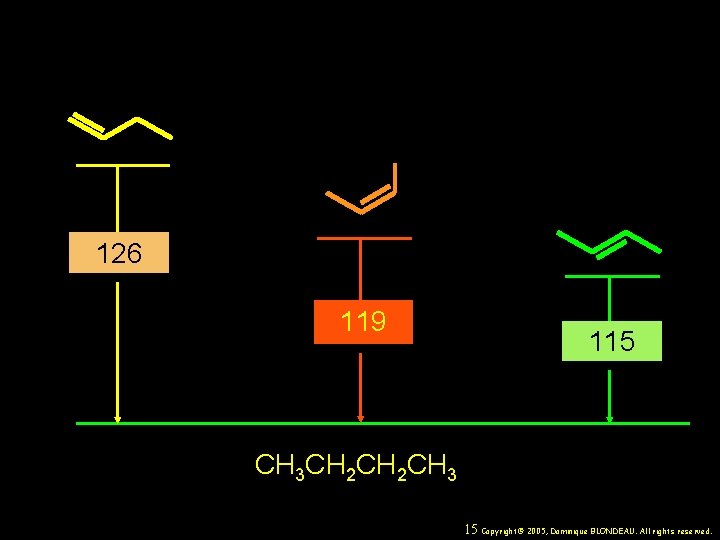
126 119 115 CH 3 CH 2 CH 3 15 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

Chaleurs d’Hydrogénation (k. J/mol) Éthylène 136 Monosubstitué 125 -126 cis-Disubstitué 117 -119 trans-Disubstitué 114 -115 C terminal disubstitué 116 -117 Trisubstitué 112 Tétrasubstitué 110 16 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

Problème Affecter aux différents isomères du 2 -méthylbutène la bonne chaleur d’hydrogénation. 126 k. J/mol 118 k. J/mol 112 k. J/mol 17 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

Problème Affecter aux différents isomères du 2 -méthylbutène la bonne chaleur d’hydrogénation. 126 k. J/mol chaleur d’hydrogénation la plus élevée; le moins stable des isomères 118 k. J/mol 112 k. J/mol chaleur d’hydrogénation la moins élevée; le plus stable des isomères 18 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

11. 20 Stéréochimie de l’Hydrogénation des Alcènes 19 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

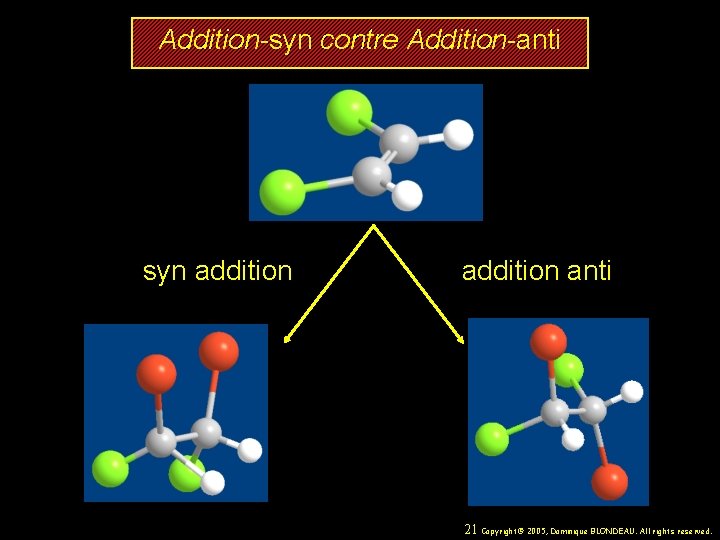
Deux aspects spatiaux (stéréochimiques) de l’hydrogénation des alcènes : addition syn des deux atomes d’H sur la double liaison l’hydrogénation est stéréosélective, correspond à l’addition sur la face la moins encombrée de la double liaison 20 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

Addition-syn contre Addition-anti syn addition anti 21 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

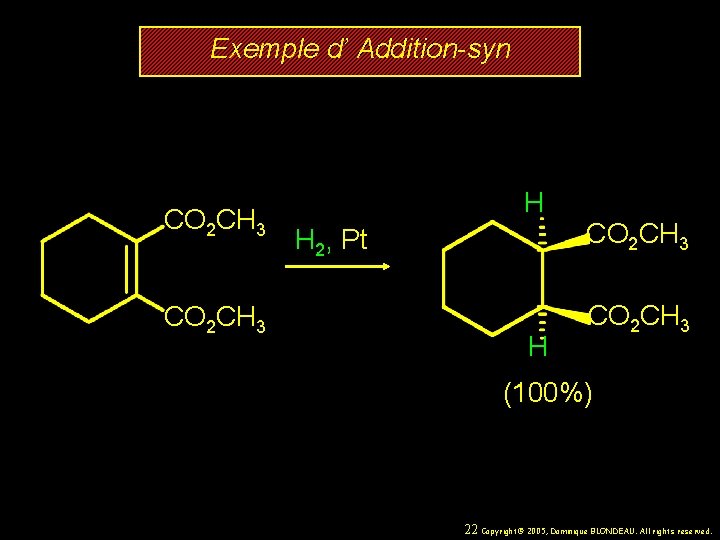
Exemple d’ Addition-syn CO 2 CH 3 H H 2, Pt H CO 2 CH 3 (100%) 22 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

Stéréosélectivité Une réaction, qui partant d’un composé unique peut donner deux ou plus de stéréoisomères, fournit un seul d’entre eux en plus grande quantité (ou même à l’exclusion des autres) est dite réaction stéréosélective. 23 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

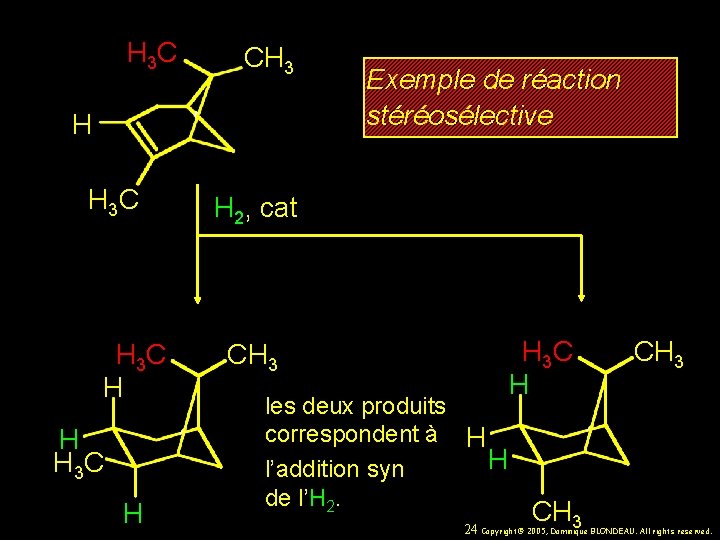
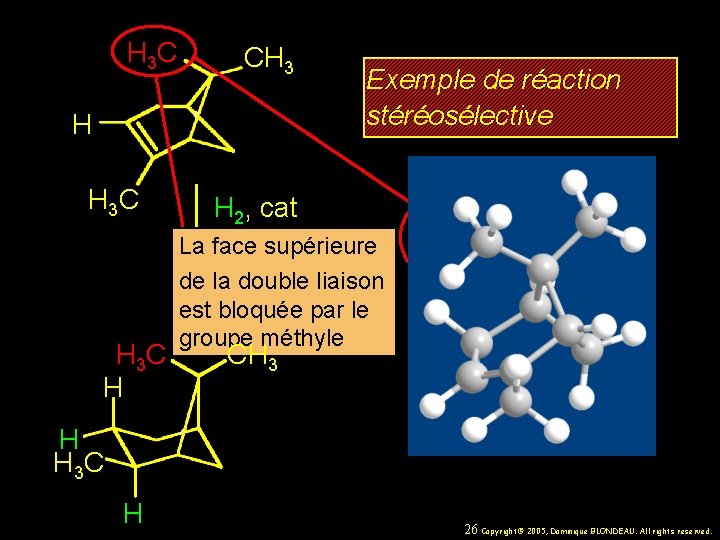
H 3 C CH 3 H H 3 C H Exemple de réaction stéréosélective H 2, cat CH 3 les deux produits correspondent à H H l’addition syn de l’H 2. H 3 C H CH CH 3 3 BLONDEAU. All rights reserved. 24 Copyright© 2005, Dominique

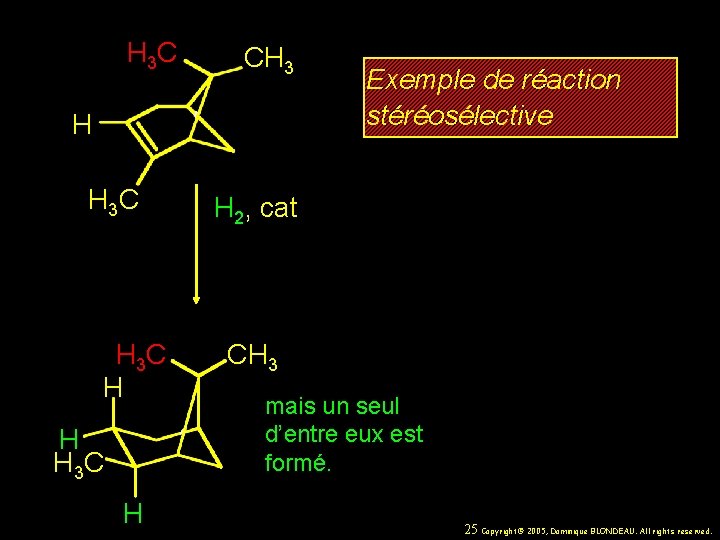
H 3 C CH 3 H H 3 C H Exemple de réaction stéréosélective H 2, cat CH 3 mais un seul d’entre eux est formé. 25 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

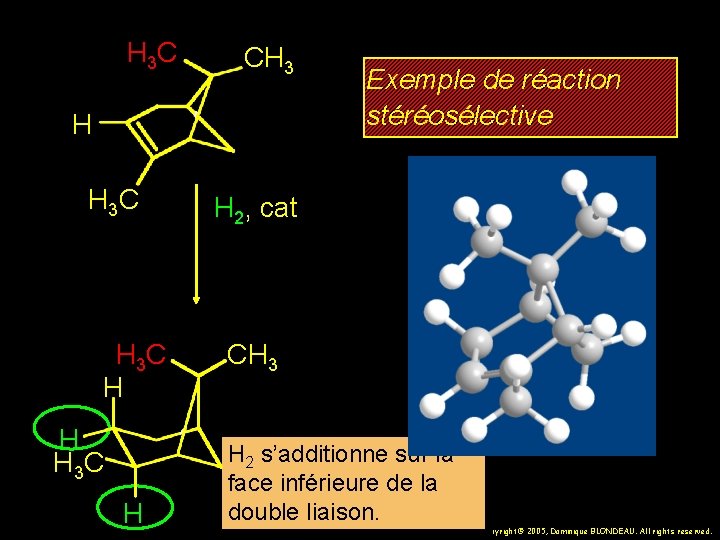
H 3 C CH 3 H H 3 C H Exemple de réaction stéréosélective H 2, cat La face supérieure de la double liaison est bloquée par le groupe méthyle CH 3 H H 3 C H 26 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

H 3 C CH 3 H H 3 C H Exemple de réaction stéréosélective H 2, cat CH 3 H 2 s’additionne sur la face inférieure de la double liaison. 27 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

11. 21 Addition électrophile des Halogénures d’Hydrogène aux Alcènes 28 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

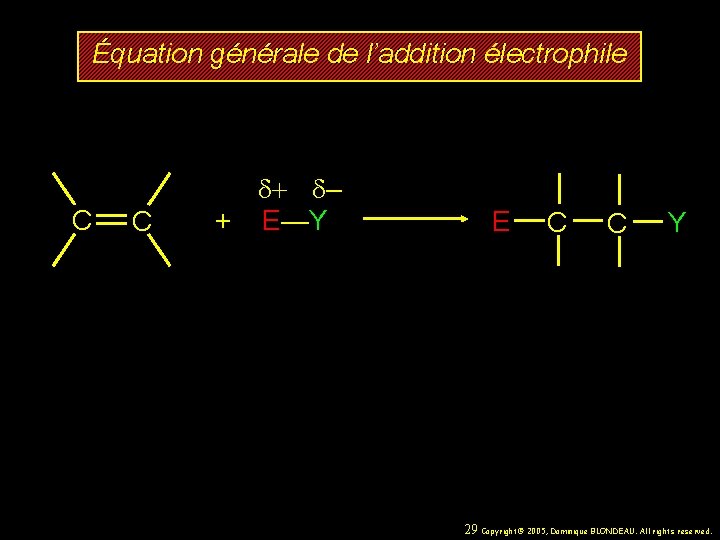
Équation générale de l’addition électrophile C C d+ d– + E—Y E C C Y 29 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

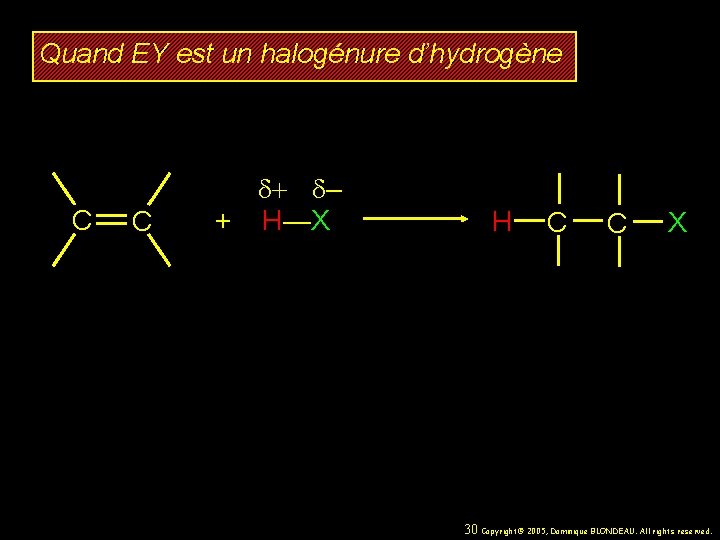
Quand EY est un halogénure d’hydrogène C C d+ d– + H—X H C C X 30 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

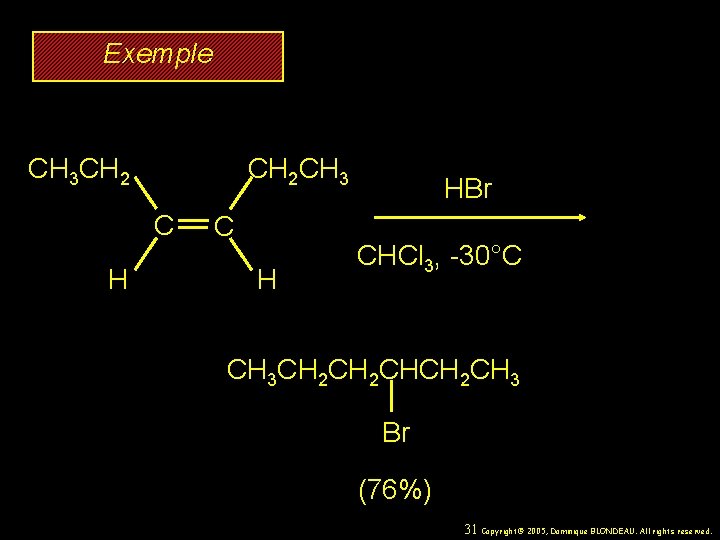
Exemple CH 2 CH 3 CH 2 C H HBr CHCl 3, -30°C CH 3 CH 2 CHCH 2 CH 3 Br (76%) 31 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

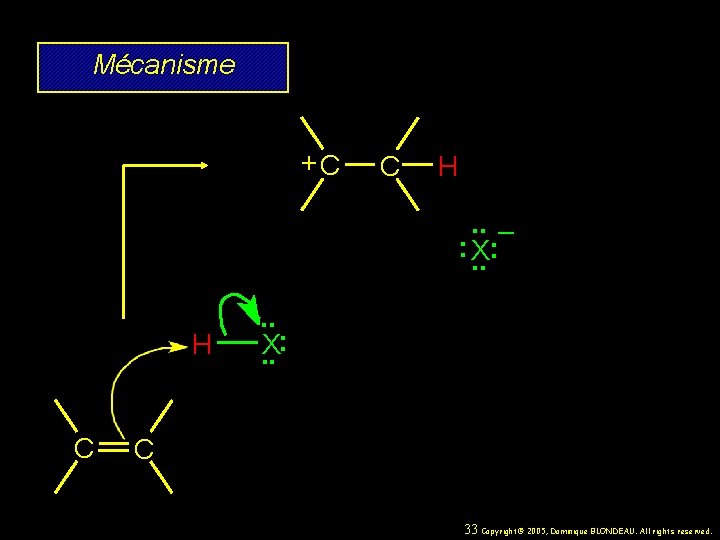
Mécanisme Addition électrophile des halogénures d’hydrogènes aux alcènes se déroule suivant une étape déterminante passant par la formation d’un carbocation intermédiaire. 32 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

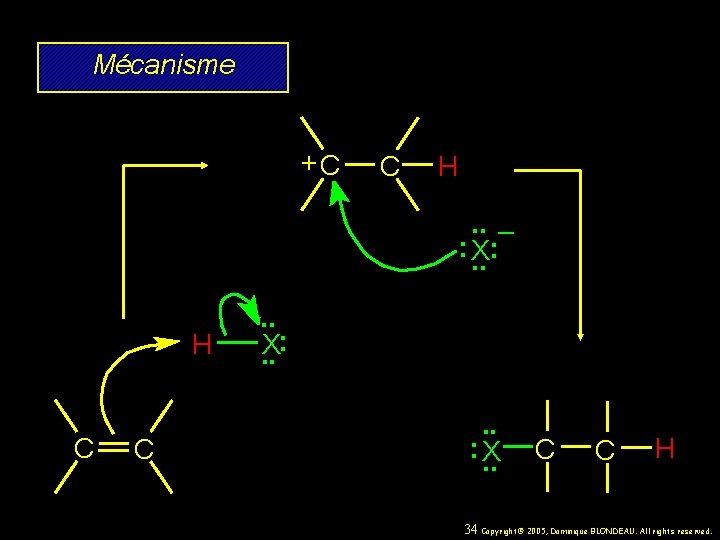
Mécanisme +C H C C H. . – : X. . : . . X: . . C 33 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

Mécanisme +C H C C C H. . – : X. . : . . X: . . : X. . C C H 34 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

11. 22 Régiosélectivité de l’addition des halogénures d’hydrogène: Règle de Markovnikov 35 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

Règle de Markovnikov Quand un alcène dissymétrique réagit avec un halogénure d’hydrogène, l’hydrogène s’additionne sur le carbone qui porte le plus d’atomes d’hydrogène. L’halogène se fixe sur le carbone qui porte le moins d’atomes d’hydrogène. 36 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

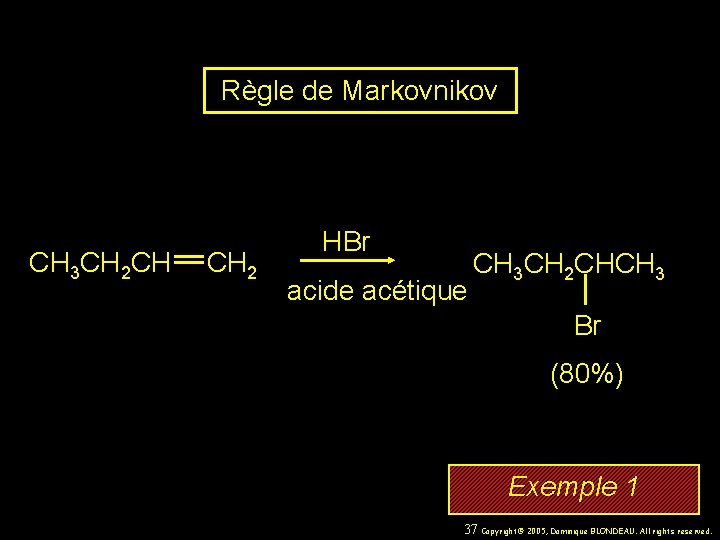
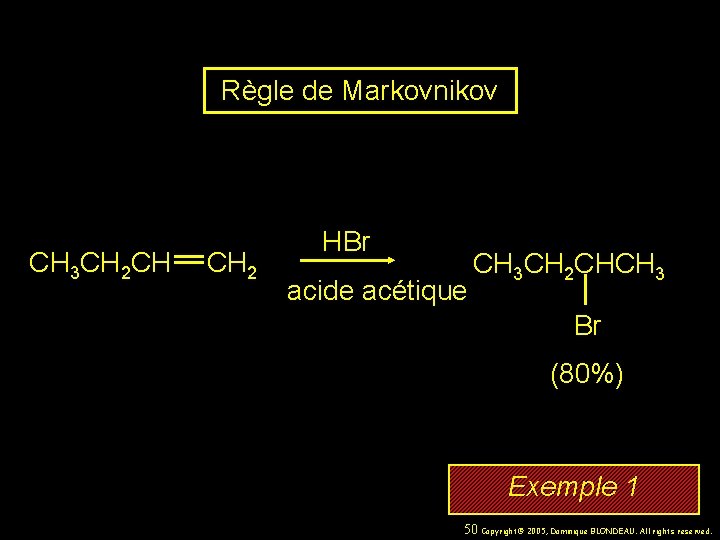
Règle de Markovnikov CH 3 CH 2 CH CH 2 HBr acide acétique CH 3 CH 2 CHCH 3 Br (80%) Exemple 1 37 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

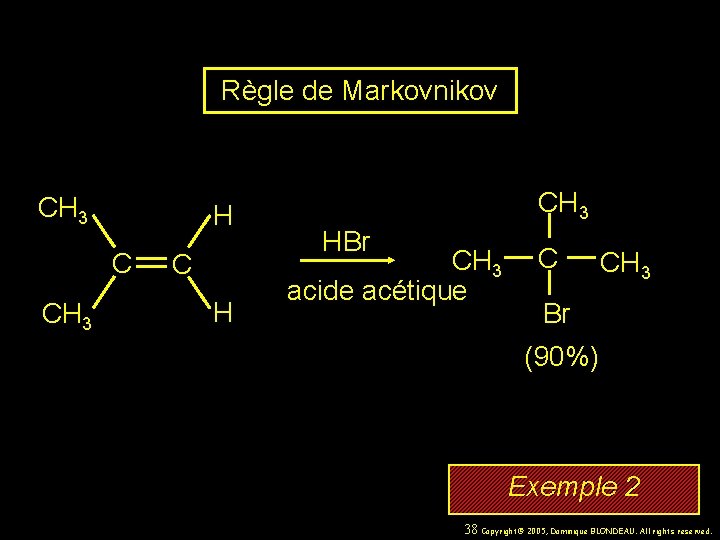
Règle de Markovnikov CH 3 H C CH 3 C H CH 3 HBr CH 3 acide acétique C CH 3 Br (90%) Exemple 2 38 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

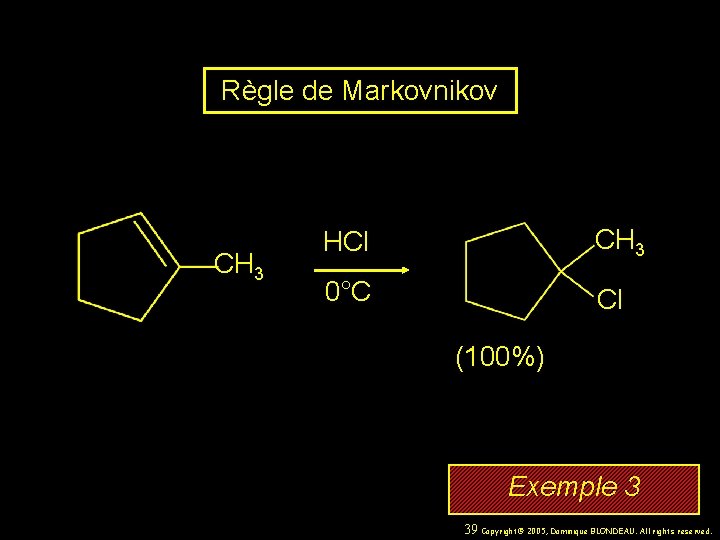
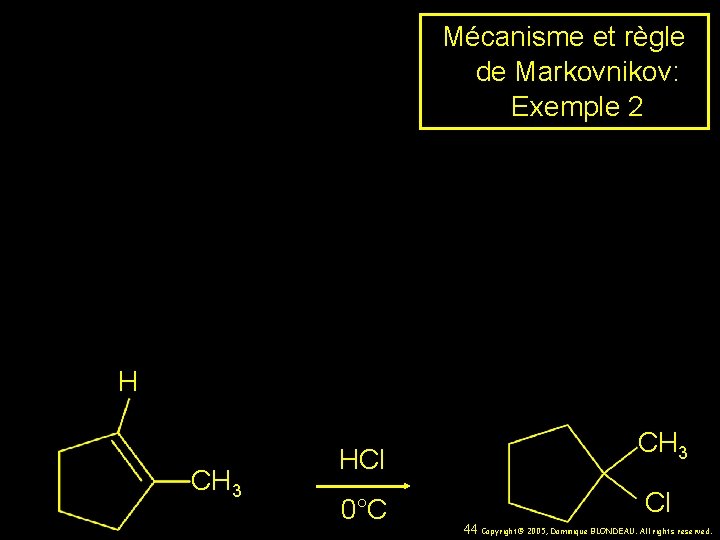
Règle de Markovnikov CH 3 HCl CH 3 0°C Cl (100%) Exemple 3 39 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

11. 23 Mécanisme et règle de Markovnikov La protonation de la double liaison se produit selon un mécanisme qui conduit aux intermédiaires carbocations les plus stables. 40 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

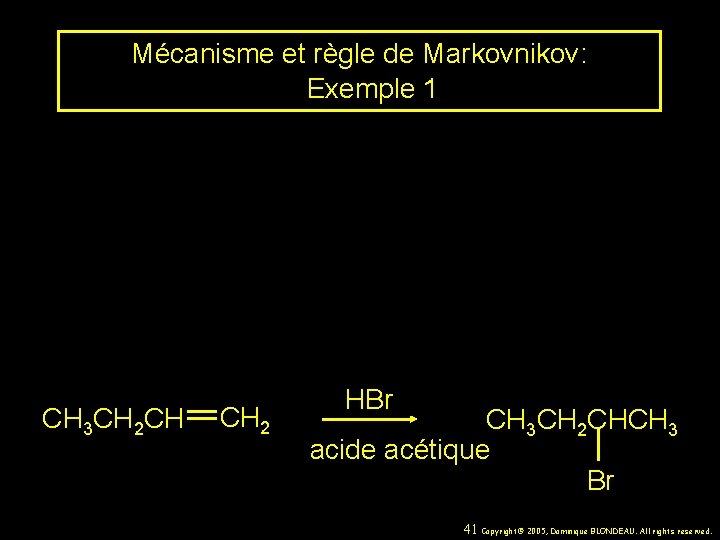
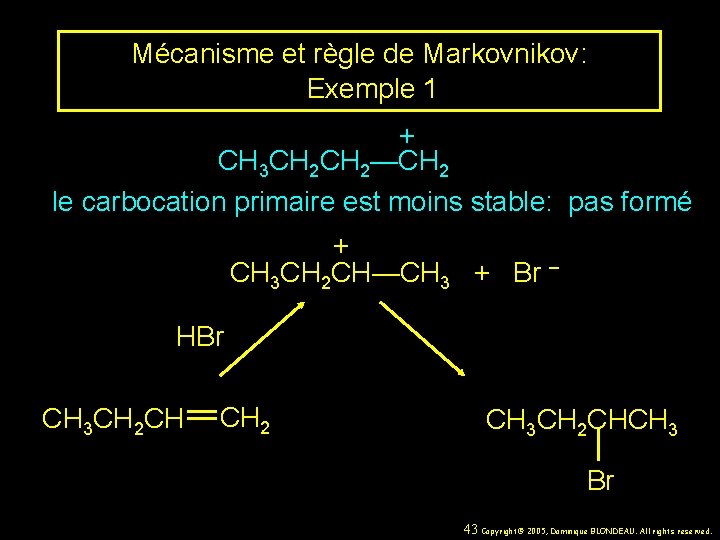
Mécanisme et règle de Markovnikov: Exemple 1 CH 3 CH 2 CH CH 2 HBr CH 3 CH 2 CHCH 3 acide acétique Br 41 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

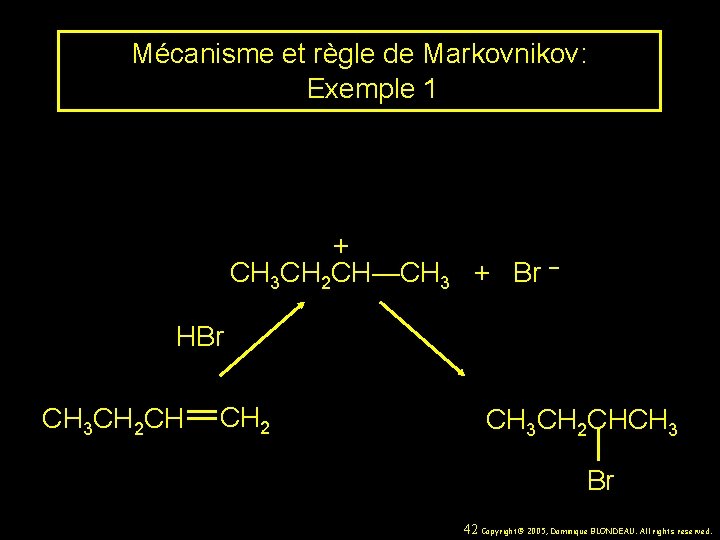
Mécanisme et règle de Markovnikov: Exemple 1 + CH 3 CH 2 CH—CH 3 + Br – HBr CH 3 CH 2 CH CH 2 CH 3 CH 2 CHCH 3 Br 42 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

Mécanisme et règle de Markovnikov: Exemple 1 + CH 3 CH 2—CH 2 le carbocation primaire est moins stable: pas formé + CH 3 CH 2 CH—CH 3 + Br – HBr CH 3 CH 2 CH CH 2 CH 3 CH 2 CHCH 3 Br 43 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

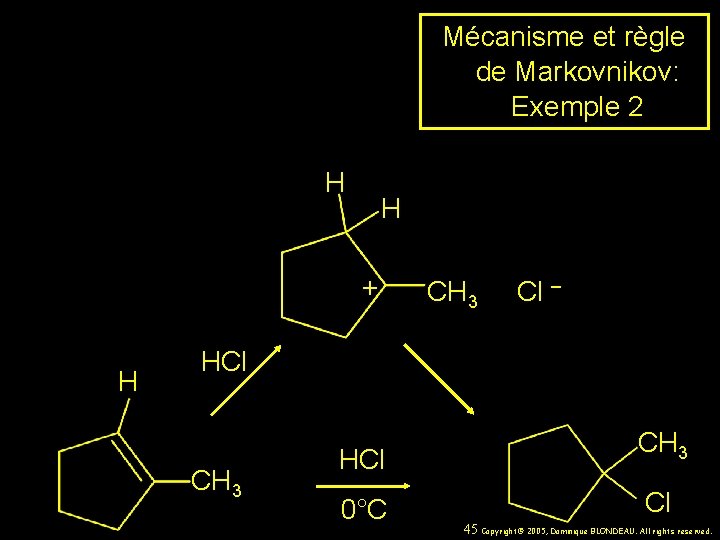
Mécanisme et règle de Markovnikov: Exemple 2 H CH 3 HCl CH 3 0°C Cl 44 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

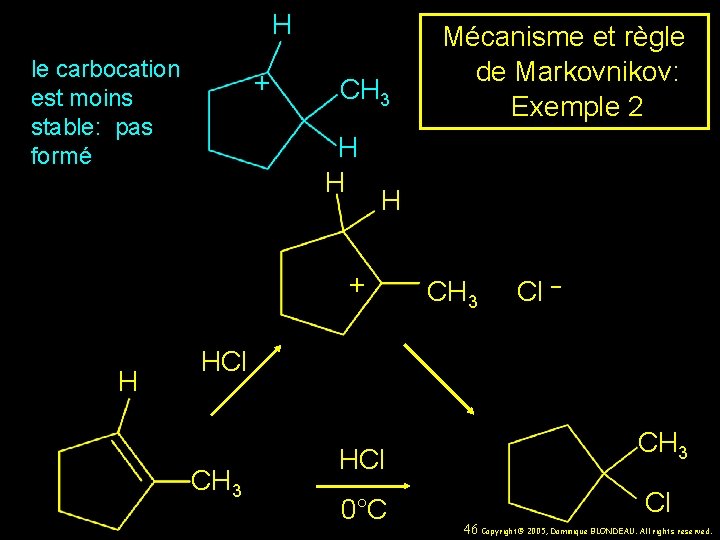
Mécanisme et règle de Markovnikov: Exemple 2 H H + H CH 3 Cl – HCl CH 3 0°C Cl 45 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

H le carbocation est moins stable: pas formé + CH 3 H H H + H Mécanisme et règle de Markovnikov: Exemple 2 CH 3 Cl – HCl CH 3 0°C Cl 46 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

11. 24 Réarrangements de Carbocations dans les Additions d’halogénures d’hydrogène aux Alcènes 47 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

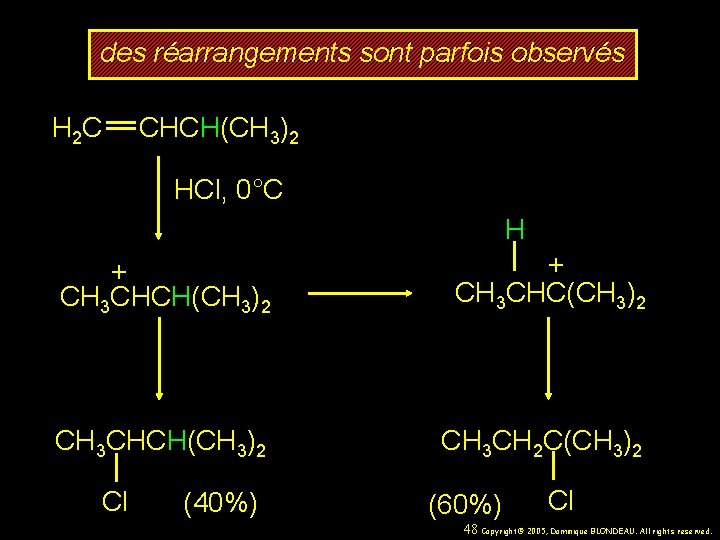
des réarrangements sont parfois observés H 2 C CHCH(CH 3)2 HCl, 0°C H + CH 3 CHCH(CH 3)2 + CH 3 CHC(CH 3)2 CH 3 CHCH(CH 3)2 CH 3 CH 2 C(CH 3)2 Cl (40%) (60%) Cl 48 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

11. 25 Addition radicalaire de HBr aux Alcènes L’ effet « peroxyde » ou effet Karash 49 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

Règle de Markovnikov CH 3 CH 2 CH CH 2 HBr acide acétique CH 3 CH 2 CHCH 3 Br (80%) Exemple 1 50 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

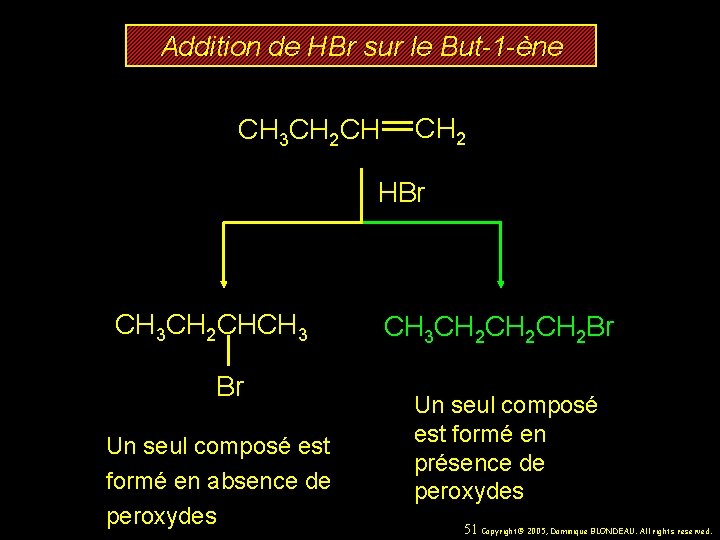
Addition de HBr sur le But-1 -ène CH 3 CH 2 CH CH 2 HBr CH 3 CH 2 CHCH 3 Br Un seul composé est formé en absence de peroxydes CH 3 CH 2 CH 2 Br Un seul composé est formé en présence de peroxydes 51 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

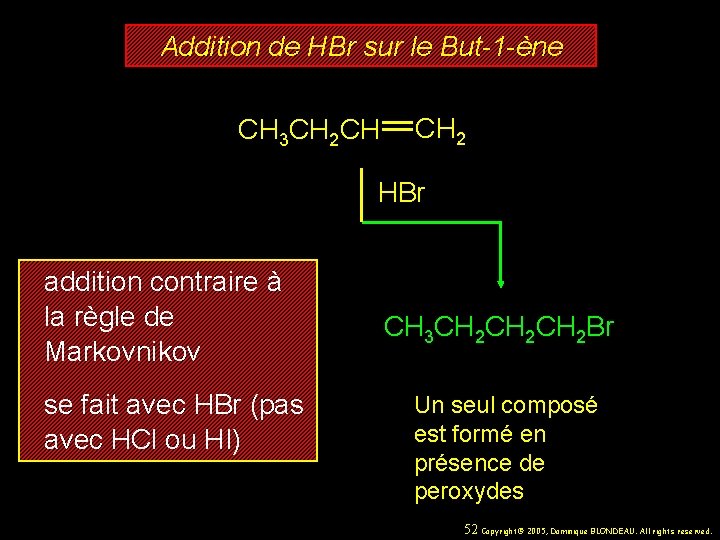
Addition de HBr sur le But-1 -ène CH 3 CH 2 CH CH 2 HBr addition contraire à la règle de Markovnikov se fait avec HBr (pas avec HCl ou HI) CH 3 CH 2 CH 2 Br Un seul composé est formé en présence de peroxydes 52 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

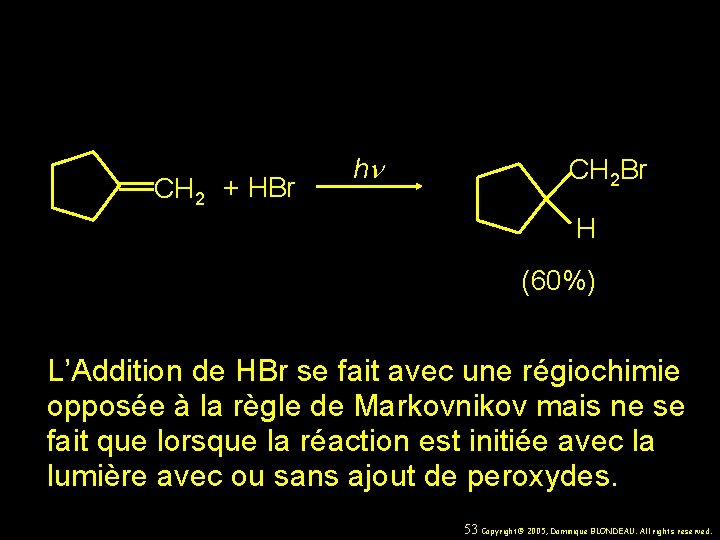
CH 2 + HBr hn CH 2 Br H (60%) L’Addition de HBr se fait avec une régiochimie opposée à la règle de Markovnikov mais ne se fait que lorsque la réaction est initiée avec la lumière avec ou sans ajout de peroxydes. 53 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

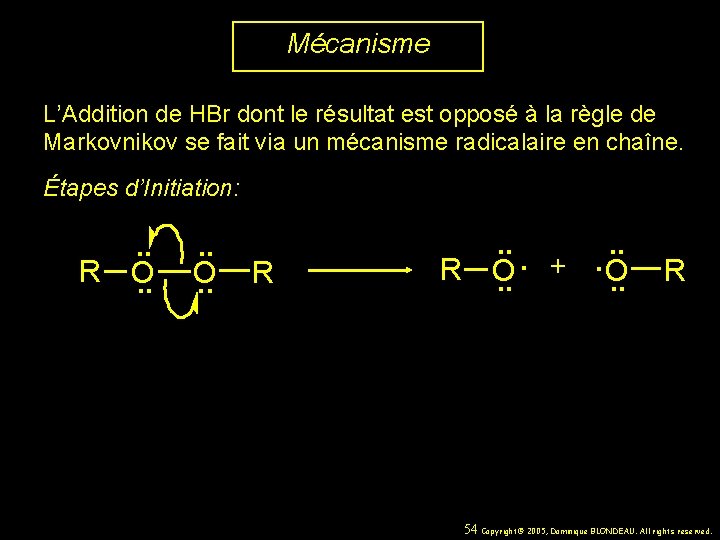
Mécanisme L’Addition de HBr dont le résultat est opposé à la règle de Markovnikov se fait via un mécanisme radicalaire en chaîne. Étapes d’Initiation: R . . O. . R R . . . +. O O. . R 54 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

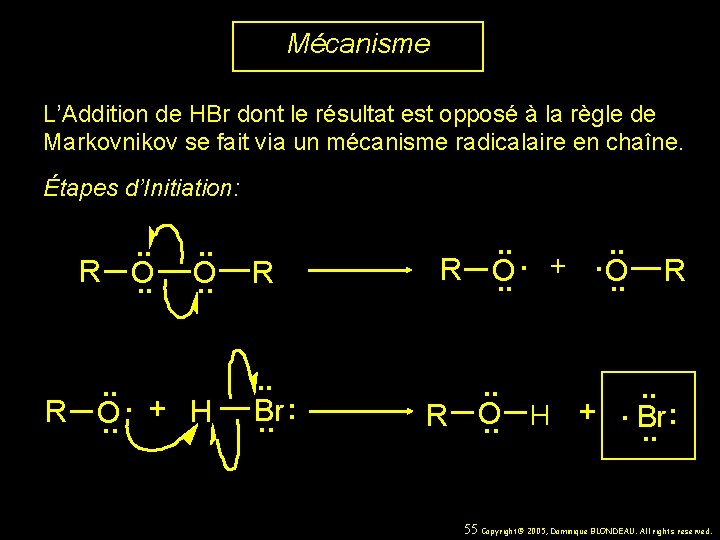
Mécanisme L’Addition de HBr dont le résultat est opposé à la règle de Markovnikov se fait via un mécanisme radicalaire en chaîne. Étapes d’Initiation: R . . O. . R R . . . +. O O. . R R . . : Br. . . + H O. . R . . . + : O H Br. . 55 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

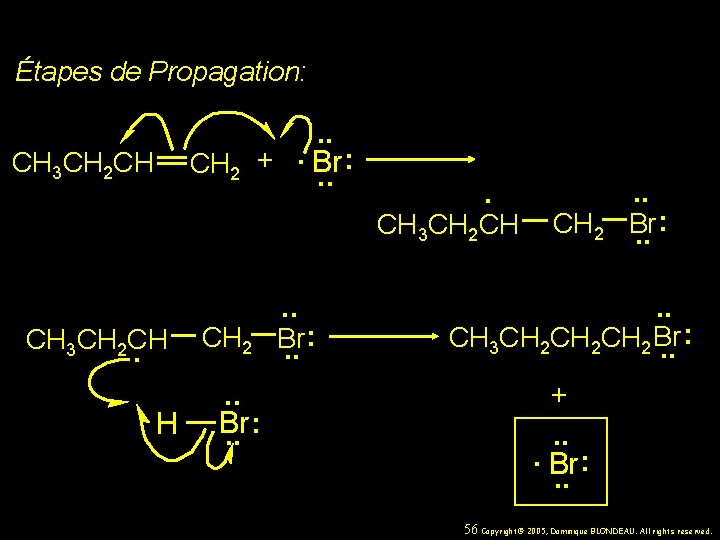
Étapes de Propagation: . . : CH 2 +. Br. . CH 3 CH 2 CH. H CH 2 . . Br. . : . CH 3 CH 2 CH CH 2 . . : Br. . CH 3 CH 2 CH 2 Br. . : + . . . Br : . . 56 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

11. 26 Addition d’Acide Sulfurique sur les Alcènes 57 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

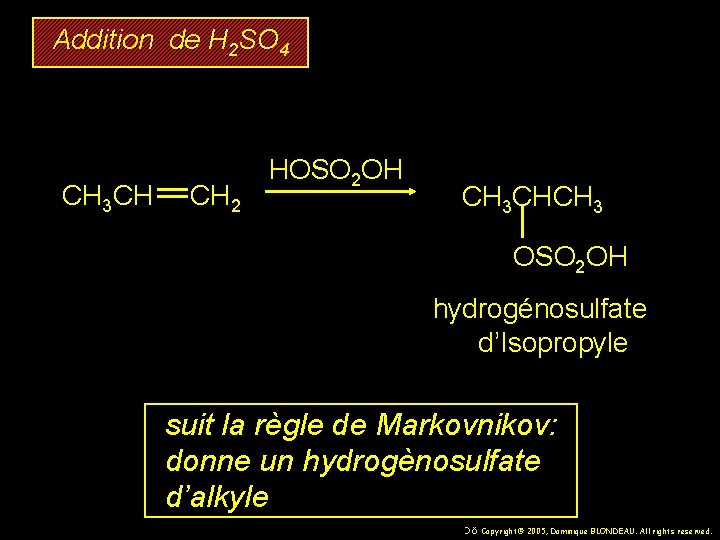
Addition de H 2 SO 4 CH 3 CH CH 2 HOSO 2 OH CH 3 CHCH 3 OSO 2 OH hydrogénosulfate d’Isopropyle suit la règle de Markovnikov: donne un hydrogènosulfate d’alkyle 58 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

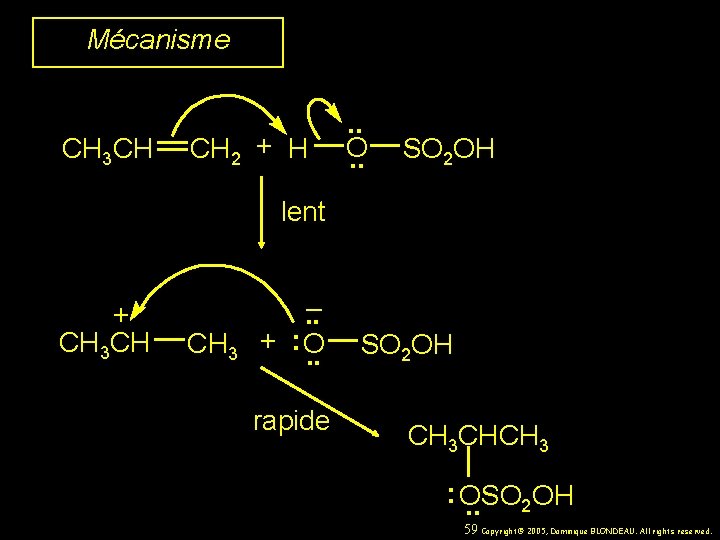
Mécanisme CH 3 CH CH 2 + H . . O. . SO 2 OH lent + CH 3 CH CH 3 . . – + : O. . rapide SO 2 OH CH 3 CHCH 3 : OSO. . 2 OH 59 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

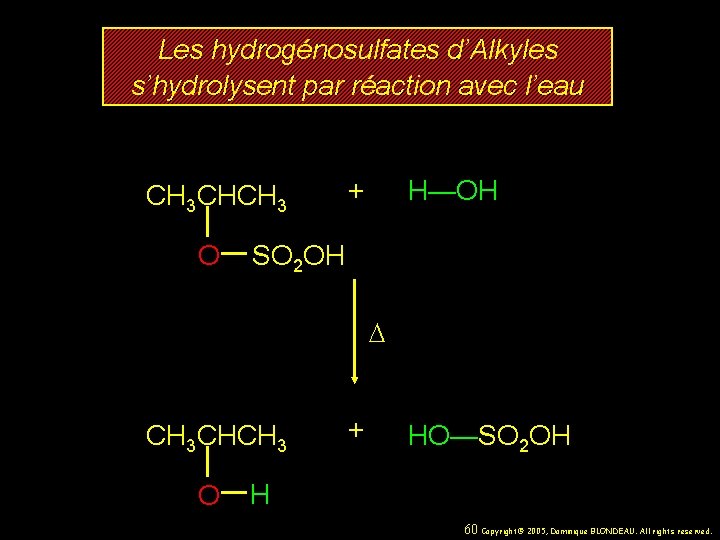
Les hydrogénosulfates d’Alkyles s’hydrolysent par réaction avec l’eau CH 3 CHCH 3 O + H—OH SO 2 OH D CH 3 CHCH 3 O + HO—SO 2 OH H 60 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

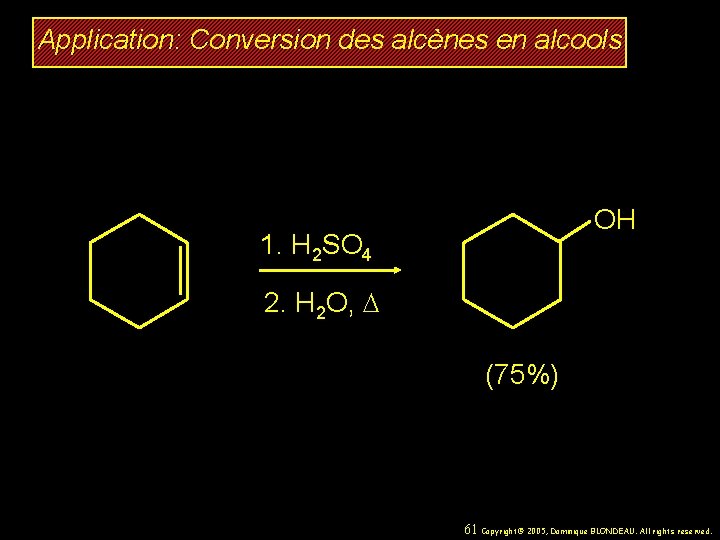
Application: Conversion des alcènes en alcools OH 1. H 2 SO 4 2. H 2 O, D (75%) 61 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

Mais. . . tous les alcènes ne donnent pas des hydrogénosulfates d’alkyles par réaction avec l’acide sulfurique formation avec: H 2 C=CH 2, RCH=CH 2, et RCH=CHR' pas de formation avec: R 2 C=CH 2, et R 2 C=CR 2 62 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

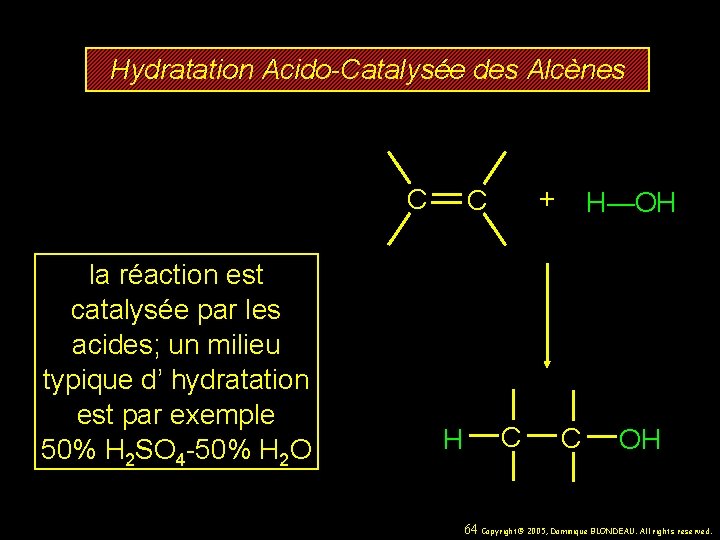
11. 27 Hydratation Acido-Catalysée des Alcènes 63 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

Hydratation Acido-Catalysée des Alcènes C la réaction est catalysée par les acides; un milieu typique d’ hydratation est par exemple 50% H 2 SO 4 -50% H 2 O + C H—OH C OH 64 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

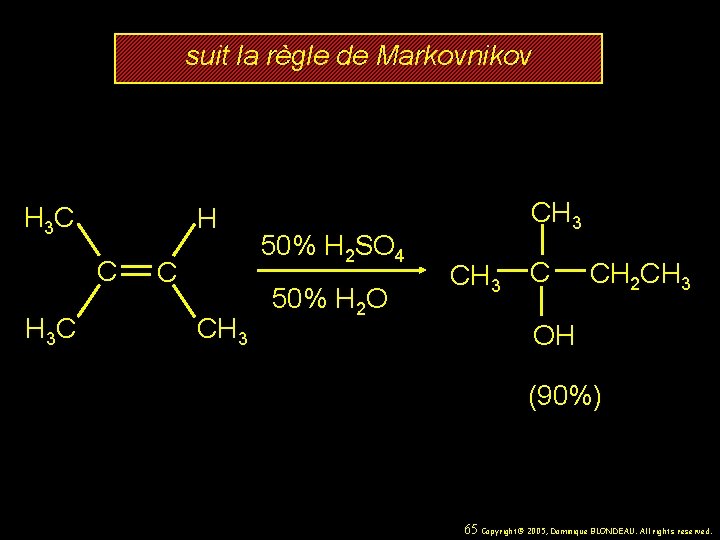
suit la règle de Markovnikov H 3 C C CH 3 50% H 2 SO 4 50% H 2 O CH 3 C CH 2 CH 3 OH (90%) 65 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

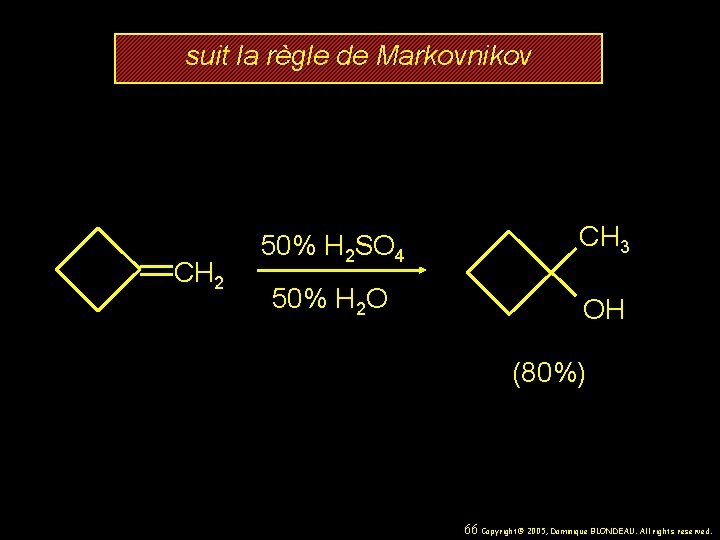
suit la règle de Markovnikov CH 2 50% H 2 SO 4 CH 3 50% H 2 O OH (80%) 66 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

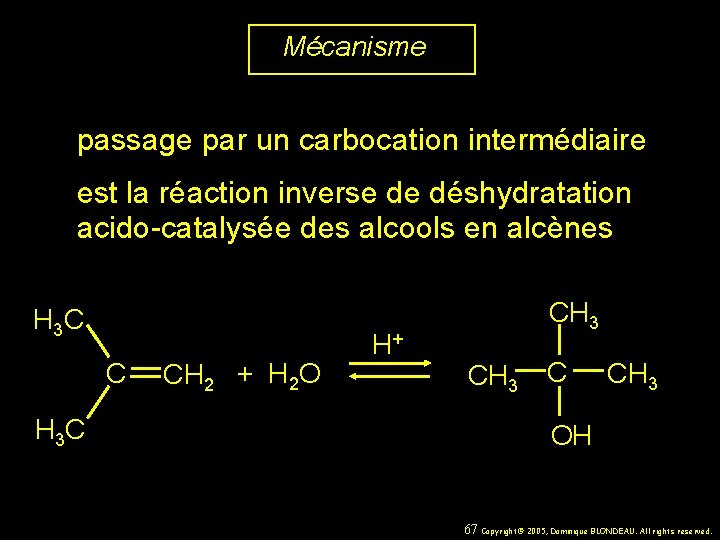
Mécanisme passage par un carbocation intermédiaire est la réaction inverse de déshydratation acido-catalysée des alcools en alcènes H 3 C CH 2 + H 2 O H+ CH 3 C CH 3 OH 67 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

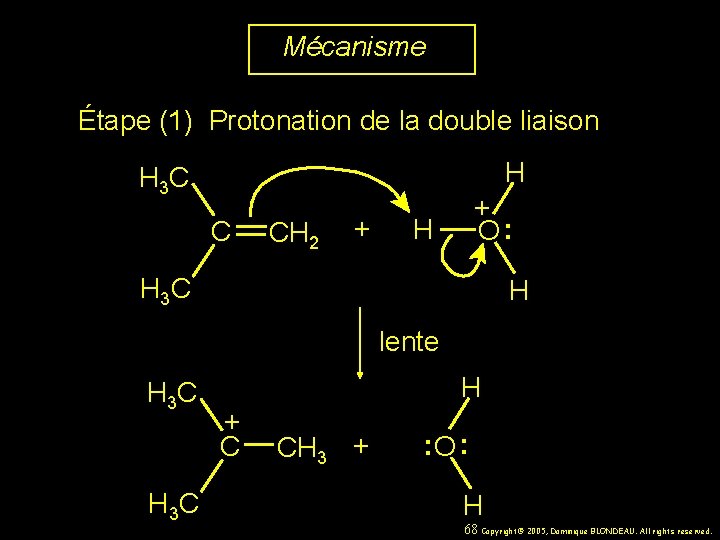
Mécanisme Étape (1) Protonation de la double liaison H H 3 C C CH 2 + + O : H H 3 C H lente H 3 C H + C CH 3 + : O : H 68 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

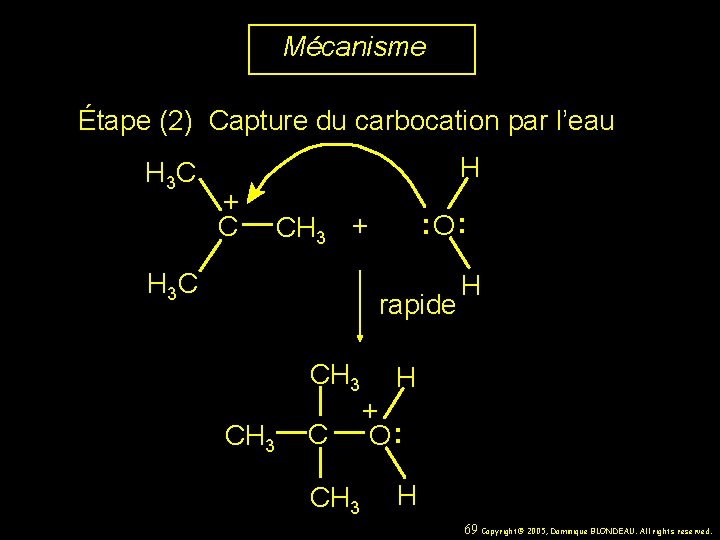
Mécanisme Étape (2) Capture du carbocation par l’eau H 3 C H + C : O : CH 3 + H 3 C rapide CH 3 C CH 3 H H + O : H 69 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

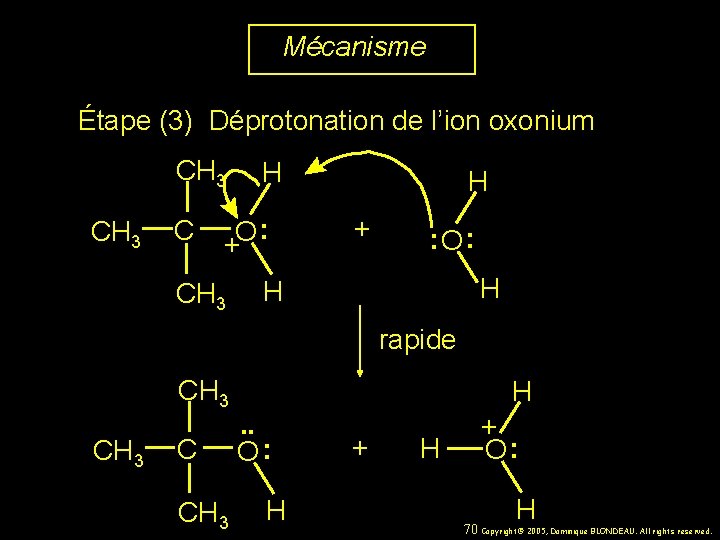
Mécanisme Étape (3) Déprotonation de l’ion oxonium CH 3 C H : O + CH 3 H + : O : H H rapide CH 3 C CH 3 H. . O : H + O : H 70 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

Vitesses Relatives Hydratation Acido-catalysée éthylène CH 2=CH 2 1. 0 propène CH 3 CH=CH 2 1. 6 x 106 2 -méthylpropène (CH 3)2 C=CH 2 2. 5 x 1011 Plus stable est le carbocation, plus rapide est sa formation, et plus la réaction est rapide. 71 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

11. 28 Hydroboration-Oxydation des Alcènes 72 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

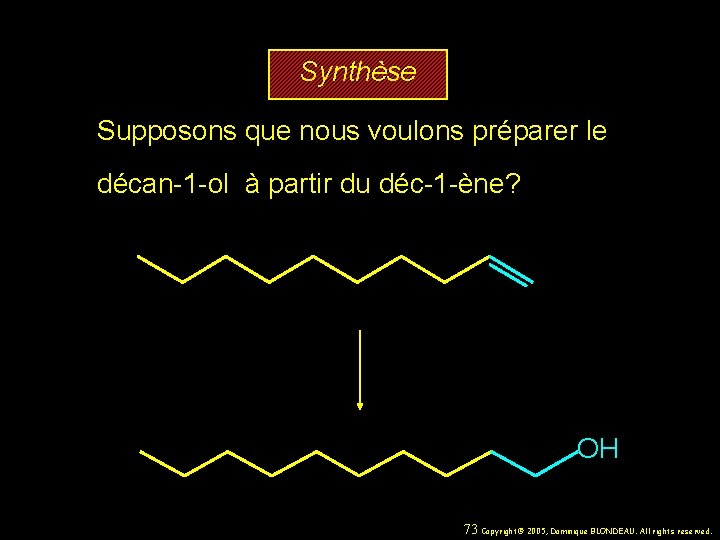
Synthèse Supposons que nous voulons préparer le décan-1 -ol à partir du déc-1 -ène? OH 73 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

Synthèse Supposons que nous voulons préparer le décan-1 -ol à partir du déc-1 -ène? Nous avons besoin d’une méthode d’hydratation des alcènes qui réagit de façon régiosélective et opposée à la règle de Markovnikov. OH 74 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

Synthèse On utilisera une séquence réactionnelle appelée hydroborationoxydation qui convertit les alcènes en alcools avec une régiochimie opposée à la règle de Markovnikov. 1. hydroboration 2. oxydation OH 75 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

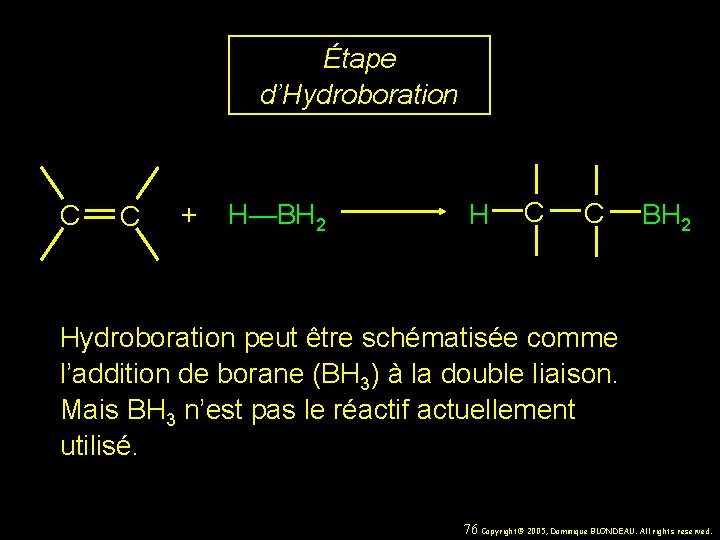
Étape d’Hydroboration C C + H—BH 2 H C C BH 2 Hydroboration peut être schématisée comme l’addition de borane (BH 3) à la double liaison. Mais BH 3 n’est pas le réactif actuellement utilisé. 76 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

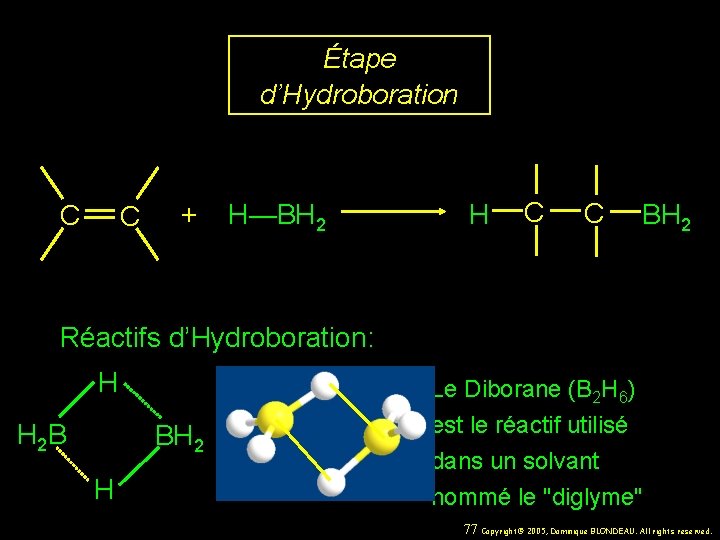
Étape d’Hydroboration C C + H—BH 2 H C C BH 2 Réactifs d’Hydroboration: H H 2 B BH 2 H Le Diborane (B 2 H 6) est le réactif utilisé dans un solvant nommé le "diglyme" 77 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

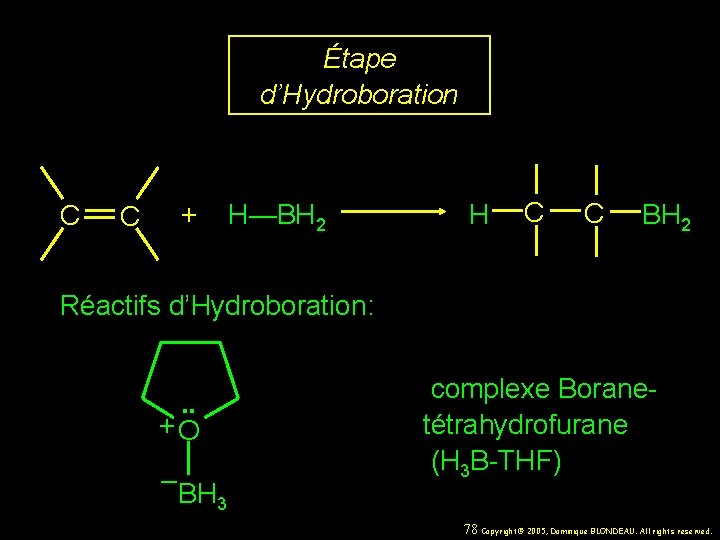
Étape d’Hydroboration C + H—BH 2 C H C C BH 2 Réactifs d’Hydroboration: . . +O – BH 3 complexe Boranetétrahydrofurane (H 3 B-THF) 78 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

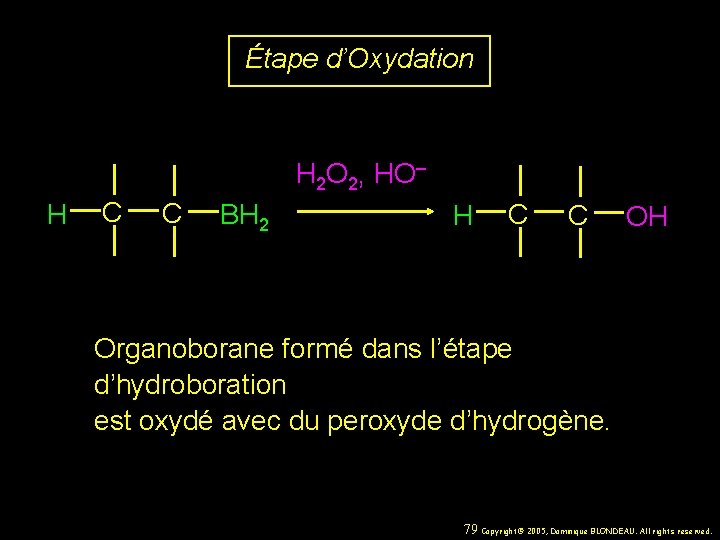
Étape d’Oxydation H 2 O 2, HO– H C C BH 2 H C C OH Organoborane formé dans l’étape d’hydroboration est oxydé avec du peroxyde d’hydrogène. 79 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

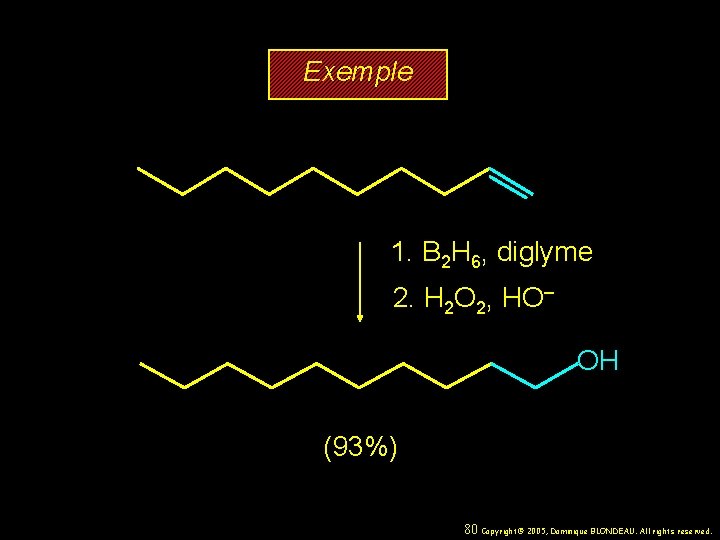
Exemple 1. B 2 H 6, diglyme 2. H 2 O 2, HO– OH (93%) 80 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

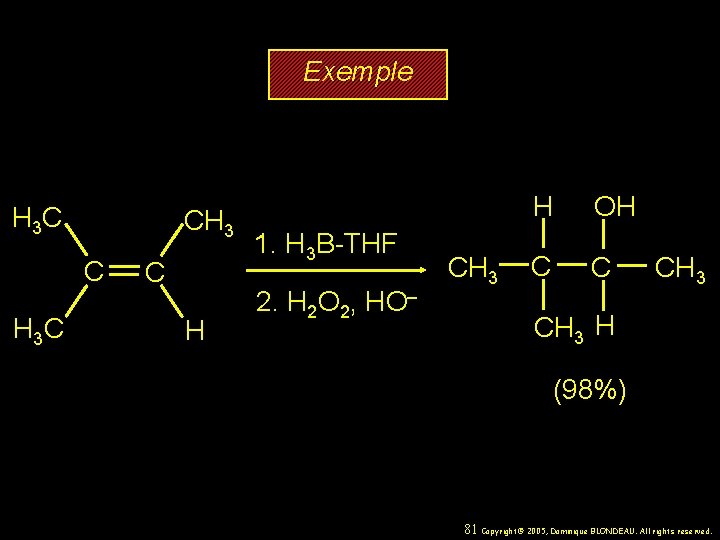
Exemple H 3 C CH 3 C H 3 C C H 1. H 3 B-THF 2. H 2 O 2, HO– CH 3 H OH C C CH 3 H (98%) 81 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

Conclusions sur l’hydroboration-oxydation hydratation des alcènes régiosélectivité opposée à la règle de Markovnikov pas de réarrangement addition stéréospécifique syn 82 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

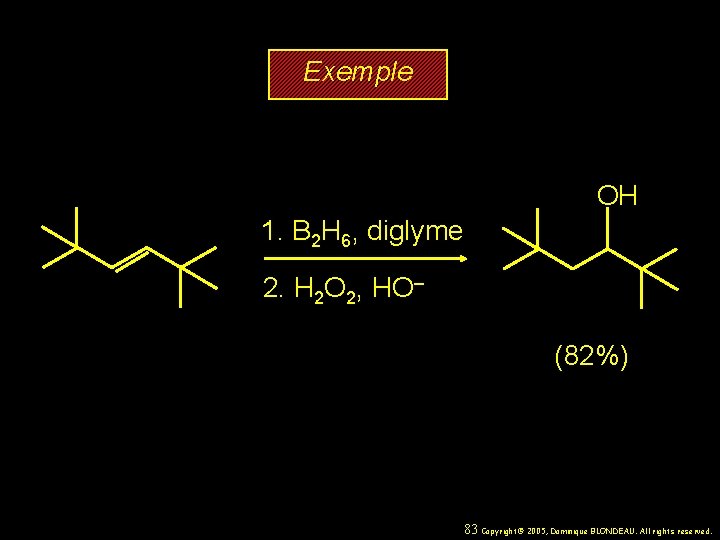
Exemple OH 1. B 2 H 6, diglyme 2. H 2 O 2, HO– (82%) 83 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

11. 29 Stéréochimie de la réaction d’Hydroboration-Oxydation 84 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

Conclusions sur l’hydroboration-oxydation hydratation des alcènes régiosélectivité opposée à la règle de Markovnikov pas de réarrangement addition stéréospécifique syn 85 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

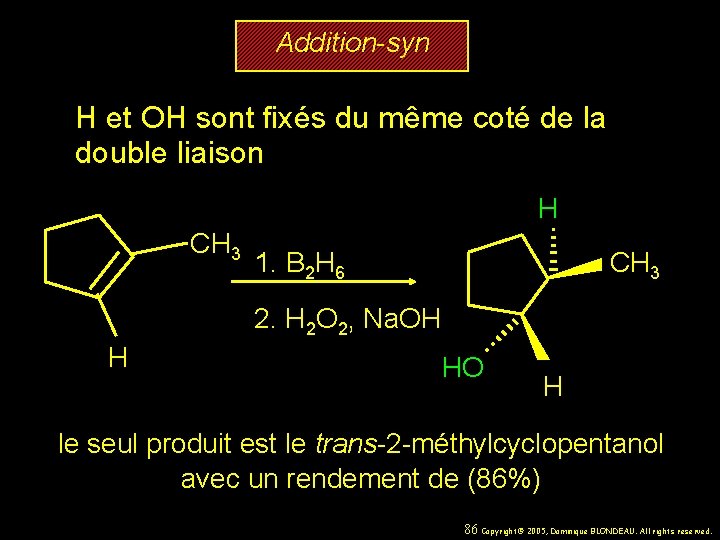
Addition-syn H et OH sont fixés du même coté de la double liaison H CH 3 1. B 2 H 6 CH 3 2. H 2 O 2, Na. OH H HO H le seul produit est le trans-2 -méthylcyclopentanol avec un rendement de (86%) 86 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

11. 30 Mécanisme d’Hydroboration-Oxydation 87 Copyright© 2005, Dominique BLONDEAU. All rights reserved.

Mécanisme d’Hydroboration-Oxydation Le mécanisme d’hydroboration et oxydation par H 2 O 2 ne sera pas détaillé car non demandé lors de questions d’examens. A retenir toutefois: - addition syn de H et de BH 2 sur la double liaison - BH 2 s’additionne du côté du carbone le moins substitué - OH s’introduit du même côté que BH 2 Le mécanisme fait intervenir l’addition de H- et de BH 2+ 88 Copyright© 2005, Dominique BLONDEAU. All rights reserved.
 Profil réactionnel
Profil réactionnel Des des des
Des des des Cartographie des flux
Cartographie des flux La diffusion des idées des lumières
La diffusion des idées des lumières Budget des ventes
Budget des ventes Diversification des espaces et des acteurs de la production
Diversification des espaces et des acteurs de la production Je t'offrirai des fleurs et des nappes en couleurs
Je t'offrirai des fleurs et des nappes en couleurs Il existe des personnes qui sont des lumières pour tous
Il existe des personnes qui sont des lumières pour tous Volume d'un corps
Volume d'un corps Robin des bois des alpes
Robin des bois des alpes Modes temps et valeurs
Modes temps et valeurs Volume des liquides et des solides
Volume des liquides et des solides Triple des attack
Triple des attack Affiche de propagande plan marshall
Affiche de propagande plan marshall Habits des paysans au moyen age
Habits des paysans au moyen age Ouverture des magasins
Ouverture des magasins Tableau dixième centième
Tableau dixième centième Ifsi des hus
Ifsi des hus Besoins non fonctionnels exemples
Besoins non fonctionnels exemples Tomate maladie
Tomate maladie Mall de pott
Mall de pott Traitement des objections vente
Traitement des objections vente Musikkoffer sachsen-anhalt
Musikkoffer sachsen-anhalt Chaine de transport des électrons
Chaine de transport des électrons Polygone des ecc
Polygone des ecc Aufbau eines regenwurms
Aufbau eines regenwurms Grundlagen des schnell - lesen - peter rösler
Grundlagen des schnell - lesen - peter rösler Digestion des lipides
Digestion des lipides Calepin des nombres mhm
Calepin des nombres mhm Why were there no coureurs des bois before 1663
Why were there no coureurs des bois before 1663 Quantitätsgesetz des trainings
Quantitätsgesetz des trainings Lagrangien microéconomie
Lagrangien microéconomie Das leben ist eine zugfahrt
Das leben ist eine zugfahrt Classification des zoonoses
Classification des zoonoses Classification des potages
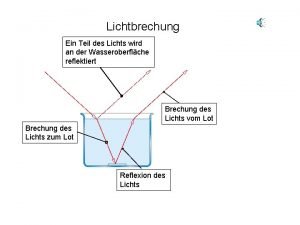
Classification des potages Teil des lichts
Teil des lichts Platre clavicule
Platre clavicule Sculpture ondine sortant des eaux
Sculpture ondine sortant des eaux Tableau de conversion t q
Tableau de conversion t q Musee des beaux arts analysis
Musee des beaux arts analysis Brevet des colleges
Brevet des colleges Grammatische kategorien des substantivs
Grammatische kategorien des substantivs Geschichte des jazz
Geschichte des jazz Il y aura toujours des pauvres parmi vous
Il y aura toujours des pauvres parmi vous Pour cet immense bonheur alléluia
Pour cet immense bonheur alléluia Proverbios 23 4
Proverbios 23 4 Les pronoms tableau
Les pronoms tableau Cmup
Cmup 10
10 Matrice des dépendances fonctionnelles
Matrice des dépendances fonctionnelles Prädikat
Prädikat Cursus honorum
Cursus honorum Les étapes de la visite à domicile
Les étapes de la visite à domicile Differenciation verticale et horizontale des produits
Differenciation verticale et horizontale des produits Kangourou 2017
Kangourou 2017 Donnez-moi des noms
Donnez-moi des noms La nature nous fournit elle des outils
La nature nous fournit elle des outils Les pronoms interrogatifs variables
Les pronoms interrogatifs variables Kostenstellenrechnung gleichungsverfahren
Kostenstellenrechnung gleichungsverfahren La planification des apprentissages
La planification des apprentissages French east india company
French east india company Ti-jacques la guerre des tuques
Ti-jacques la guerre des tuques Gestion centralisée des lits et places
Gestion centralisée des lits et places Pluriel jour de la semaine
Pluriel jour de la semaine Union amicale des maires du calvados
Union amicale des maires du calvados Lambert beersches gesetz
Lambert beersches gesetz Syndrome de galates
Syndrome de galates Feuille rousse feuille folle
Feuille rousse feuille folle Pays d'afrique du nord
Pays d'afrique du nord Ordre des tubes de prélèvement
Ordre des tubes de prélèvement Classification des formations sanitaires au cameroun
Classification des formations sanitaires au cameroun La grande plaine est blanche immobile et sans voix
La grande plaine est blanche immobile et sans voix Genitivobjekt beispielsatz
Genitivobjekt beispielsatz Je lis des syllabes
Je lis des syllabes Les causes des conflits interpersonnels
Les causes des conflits interpersonnels Tunisie clearing
Tunisie clearing Haw.international daad
Haw.international daad Décomposition des aliments
Décomposition des aliments College emile zola prahecq
College emile zola prahecq Tipos de soluciones
Tipos de soluciones Kognitive triade
Kognitive triade Marché des capitaux schéma
Marché des capitaux schéma Couleurs qui sont des choses
Couleurs qui sont des choses Analyseur la texture des aliments
Analyseur la texture des aliments Feigenblatt des absolutismus
Feigenblatt des absolutismus Vendre ses photos sur internet
Vendre ses photos sur internet Traçabilité des soins infirmiers législation
Traçabilité des soins infirmiers législation Changement de base matrice
Changement de base matrice Des personnages insolites
Des personnages insolites