Les ractions chimiques m Rotan Mohamed Les ractions

















- Slides: 24

Les réactions chimiques m. Rotan Mohamed

Les réactions chimiques �c'est la brisure des liaisons qui se trouvent dans les molécules des réactifs et formation de nouvelles liaisons dans les molécules des produits. m. Rotan Mohamed

Les réactions chimiques diffèrent selon les opérations qui ont lieu m. Rotan Mohamed

Les réactions de décomposition thermique Par la chaleur m. Rotan Mohamed

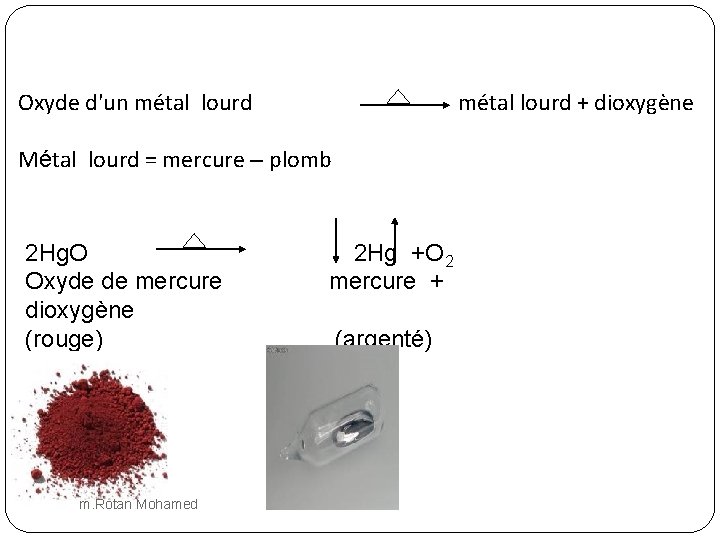
Oxyde d'un métal lourd + dioxygène Métal lourd = mercure – plomb 2 Hg. O Oxyde de mercure dioxygène (rouge) m. Rotan Mohamed 2 Hg +O 2 mercure + (argenté)

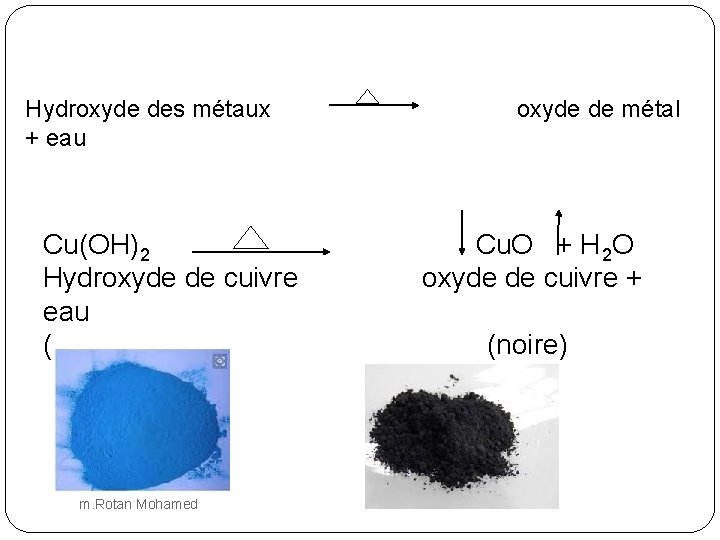
Hydroxyde des métaux + eau Cu(OH)2 Hydroxyde de cuivre eau (bleue) m. Rotan Mohamed oxyde de métal Cu. O + H 2 O oxyde de cuivre + (noire)

Carbonate de métal Cu. CO 3 Carbonate de cuivre carbone (verte) m. Rotan Mohamed oxyde de métal + dioxyde de carbone Cu. O + CO 2 dioxyde de

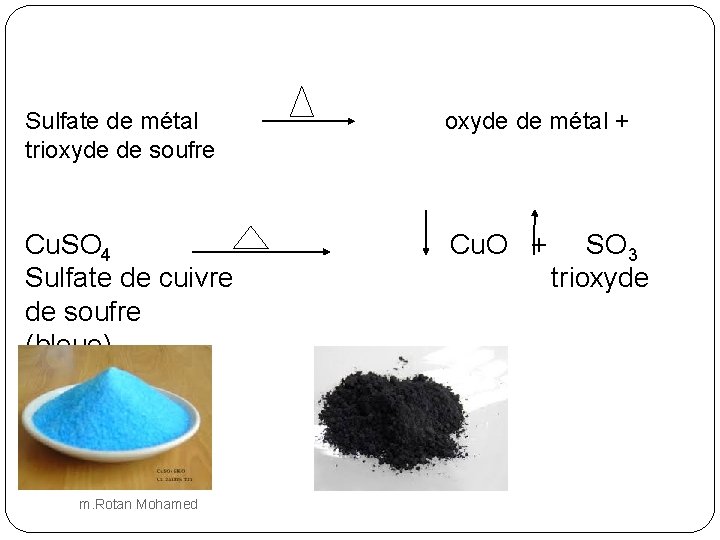
Sulfate de métal trioxyde de soufre oxyde de métal + Cu. SO 4 Sulfate de cuivre de soufre (bleue) Cu. O + m. Rotan Mohamed SO 3 trioxyde

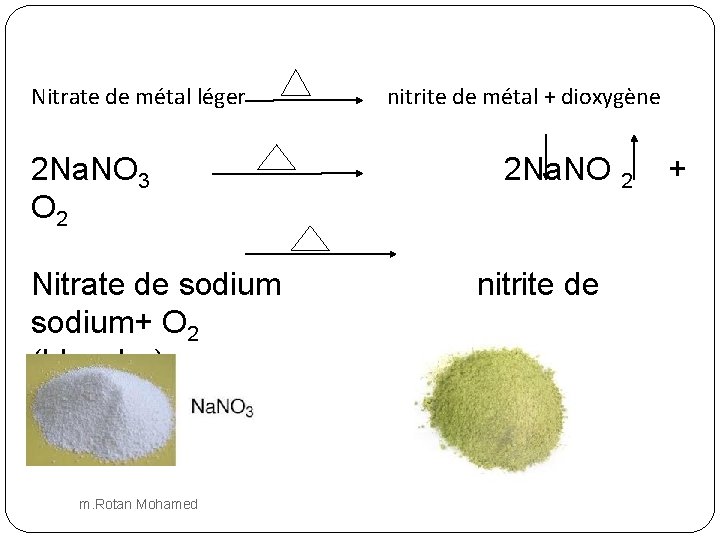
Nitrate de métal léger 2 Na. NO 3 O 2 Nitrate de sodium+ O 2 (blanche) jaunâtre) m. Rotan Mohamed nitrite de métal + dioxygène 2 Na. NO nitrite de (blanc 2 +

Les réactions de substitution ont lieu quand un élément actif substitue un autre élément moins actif dans un autre composé m. Rotan Mohamed

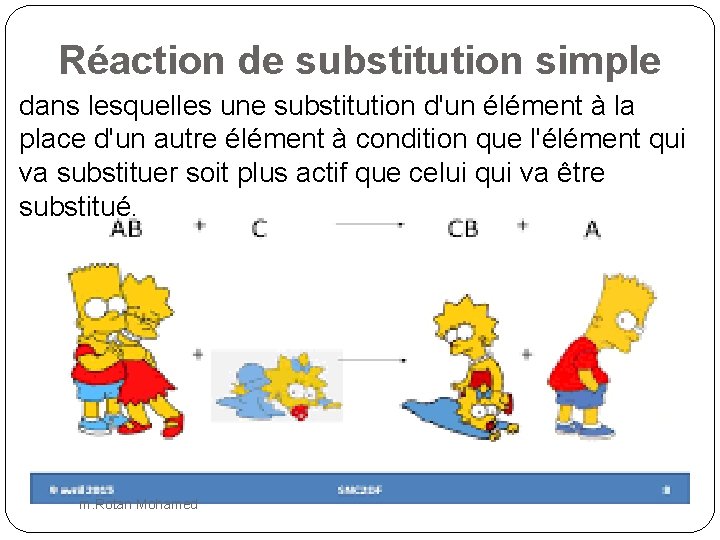
Réaction de substitution simple dans lesquelles une substitution d'un élément à la place d'un autre élément à condition que l'élément qui va substituer soit plus actif que celui qui va être substitué. m. Rotan Mohamed

La série électrochimique : c'est l'ordre décroissant des métaux selon leur activité chimique. Al m. Rotan Mohamed Zn Fe Sn Pb H Cu Hg Ag Pt Au argent platine or Mg zinc fer étain plomb hydrogèn e cuivre mercure Na Ba Ca barium calcium magnésiu m aluminium K Lithium Potassiu m sodium Li

Les éléments qui précèdent l'hydrogène dans la série substituent l'hydrogène dans les acides tandis que les éléments qui suivent l'hydrogène dans la série ne substituent pas l'hydrogène dans les acides que dans certaines conditions chimiques spéciales. m. Rotan Mohamed

La substitution de l'hydrogène de l'eau par un métal La réaction de l'eau avec le sodium 2 Na + 2 H 2 O 2 Na. OH + H 2 +chaleur m. Rotan Mohamed

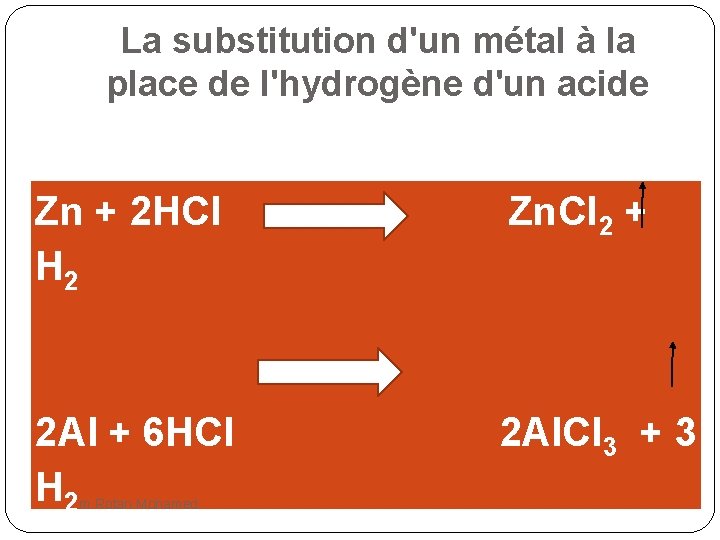
La substitution d'un métal à la place de l'hydrogène d'un acide Zn + 2 HCl H 2 Zn. Cl 2 + 2 Al + 6 HCl H 2 2 Al. Cl 3 + 3 m. Rotan Mohamed

La substitution d'un métal à la place d'un autre dans la solution d'une de ses sels Mg + Cu. SO 4 Cu m. Rotan Mohamed Mg. SO 4 +

Réactions de substitution réciproque (double échange) � dans lesquelles une substitution réciproque entre les deux ions de deux composés pour obtenir deux nouveaux composés. m. Rotan Mohamed

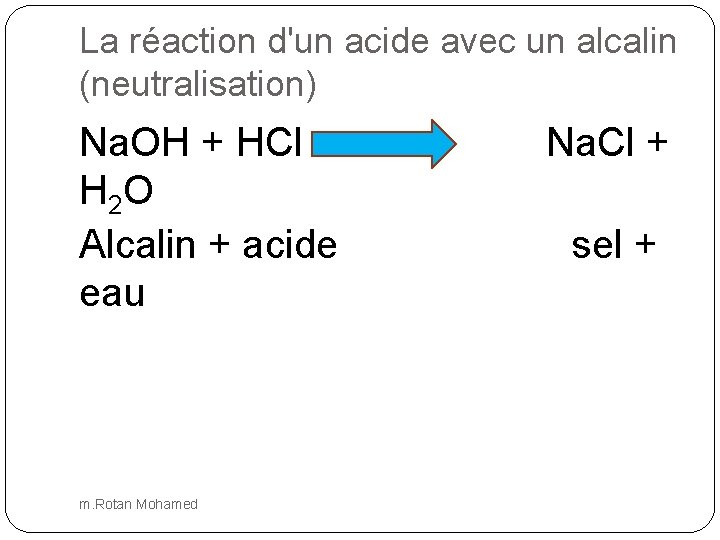
La réaction d'un acide avec un alcalin (neutralisation) Na. OH + HCl H 2 O Alcalin + acide eau m. Rotan Mohamed Na. Cl + sel +

La réaction d'un acide avec un sel Na 2 CO 3 + 2 HCl H 2 O+CO 2 2 Na. Cl + L'acide chlorhydrique réagit avec le carbonate de sodium et il se forme le chlorure de sodium, de l'eau et le dioxyde de carbone qui m. Rotan Mohamed

La réaction d'un sel avec un autre Na. Cl +Ag. NO 3 Na. NO 3 + Ag. Cl En ajoutant une solution de nitrate d'argent à une solution de chlorure de sodium, il se forme un précipité blanc de chlorure m. Rotan Mohamed

L'oxydation et la réduction �Les opérations de d'oxydation et de réduction sont concomitants et ont lieu en même temps m. Rotan Mohamed

De point de vue de l'oxygène H 2 + Cu. O Cu+H 2 En faisant passer le gaz hydrogène sur l'oxyde de cuivre chauffé, l'hydrogène arrache l'oxygène de l'oxyde de cuivre et il se forme de l'eau et l'oxyde de cuivre se. L'oxydation transforme en cuivre La réduction C'est l'opération chimique qui provoque l'augmentation du provoque la diminution du taux de l'oxygène dans la matière L'agent oxydant : c'est la L'agent réducteur : c'est la matière qui donne l'oxygène matière qui arrache l'oxygène m. Rotan Mohamed Cu. O = agent oxydant H 2 = agent reducteur

De point de vue de l’hydrogène L'oxydation La réduction C'est l'opération chimique qui provoque le qui provoque manque de l'hydrogène l'augmentation du taux de dans la matière l'hydrogène dans la matière. L'agent oxydant : c'est la L'agent réducteur : c'est matière qui arrache la matière qui donne l'hydrogène durant la réaction chimique m. Rotan Mohamed

De point de vue de l'électron L'oxydation C'est une opération chimique durant laquelle l'atome de l'élément perd un ou plusieurs électrons 2 Na 2 Na+ + 2 e 11 Na (2. 8. 1) L'atome de sodium s'est transformé en ion de sodium L'atome de sodium a perdu un seul électron et s'est transformé d'un atome neutre en ion sodium positif cette opération est nommé oxydation Le métal effectue l'opération de l'oxydation L'agent oxydant : C'est la matière m. Rotan Mohamed qui gagne un ou plusieurs électrons La réduction C'est une opération chimique durant laquelle l'atome de l'élément gagne un ou plusieurs électrons. Cl 2 + 2 e 2 Cl – 17 Cl (2. 8. 7) L'atome de chlore s'est transformé en ion de chlore. L'atome de chlore gagnent un électron et se transforme en ion négatif cette opérations est nommée réduction Le non métal effectue l'opération de la réduction L'agent réducteur : c'est la matière qui perd un ou plusieurs électrons
 Profil réactionnel
Profil réactionnel Phet colorado equilibrer equations chimiques
Phet colorado equilibrer equations chimiques Valence des corps chimiques
Valence des corps chimiques Pollutions chimiques et gestion environnementale.
Pollutions chimiques et gestion environnementale. Tableau des formules chimiques
Tableau des formules chimiques Produits chimiques
Produits chimiques Pantun rangkap
Pantun rangkap Rotan balubuk berasal dari
Rotan balubuk berasal dari Ciri ciri rotan
Ciri ciri rotan Niet-gebroken plastic stoelvorm buymouldsonline.nl
Niet-gebroken plastic stoelvorm buymouldsonline.nl Bahan alam yang memiliki karakteristik
Bahan alam yang memiliki karakteristik Maksud tukang tidak membuang kayu
Maksud tukang tidak membuang kayu Penjodoh bilangan untuk bayam
Penjodoh bilangan untuk bayam Soumia ecrit en arabe
Soumia ecrit en arabe Hassan fareed physics
Hassan fareed physics Dr alboushi
Dr alboushi Mohamed akel
Mohamed akel Yahye mohamed omar
Yahye mohamed omar Lodacain
Lodacain Mohamed younis umbc
Mohamed younis umbc Family tree of hazrat ali
Family tree of hazrat ali Dr mohamed nasr
Dr mohamed nasr Mohamed dahoui
Mohamed dahoui Mohamed zahran nyu
Mohamed zahran nyu Bouhicha mohamed
Bouhicha mohamed