Les quations chimiques Prcipitation Les quations chimiques Ractifs
























































- Slides: 58

Les équations chimiques

Précipitation Les Équations chimiques Réactifs Produits 2 Na. OH + H 2 SO 4 (aq) coéfficient Évaporation Na 2 SO 4 + 2 H 2 réaction formules chimiques indice

Comment balancer une équations? n Part toujours du premier élément a ta gauche et lis vers la droite. n Lorsque l’on fait un changement il faut tout recommencer. n Seulement ajouter un coefficient par formule chimique. n Si il y a un nombre impair d’hydrogène ou d’oxygène et que cela cause un problème il faut doubler le coefficient de la molécule qui cause le problème. n Si il y a de l’oxygène dans chacun des composés de l’équation chimique, ne le compte pas. L’oxygène se balancera tout seul.

Pratiquons nous un peut!

1 1 1 + 1 1= 2 1 1 2 1 KOH + HBr => KBr + H 2 O Elle est déjà équilibrée On en fait une autre!!! a) 1 1 3 13 3 1 1 3 Li + Al. Cl 3 => 3 Li. Cl + Al Souviens-toi si on fait un Elle est déjà équilibrée changement il faut recommencer. ?

A vous de jouer! H 3 PO 4 + Mg(OH)2 => Mg 3(PO 4)2 + H 2 O Na. OH + H 2 CO 3 => Na 2 CO 3 + H 2 O KOH + HBr => KBr + H 2 O Al(OH)3 + H 2 CO 3 => Al 2(CO 3)3 + H 2 O Rb + Rb. NO 3 => Rb 2 O + N 2 Al(OH)3 + HBr => Al. Br 3 + H 2 O C 4 H 10 + O 2 => CO 2 + H 2 O K + Al. F 3 => KF + Al

Écrire des équations chimiques Il faut avoir quelques connaissances de base : – La nomenclature – Les éléments diatomiques: n H 2 , N 2 , O 2 , F 2 , Cl 2 , Br 2 , I 2 – Les éléments polyatomiques: n S 8 , P 4

Écrire des équations chimiques Il y a trois façons d’écrire une équation: a) équation nominale: ex: hydrogène + oxygène b) équation squelette: ex: H 2 + eau O 2 H 2 O c) équation chimique balancée: ex: 2 H 2 + O 2 2 H 2 O

Voici quatre équations nominales. Écrivons l’équation squelettique et équilibré de chacune. 1. L’acide hydrochlorique combiné ave du Bromure de Magnésium produit du chlorure de magnésium et de l’Acide bromhydrique 2. Le nitrite d’ammonium se décompose en azote gazeux et en eau. 3. L’acide sulfurique se décompose en eau et en trioxyde de soufre 4. L’hydroxyde de barium réagit avec le dioxyde de carbone pour former du carbonate de baryum et de l’eau

Voici quatre équations squelettiques. Écris l’équation nominale de chacune. 1. 2 Na 3 PO 4 + 2. 2 HI(aq) 3. 8(NH 4)2 S 4. 2 H 2 O + 3 Ca. Br 2 Cl 2 + Ca 3(PO 4)2 + 2 HCl 8 F 2 + I 2 16 NH 4 F 2 H 2 + 6 Na. Br O 2 + S 8

Toute les équations chimiques suivent la loi de la conservation de la matière

La loi de la conservation de la matière peut se résumer ainsi; dans une réaction chimique : Rien ne se perd, rien ne se crée, les atomes sont tout simplement réarrangés.

La loi de la conservation de la matière

Comment prouver que la loi de la conservation de la matière est respectée? Il faut trouver la masse moléculaire des réactifs et des produits. Si la masse des réactifs est identique a celle des produits la loi est respectée. 12 + 4(1) 16 uma + 4(16) + 64 uma 80 uma = = La masse des réactifs = 12 + 2(16) 44 uma + + 80 uma La masse des produits 4(1) + 2(16) 36 uma

La Mole et la masse molaire

Sa découverte n n En 1811, il proposa l’hypothèse suivante "Des volumes égaux de gaz différents, aux mêmes conditions de température et de pression, contiennent le même nombre de molécules. " Ce nombre est égal à 6, 023 x 1023 molécules "nombre d'Avogadro" et son symbole est NA. Amedeo Avogadro

La mole Nombre de particules équivalent à la constante d’Avogadro Nous avons besoin de 602000000000000 atomes ou 6, 02 x 10 23 atomes = 1 mole.

Nom du nombre n Une paire Valeur n Deux

Nom du nombre n Une douzaine Valeur n Douze

Nom du nombre n Kèquezuns Valeur n Ehhhhh? ? ?

Nom du nombre n Une mole Valeur n 6, 023 x 1023

La mole et la constante d’Avogadro n Calculons: – Combien de molécules d’H 2 O y a-t-il dans 2 moles d’H 2 O? Qu’est-ce qu’on nous donne? Que sait-on? 2 moles d’eau x 6, 02 x 1023 molécules d’eau 1 mole d’eau = 1, 20 x 1024 molécules d’eau

La mole et la constante d’Avogadro n Calculons: – Combien de moles d’eau y a-t-il dans 1. 3 x 1026 molécules d’eau? Qu’est-ce qu’on nous donne? Que sait-on des moles et des molécules? 1, 3 x 1026 molécules d’eau x 1 mole d’eau = 216 moles 6, 02 x 1023 molécules d’eau

La mole et la constante d’Avogadro n À ton tour: – Combien d’atomes de H 3 PO 4 y a-t-il dans 0. 45 moles de H 3 PO 4?

La mole et la constante d’Avogadro n À ton tour: – Combien peut-on former de moles de Br avec 1, 7 x 1025 atomes?

La mole et la constante d’Avogadro n À ton tour: – Combien peut-on former de moles de H 2 O avec 9, 32 x 1023 molécules?

La relation masse molaire, mole et nombre d’Avogadro

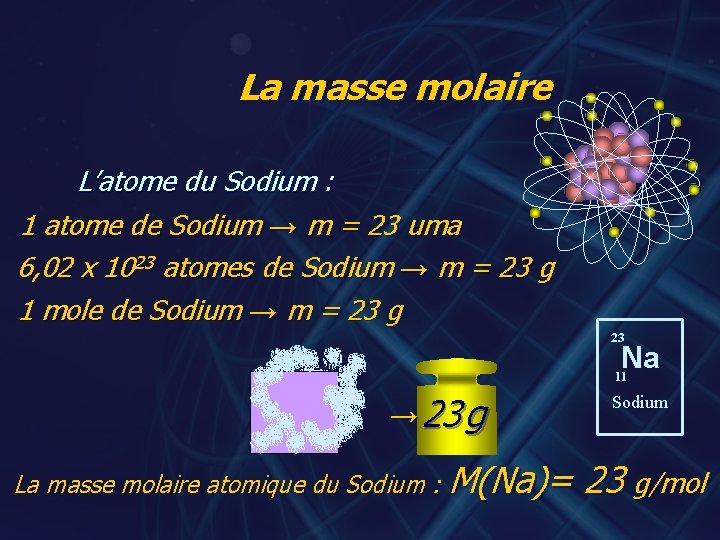
La masse molaire L’atome du Sodium : 1 atome de Sodium → m = 23 uma 6, 02 x 1023 atomes de Sodium → m = 23 g 1 mole de Sodium → m = 23 g 23 Na 11 → 23 g La masse molaire atomique du Sodium : M(Na)= Sodium 23 g/mol

La masse molaire La molécule d’hydroxyde d’aluminium: Al(OH)3 1 molécule d’Al(OH)3 → m = 78 uma 6, 02 x 10 23 molécules d’Al(OH)3 → m = 78 g 1 mole d’Al(OH)3 → m = 78 g

Comment calculer le nombre de mole contenu dans un tube de cuivre ?

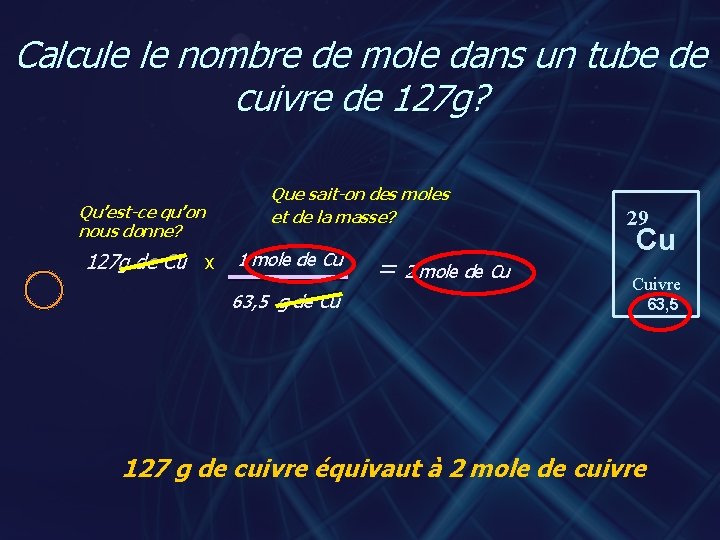
Calcule le nombre de mole dans un tube de cuivre de 127 g? Qu’est-ce qu’on nous donne? 127 g de Cu x Que sait-on des moles et de la masse? 1 mole de Cu 63, 5 g de Cu = 2 mole de Cu 29 Cu Cuivre 127 g de cuivre équivaut à 2 mole de cuivre 63, 5

Résumons n n Masse molaire: c’est la masse de 1 mole d’objet (c’està-dire la masse de 6, 02 x 1023 objets) 1 mole = 6, 02 x 1023 – – 1 mole de carbone = 6, 02 x 1023 atomes de carbone 1 mole de carbone = 12 g La mase molaire du carbone est 12 g 1 mole de glucose (C 6 H 12 O 6) = 6, 02 x 1023 molécules de glucose – 1 mole de glucose = 180 g – La masse molaire du glucose est 180 g

Calcule le nombre d’atomes de cuivre dans un tube de cuivre de 127 g? 29 Que sait-on des moles Qu’est-ce qu’on et de la masse? nous donne? et du nombre d’atomes? 127 g de Cu x 1 mole de Cu 63, 5 g de Cu x Cu Cuivre 63, 5 6, 02 x 1023 atomes de Cu 1 mole de Cu = 1, 2 x 10 24 atomes de Cu 127 g de cuivre équivaut à 1, 2 x 1024 atomes de cuivre

Calcule le nombre d’atomes de cuivre dans un tube de cuivre de 127 g? 29 Cu Cuivre 63, 5

Calcule le nombre de molécules de sel dans une salière contenant 100 g? 11 Na Qu’est-ce qu’on nous donne? Que sait-on des moles Sodium et de la masse? 22, 99 et des molécules? 17 Cl Chlore 35, 45 100 g de Na. Cl x 1 mole de Na. Cl x 6, 02 x 1023 molécules de Na. Cl 58. 44 g de Na. Cl 1 mole de Na. Cl = 1, 03 x 10 24 molécules de Na. Cl 100 g de sel équivaut à 1, 03 x 1024 molécules de sel

La stœchiométrie

Hein? De cossé que cé ça la stœchiométrie "C’est l’étude des relations entre les masses des réactifs et les masses des produits dans une réaction chimique ".

Les calculs des quantités de réactifs et de produits n si on connaît la quantité de réactifs (produits), on peut calculer la quantité de produits (réactifs) qui est formée (requise) n afin de simplifier le processus, on utilisera la méthode des moles, i. e. , on travaillera directement avec les moles (plutôt qu’avec les grammes ou litres)

Les calculs des quantités de réactifs et de produits n pour la réaction 2 CO(g) + O 2(g) 2 CO 2(g) on observe qu’au moins deux moles de CO(g) sont nécessaires pour produire deux moles de CO 2(g) et qu’au moins une mole de O 2(g) est aussi nécessaire n dans cet exemple, on dit que 2 mol CO(g) sont stoechiométriquement équivalent à 1 mol O 2(g) ainsi que 2 mol CO 2(g) n de la même façon, on dit que 1 mol O 2(g) est stoechiométriquement équivalent à 2 mol CO 2(g)

La méthode des moles n étape (1): identifiez tous les réactifs et produits n étape (2): équilibrez l’équation chimique n étape (3): convertissez toutes les quantités connues en moles n étape (4): utilisez les coefficients de l’équation chimique équilibrée pour établir le nombre de moles des quantités recherchées n étape (5): si nécessaire, convertissez le nombre de moles des quantités recherchées en grammes, litres, etc.

La méthode des moles n Exemple: La réaction entre NO et O 2 est une étape clé dans la formation de smog photochimique: 2 NO(g) + O 2(g) 2 NO 2(g) (a) Combien de molécules de NO 2(g) sont formées par réaction complète de. 254 mole de O 2(g)? (b) Quelle masse en grammes de NO 2(g) est obtenue par la réaction complète de 1. 44 g de NO(g)?

La méthode des moles 2 NO(g) + O 2(g) 2 NO 2(g) 0. 254 mole x molécules (a) Combien de molécules de NO 2(g) sont formées par réaction complète de 0. 254 mole de O 2(g)? Que sait-on des moles Que de sait-on des moles de NO 2 et Qu’est-ce qu’on O et de s moles de NOdu 2? nombre de molécules de NO 2? nous donne? 2 0. 254 mole d’O 2 x 2 mole de NO 2 1 mole d’O 2 23 x 6, 02 x 10 molécules NO 2 = 3. 06 x 1023 1 mole de NO 2 molécules de NO 2

La méthode des moles 2 NO(g) + O 2(g) 2 NO 2(g) xg 1. 44 g (b) Quelle masse en grammes de NO 2(g) est obtenue par la réaction complète de 1. 44 g de NO(g)? Que sait-on des moles Que de sait-on des moles de NO 2 et Qu’est-ce qu’on NO et de s moles de NOdu 2? nombre de g de NO 2? nous donne? 1. 44 g de NO x 2 mole de NO 2 2 mole de NO x 46 g de NO 2 1 mole de NO 2 = 66. 2 g de NO 2 14 g + 2(16 g) = 46 g

La méthode des moles 2 CH 3 OH(l) + 3 O 2(g) 2 CO 2(g) + 4 H 2 O(l) (a) Quelle masse de H 2 O est produite lors de la combustion de 209 g de CH 3 OH?

La méthode des moles 2 CH 3 OH(l) + 3 O 2(g) 2 CO 2(g) + 4 H 2 O(l) (b) Combien de molécules de O 2 est utilisées lors de la combustion de 3. 5 moles de CH 3 OH?

La méthode des moles Combien de grammes d’hydroxyde de calcium réagiront entièrement avec 10, 0 g d’acide phosphorique? 3 Ca(OH)2 + 2 H 3 PO 4 Ca 3(PO 4)2 + 6 H 2 O

La méthode des moles Combien de molécules de Cu 2 S peut-on produire en faisant réagir 9, 90 g de Cu. Cl avec du H 2 S gazeux en excès? 2 Cu. Cl(aq) + H 2 S(g) Cu 2 S(s) + 2 HCl(aq)

Stœchiométrie – Équations chimiques Équation des gaz parfaits §Voici §PV l’équation des gaz parfaits : = n. RT P = Pression ( k. Pa) V = Volume ( dm 3 ) n = nombre de mole ● k. Pa R = Constante 8. 31 dm mol ● K T = Température ( K ) = (273 + OC) 3 §Celle-ci nous permet de calculer le nombre de mole d’un gaz.

Stœchiométrie – Équations chimiques Équation des gaz parfaits §Par définition, le volume molaire est le volume d’une mole de gaz de n’importe quelle substance et équivaut à 22, 7 dm 3 à 273 K (O o. C) et 100 k. Pa de pression : § 1 mole de gaz = 22, 7 dm 3 § 6, 02 x 1023 molécules ou atomes d’un gaz = 22, 7 L §TPR ou TPN = Température (273 K) et Pression (100 k. Pa) de Référence (Normales) §N’oublie pas la conversion suivante 1 dm 3 = 1 L = 1000 cm 3 = 1000 m. L = 0, 001 m 3

Stœchiométrie – Équations chimiques Équation des gaz parfaits n Calcule le nombre de moles de gaz contenues dans chacun des volumes suivants mesurés à TPR. (1 mole de gaz = 22, 7 dm 3) a) 247 dm 3 b) 1, 25 x 105 cm 3

Stœchiométrie – Équations chimiques Équation des gaz parfaits n Calcule le volume occupé à TPR (273 K et 100 k. Pa) par chacune des quantités de gaz suivantes : a) 1. 4 mole de Cl 2 b) 2, 39 x 1023 molécules O 3

Stœchiométrie – Équations chimiques Équation des gaz parfaits Calcule le volume occupé à TPR de 3, 00 mol de H 2? P = Pression ( k. Pa) V = Volume (dm 3 ) n = nombre de mole R = Constante 8. 31 T = Température ( K )

Stœchiométrie – Équations chimiques Équation des gaz parfaits À quelle température un ballon de 10, 9 dm 3 contenant 0, 877 mol de sulfure d’hydrogène présente-t-il une pression de 2, 00 x 102 k. Pa ? P= V= n= R= T=

Stœchiométrie – Équations chimiques Équation des gaz parfaits À quelle température un ballon de 31, 5 dm 3 contenant 3, 271 mole de sulfure d’hydrogène présente-t-il une pression de 232 k. Pa ? P= V= n= R = 8. 31 T=

Stœchiométrie – Équations chimiques Équation des gaz parfaits Détermine combien on peut produire de dm 3 de CO 2 à TPR à partir de 41 g de Fe 2 O 3 par la réaction suivante : Fe 2 O 3(s) + 3 CO(g) → 3 Fe(s) + 3 CO 2(g) P= V= n= R = 8. 31 T=

Stœchiométrie – Équations chimiques Équation des gaz parfaits Quel masse de chlorure de sodium peut-on produire par la réaction de 13, 0 g de sodium avec 18, 3 dm 3 de chlore à TPR par la réaction suivante : 2 Na(s) + Cl 2(g) → 2 Na. Cl(s) P= V= n= R = 8. 31 T=

Stœchiométrie – Équations chimiques Équation des gaz parfaits Calculer le volume d’oxygène à TPR nécessaire à la combustion complète de 401 cm 3 de butane C 4 H 10. P= V= n= R = 8. 31 T=

Stœchiométrie – Équations chimiques Équation des gaz parfaits Feuille de travail
 Prcipitation
Prcipitation Grsil
Grsil Prcipitation
Prcipitation Quations
Quations Quations
Quations Pollutions chimiques et gestion environnementale
Pollutions chimiques et gestion environnementale Tableau des formules chimiques
Tableau des formules chimiques Produits chimiques
Produits chimiques Phet colorado equilibrer equations chimiques
Phet colorado equilibrer equations chimiques Valence des corps chimiques
Valence des corps chimiques Le volcan le plus dangereux du monde
Le volcan le plus dangereux du monde Les promesses de dieu ne failliront jamais
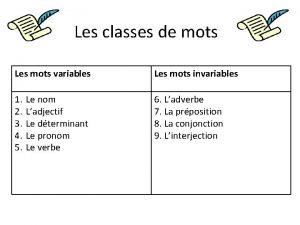
Les promesses de dieu ne failliront jamais Les mots variable et invariable
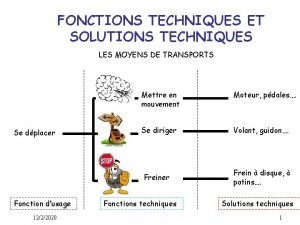
Les mots variable et invariable Fonction technique scooter
Fonction technique scooter Marqueurs de relation conclusion
Marqueurs de relation conclusion Allez vous en sur les places
Allez vous en sur les places Le paratexte de la ficelle
Le paratexte de la ficelle Horloge stratégique
Horloge stratégique Les mots variables et invariables
Les mots variables et invariables Parts de una flor
Parts de una flor Les voitures les plus rapides du monde
Les voitures les plus rapides du monde Dragibus soft calories
Dragibus soft calories Les actionneurs et les préactionneurs
Les actionneurs et les préactionneurs Pronoms convenable
Pronoms convenable Les constellations les plus connues
Les constellations les plus connues Tu aimes manger
Tu aimes manger Trouvez les réponses. écrivez-les en chiffres (numbers).
Trouvez les réponses. écrivez-les en chiffres (numbers). Les lettres et les sons
Les lettres et les sons Les trois obstacles et les quatre démons
Les trois obstacles et les quatre démons Les parts de les plantes
Les parts de les plantes Les mots qu'on ne dit pas sont les fleurs du silence
Les mots qu'on ne dit pas sont les fleurs du silence C'est quoi un texte expressif
C'est quoi un texte expressif Les histoires d'amour c'est comme les voyages en train
Les histoires d'amour c'est comme les voyages en train Les numero romain
Les numero romain Ligne faitiere des cretes
Ligne faitiere des cretes Bras et avant bras anatomie
Bras et avant bras anatomie Exemple de parcours avenir pdf
Exemple de parcours avenir pdf Généralisation abusive
Généralisation abusive Les phases de production
Les phases de production Arbre avl
Arbre avl Les 8 types de textes
Les 8 types de textes Par le cieux devant toi
Par le cieux devant toi Les causes de l inflation
Les causes de l inflation Les choristes main characters
Les choristes main characters Approche par les forces
Approche par les forces Mettre les watts
Mettre les watts Les dir oder lies dir
Les dir oder lies dir Les composants internes de l'ordinateur
Les composants internes de l'ordinateur Ma vie et moi
Ma vie et moi Les sons de la mine
Les sons de la mine Les chelles
Les chelles Les lignes imaginaires
Les lignes imaginaires Les larmes noires julius lester
Les larmes noires julius lester Les menaces informatiques
Les menaces informatiques Famille des métaux alcalins
Famille des métaux alcalins Quel beau nom paroles
Quel beau nom paroles Les courses
Les courses Nederland les
Nederland les Prire
Prire