Les Caractristiques Les Mtaux n La majorit des
























































- Slides: 61

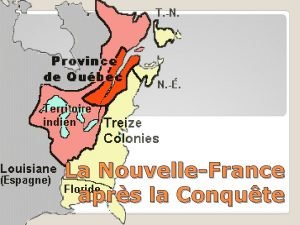
Les Caractéristiques

Les Métaux n La majorité des éléments sont des métaux. n Brillants (shiny) n Bonnes conducteurs du chaleur et de l’électricité n Hautes masses volumiques

Les Métaux n Ductiles n Malléables n On peut facilement former des fils (wires) ou plaques (sheets) n Vont rouiller

Les Non-Métaux n Basses masses volumiques n Fondent (melt) aux basses températures n Pas/peu malléable n Fragiles; Souffre cassent facilement

Les Non-Métaux n Coté droite du tableau périodique n Surface terne (dull) n Mauvaises conducteurs du chaleur et de l’électricité

Les Métalloides n Possèdent quelques propriétés des métaux et quelques propriétés des non-métaux (dépendant de quelle métalloide) n Peuvent être brillants ou ternes n Facile à changer leur forme n Conduction – entre des métaux et non-métaux

n Les éléments sont organisés dans le Tableau Périodique

Le Tableau Périodique n 7 rangées appelées les 7 PÉRIODES n 18 colonnes appelées les FAMILLES

Le Tableau Périodique n Les éléments sont ordonnées dans les rangées (horizontales) et colonnes (verticales). Une rangée s’appelle une période Il y a 7 périodes

Les Groupes/Familles Une colonne s’appelle une groupe ou une famille Il y a 18 groupes/familles

Les familles dans le tableau périodiques n n Les éléments dans le tableau périodique peut être groupés dans des familles selon leurs propriétés chimiques. Chaque famille a un nom spécifique.

Les éléments qui sont dans la même famille se ressemblent beaucoup et ont des propriétés chimiques communs.

Les Familles Pour la plupart, les familles sont les 18 colonnes dans le tableau périodique. Il y a 10 catégories: *Les Alcalins * Les Terres rares *Les Alcalino-Terreux (Les actinides/Les lanthanides) * Les Métaux en Transition * Terreux * Les Carbonides * Les Azotides * Les Sulfurides * Les Halogènes * Les Gaz Rares/Les gaz nobles/Les gaz inertes

Hydrogène n n Hydrogène est une famille toute seule. Hydrogène est un gaz réactive et diatomique. Hydrogène était responsible pour l’explosion du Hindenberg. Hydrogèene est en train d’être explorer comme source altérnative pour les automobiles.

Hydrogène n n L’hydrogène est en haut de la famille A 1 mais n’est pas un membre de cette famille. C’est un gaz à la température ambiante. Il possède un proton et un électron et n’a qu’un couche d’électrons. Hydrogène a besoin de 2 électrons afin de remplir dans sa couche d’électrons. Donc, il se lie souvent avec un autre atome d’hydrogène afin de devenir stable.

Les métaux alcalins Groupe 1 n n n n La famille alcaline est trouvé dans le premier colonne dans le tableau périodique. Groupe 1 sont tous les métaux doux et “silvery” Hydrogène n’est pas un membre car il est un non- métaux. 1 électrons dans sa dernière couche. Très réactive, surtout avec l’eau. Conducteur d’électricité Si doux, il peut être coupé avec un couteau.

Les métaux alcalins n n Ils sont les métaux les plus réactive du tableau. Les métaux alkalins ne sont jamais trouvé en forme seule dans la nature. Ils sont toujours liés avec un autre éléments pour le rendre stable.

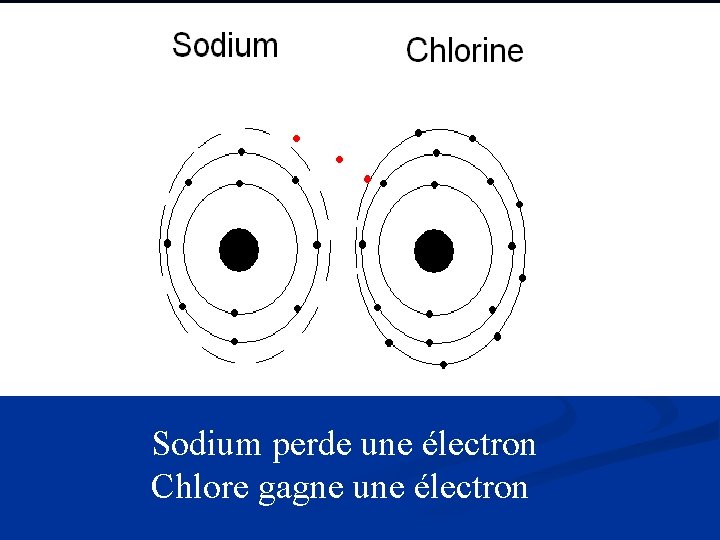
Qu’est-ce que ça veut dire d’être réactive? n n On va être en train de décrire les éléments selon leur réactivité. Les éléments qui sont réactive se lie facilement avec d’autre éléments afin de créer des composés. Quelques éléments sont seulement trouvés dans la nature liée avec d’autres éléments. (ie. Sodium) Qu’est-ce qui fait un élément réactive? n n n Un couche d’électrons incomplète. Tout les atomes (sauf hydrogène) veut avoir 8 électrons dans leurs dernière couche d’électrons. Ceci s’appelle la règle de l’octet. Les atomes si lient jusqu’au moment où la couche d’électrons est complète. Les atomes avec peu d’électrons de valence vont les perdre durant la réaction chimique. Les atomes avec 6, 7, ou 8 électrons de valence gagnent des électrons durant la réaction chimique.

5

Sodium perde une électron Chlore gagne une électron


Les métaux alcalino-térreux Groupe 2 n 2 électrons dans leur dernière couche d’électrons n Blanc et malléable Réactive, mais moins que les métaux alcalines Conducteur d’électricité. Plusieurs des élements sont des nutrients minéraux (comme Mg et Ca) n n n

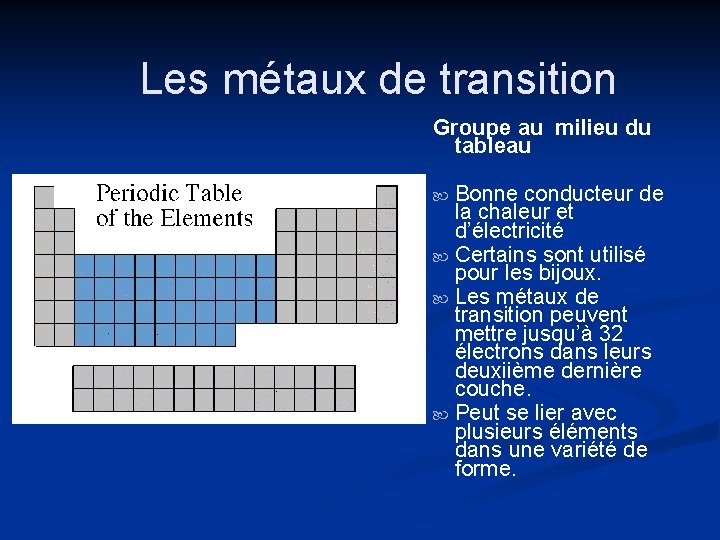
Les métaux de transition Groupe au milieu du tableau Bonne conducteur de la chaleur et d’électricité Certains sont utilisé pour les bijoux. Les métaux de transition peuvent mettre jusqu’à 32 électrons dans leurs deuxiième dernière couche. Peut se lier avec plusieurs éléments dans une variété de forme.

Les métaux de transition n n Les éléments dans les groupes 3 -12 Moins réactive et plus dure. Aussi souvent utilisé dans la construction. Des métaux utilisé comme “des métaux”

Les métaux de transition n Les composés formées avec les métaux de transition sont souvent très brillantes et souvent utilisé dans afin de colorier la peinture. Ils ont 1 ou 2 électrons de valence qu’ils perdent quand ils se lient avec d’atomes. Plusieurs métaux de tarnsition se combinent chimiquement avec oxygène afin de former des composés appellé des oxides.

Les Terreux Groupe 13 n n 3 électrons dans la dernière couche La plupart sont des métaux Bore est un metalloïde. Aluminium était une fois rare et chère et maintenant c’est un métal “jetable”. C’est le métal le plus abondante dans la croûte terrestre.

La croûte terrestre

Les carbonides Groupe 14 n n n 4 electrons dans la dernière couche d’électrons Contient des métaux , des non métaux et des métalloïdes. L’élément carbon est “la base de vie”. Il y a tout une branche de chimie au sujet des composées carbone appellée la chimie organique.

Les carbonides n. Contient des élements important à la vie et aux ordinateurs. n. Silicon et Germanium sont des semiconducteurs très importants.

Les azotides Groupe 15 n. Cette groupe est nommée d’après l’élément qui se composent plus que 78% de l’atmosphère- azote (N). n. Cette famille contient des métaux, des non métaux et des non-métaux. n. Les atomes des azotides ont 5 électrons de valences. Ils partagent des électrons lorsqu’il se lient.

Les sulfurides Groupe 16 n. Les éléments dans cette famille ont 6 électrons de valence. n. Plusieurs des éléments dans cette famille partage des électrons lorsqu’il forment des composés. n. Oxygène est l’élément en plus abondance dans la croûte de la terre. C’est très réactive et se combine avec presque tout les éléments.

Les sulfurides n. Plusieurs éléments qui contient du souffre. (S) n. Par exemple, l’aile, les oeufs pourri et les mouffettes etc

Les Halogènes n n Les éléments dans cette famille sont fluor, chlore, bromine, iode et astatine. Les halogènes ont 7 électrons de valence , qui explique pourquoi ils sont les non –métaux et plus réactive. Ils ne sont pas trouvé libre dans la nature. Les atomes d’halogène n’ont besoin de gagner qu’un seul atome afin de remplir leurs dernière couche d’électrons. Ils réagissent avec des métaux alcalines afin de former des sels.

Halogènes n. Utilisé dans les déinfectants (Cl) et afin de rendre les dents plus forts(F).

Les gaz nobles/rares/inertes Groupe 18 n. TRÈS non réactive n. Utilisé dans les affiches néon. n. Utilisé dans les gonflables après les problèmes d’Hindenberg n. Ils ont une dernière couche d’électrons pleine. n. En petit quantité dans l’atmosphère de la Terre.

Les Terres rares n n n Il y a plusieurs éléments qui se composent les lanthanides et les actinides. Un élément dans la série des lanthanides et tout les éléments dans la série actinides sont transuranien, qui veut dire synthétique ou créer par l’humain. Certains éléments sont radioactive.


La clée au tableau périodique Les éléments dans le tableau périodique sont organisé selon leur nombre atomique, le nombre entier illustré dans le carré.

La clée au tableau périodique n Le nombre atomique fait référence au nombre de protons et aussi le nombre d’électrons dans l’élément. n Par exemple, hydrogène a 1 proton, et donc son nombre atomique est 1. n Le nombre atomique est unique à l’élément. Chaque élément a son propre numéro atomique.

n Les Éléments sont organisées selon leurs numéros atomiques (cher en haut à droite) n • • • Déterminer les numéros atomiques des éléments suivantes: Hydrogène Béryllium Néon * Lithium * Californium * Plomb

Les Numéros Atomiques n Chercher les numéros atomiques des éléments suivantes: n Tungstène n Plomb n Xénon n Fluor (lead)

Les Numéros Atomiques n Chercher les éléments qui correspondent aux numéros atomiques suivantes: n 16 n 33 n 98 n 102

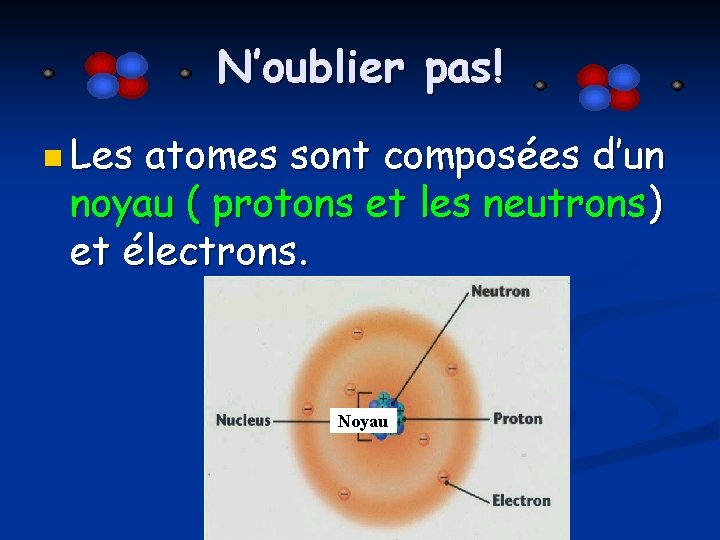
N’oublier pas! n Les atomes sont composées d’un noyau ( protons et les neutrons) et électrons. Noyau

Les Masses Atomiques La masse totale des protons et neutrons dans un atome. n mesurés en unités de amu (atomic mass unit) (u) n n Proton: masse est n Neutron: masse est n Électron: masse est

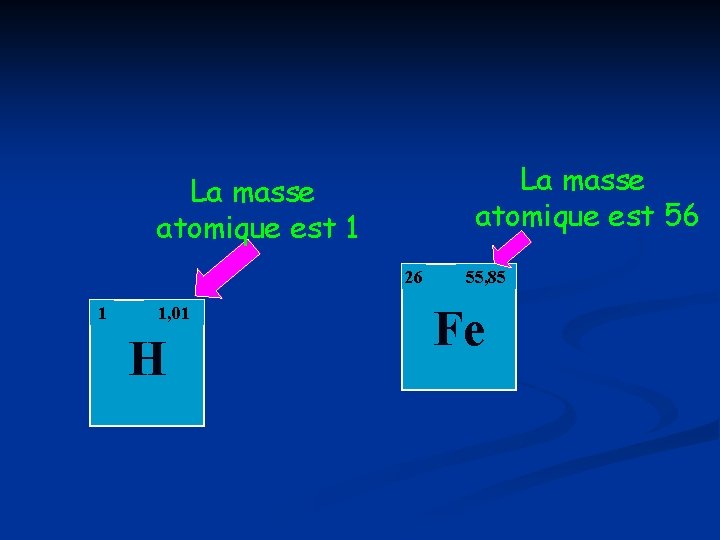
La masse atomique est 56 La masse atomique est 1 26 1 1, 01 H 55, 85 Fe


Ex: Lithium (Li) n. Masse atomique est 7 n. Nombre atomique de 3 Cela veut dire 3 protons et 3 électrons Masse atomique – le nombre atomique = # de neutrons n. On ne tient pas compte de la masse des électrons (Rappeler: 99% de la masse d’une atome vient du noyau ) n. Donc, Li a 4 neutrons.

Révision!! n n Le numéro atomique et la masse atomique sont complètement différentes. # atomique = # de protons (détermine le placement dans le tableau périodique) Masse atomique = # protons + # neutrons n Les deux sont données dans le tableau

Calculer le nombre de neutrons Le nombre de neutrons peuvent être trouver par: n. Masse atomique – le nombre atomique = # de neutrons

n Le Numéro Atomique de Krypton (Kr) est 36. n Kr - 36 protons (alors) – 36 électrons n# de Neutrons = 84 – 36 # de Neutrons = 48 neutrons


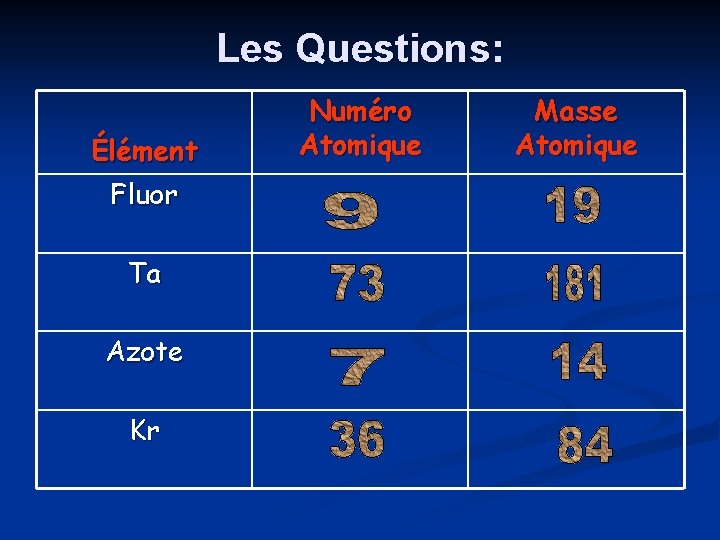
Les Questions: Élément Fluor Ta Azote Kr Numéro Atomique Masse Atomique

La Notation Atomique Standarde

La Notation Atomique Standarde n Aluminium n Calcium n Chlore n Fluore

La Notation Atomique Standarde n Hélium n Magnésium n Azote n Oxygène

La Notation Atomique Standarde n Phosphore n Potassium n Soufre n Sodium

Les Protons et les Electrons n Les atomes doivent avoir la même quantité de protons et électrons. La Quantité de Protons = Le Numéro Atomique La Quantité d’Électrons = La Quantité de Protons # de Neutrons = Masse Atomique - # Atomique

Vanadium n Protons? n Électrons? n Neutrons? (51 – 23) 23 V Vanadium 50, 94

Ruthenium n Protons? n Électrons? n Neutrons? (101 – 44) 44 V Ruthenium 101, 07

Plomb n Protons? n Électrons? n Neutrons? (207 – 82)

 Des des des
Des des des Modes et temps
Modes et temps La diffusion des idées des lumières
La diffusion des idées des lumières Il existe des personnes qui sont des lumières pour tous
Il existe des personnes qui sont des lumières pour tous Affiche plan marshall
Affiche plan marshall Diversification des espaces et des acteurs de la production
Diversification des espaces et des acteurs de la production Volume d'un corps
Volume d'un corps Mesure de niveaux pour liquides et solides
Mesure de niveaux pour liquides et solides Cartographie des flux de valeur
Cartographie des flux de valeur Je t'offrirai des fleurs et des nappes en couleurs
Je t'offrirai des fleurs et des nappes en couleurs Robin des bois des alpes
Robin des bois des alpes Des attacks
Des attacks Budget des ventes méthode des moindres carrés
Budget des ventes méthode des moindres carrés Les chansons des roses
Les chansons des roses Limites de l'école des relations humaines
Limites de l'école des relations humaines Type de solution
Type de solution Les personnes sont des cadeaux
Les personnes sont des cadeaux Les personnes sont des cadeaux
Les personnes sont des cadeaux Plan des enfers grecs
Plan des enfers grecs Les étapes de fixation des prix
Les étapes de fixation des prix French le la les
French le la les Les dérives du pétrole sont des matériaux synthétiques
Les dérives du pétrole sont des matériaux synthétiques Tableau demarche de soins
Tableau demarche de soins Les entrees des courses
Les entrees des courses Quelles sont les etapes du regroupement des armeniens
Quelles sont les etapes du regroupement des armeniens Poésie le blaireau sans-gêne
Poésie le blaireau sans-gêne échange des substances dissoutes
échange des substances dissoutes Les lois des exposants
Les lois des exposants Les causes des conflits interpersonnels
Les causes des conflits interpersonnels Les amis sont des anges qui nous soulèvent
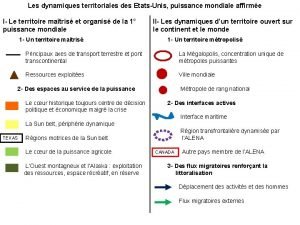
Les amis sont des anges qui nous soulèvent Les dynamiques territoriales des etats unis
Les dynamiques territoriales des etats unis Les amis sont des compagnons de voyage
Les amis sont des compagnons de voyage Les causes des conflits interpersonnels
Les causes des conflits interpersonnels En croyant à des fleurs souvent on les fait naître
En croyant à des fleurs souvent on les fait naître Les sources du droit subjectif
Les sources du droit subjectif Comparatif de bon
Comparatif de bon Que mange une coccinelle
Que mange une coccinelle Tija planta
Tija planta Les lettres et les sons
Les lettres et les sons Les 10 volcans les plus dangereux du monde
Les 10 volcans les plus dangereux du monde La ficelle maupassant fiche de lecture
La ficelle maupassant fiche de lecture Les constellations les plus connues
Les constellations les plus connues Remplacez les mots soulignes par les pronoms convenable
Remplacez les mots soulignes par les pronoms convenable Parts d una planta
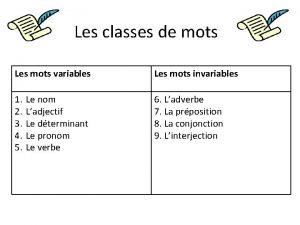
Parts d una planta Mot invariable et variable
Mot invariable et variable Les mots variables
Les mots variables Trouvez les réponses. écrivez-les en chiffres (numbers).
Trouvez les réponses. écrivez-les en chiffres (numbers). On s'est quitté d'un commun accord
On s'est quitté d'un commun accord Allez vous en sur les places
Allez vous en sur les places Preactionneurs
Preactionneurs Les trois obstacles et les quatre démons
Les trois obstacles et les quatre démons Dieu veut des soldats fideles
Dieu veut des soldats fideles Les avantages et les inconvénients de la matrice adl
Les avantages et les inconvénients de la matrice adl Tu aimes manger
Tu aimes manger Les mots qu'on ne dit pas sont les fleurs du silence
Les mots qu'on ne dit pas sont les fleurs du silence Un organisateur textuel
Un organisateur textuel Calorie dragibus
Calorie dragibus Type de texte expressif
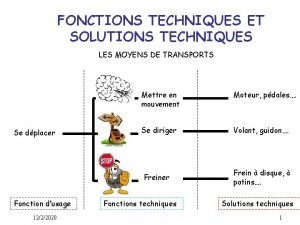
Type de texte expressif Les fonctions techniques et les solutions techniques
Les fonctions techniques et les solutions techniques Les voitures les plus rapides du monde
Les voitures les plus rapides du monde Modelo de hax (1992)
Modelo de hax (1992) Wurzel nenner rational machen
Wurzel nenner rational machen