UVOD U ORGANSKU GEOKEMIJU Ugljik 1 s 2





















- Slides: 31

UVOD U ORGANSKU GEOKEMIJU

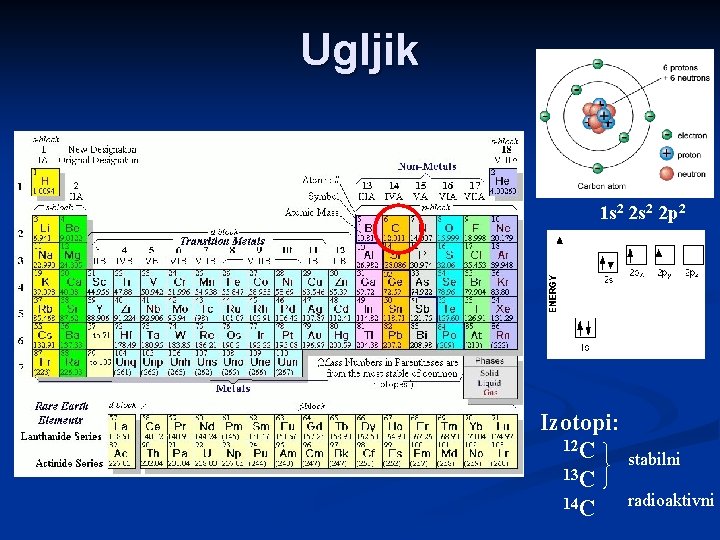
Ugljik 1 s 2 2 p 2 Izotopi: 12 C 13 C 14 C stabilni radioaktivni

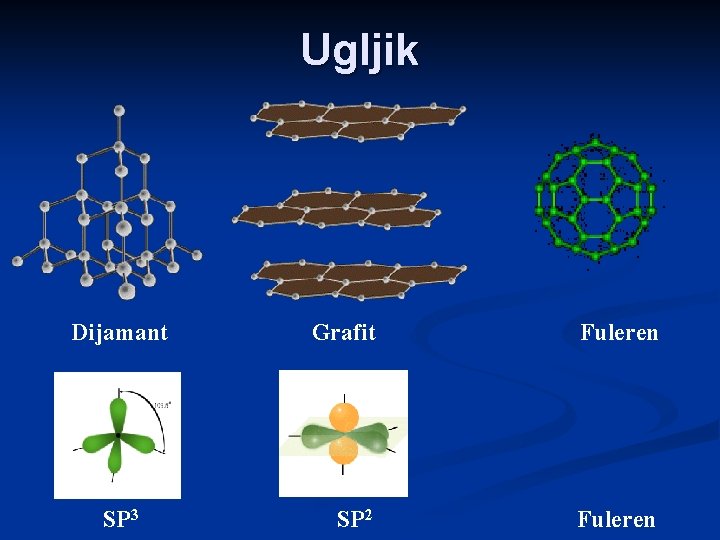
Ugljik Dijamant SP 3 Grafit Fuleren SP 2 Fuleren

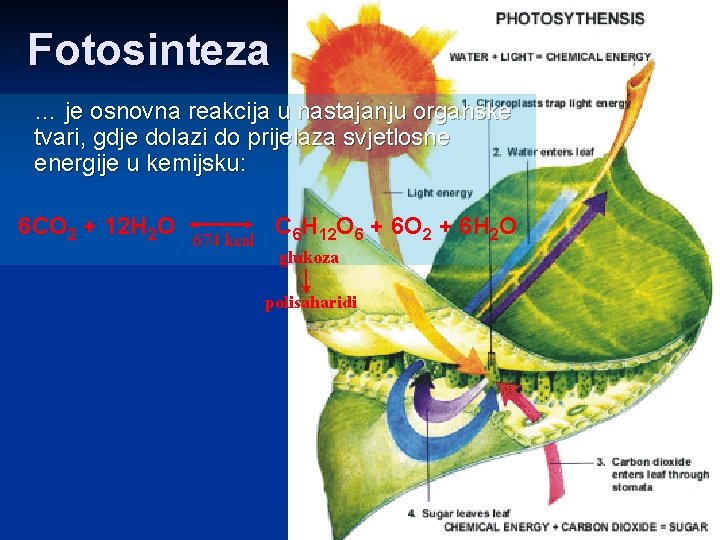
Fotosinteza … je osnovna reakcija u nastajanju organske tvari, gdje dolazi do prijelaza svjetlosne energije u kemijsku: 6 CO 2 + 12 H 2 O 674 kcal C 6 H 12 O 6 + 6 O 2 + 6 H 2 O glukoza polisaharidi

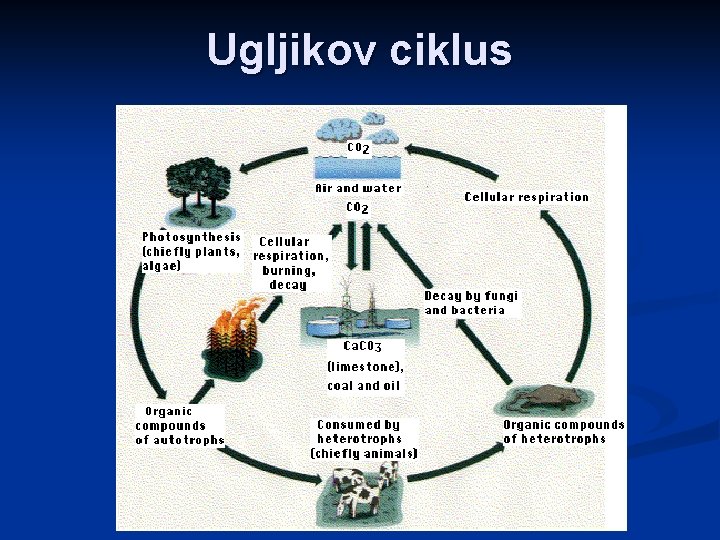
Ugljikov ciklus

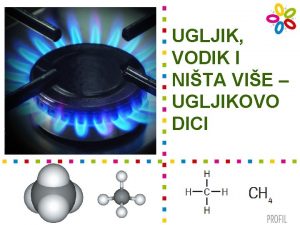
Ugljikovodici … su spojevi koji se sastoje isključivo od atoma ugljika i atoma vodika alifatski n aliciklički n aromatski n

Alifatski ugljikovodici … su lančasti ugljikovodici bez prstenastih struktura te se nazivaju i acikličkim ugljikovodicima -C–Cn n n alkani (parafini ili zasićeni ugljikovodici) alkeni alkini C=C C C nezasićeni ugljikovodici

Alkani (Cn. H 2 n+2) n normakni alkani n-C 18 (oktadekan) n-C 19 (nonadekan) n-C 20 (eikosan) n izo-alkani (izo-parafini ili izoprenoidi) i-C 18 (norpristan) i-C 19 (pristan) i-C 20 (fitan)

Aliciklički ugljikovodici …se formiraju zatvaranjem ugljikovodičnih lanaca u prstene, pri čemu dolazi do gubitka dvaju atoma vodika n cikloalkani (cikloparafini ili nafteni) Cn. H 2 n n cikloalkeni Cn. H 2 n-2 ciklopentan ciklopenten cikloheksan cikloheksen

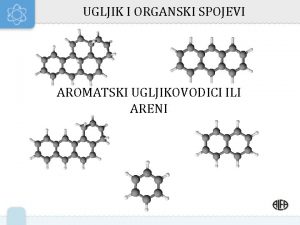
Aromatski ugljikovodici … su skupina ugljikovodika koji sadrže aromatski (benzenski) prsten n nezasićeni, ali relativno nereaktivni naftalen antracen

Funkcionalne (reaktivne) grupe

Kemijski sastav biomase ugljikohidrati n proteini n lipidi n lignin n

Lignin se formira ireverzibilnim odstranjivanjem vode iz monosaharida, pri čemu nastaju aromatski prsteni. Polimeri lignina su umrežene strukture molekularne težine reda veličine 10. 000 amu. Imaju relativno visoku otpornost na degradirajuće procese.

Izvori organske tvari fitoplankton (zasićeni i nezasićeni ugljikovodici, ravnih i razgranatih lanaca; n -C 14 – n-C 32 uz dominaciju n-C 15 i n-C 17) n zooplankton n bakterije (steroli s 27 i 29 C atoma te triterpeni hopanske serije) n više kopnene biljke (n-C 10 – n-C 40 uz dominaciju neparnih n-alkana) n

Organska tvar bitumen (dio organske tvari koji je moguće ekstrahirati iz stijene organskim otapalima) n kerogen (organska tvar u stijeni koja nije topiva u organskim otapalima) n bitumen + kerogen = ukupni organski ugljik (TOC ili Corg)


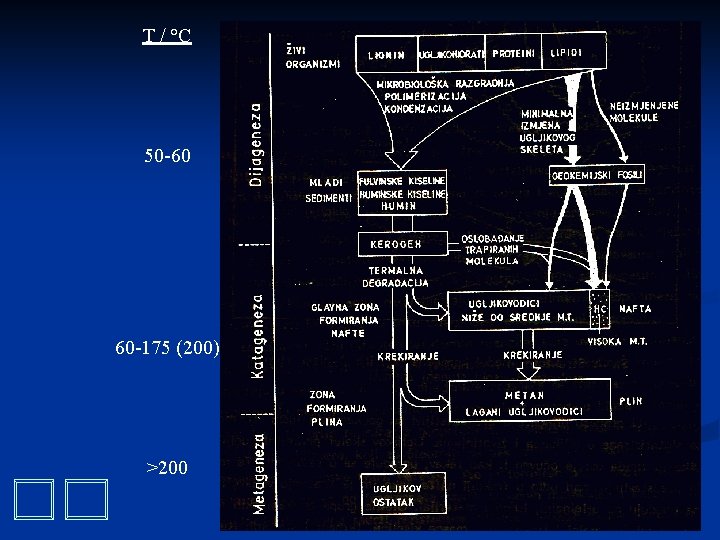
T / °C 50 -60 60 -175 (200) >200

Molekule kerogena



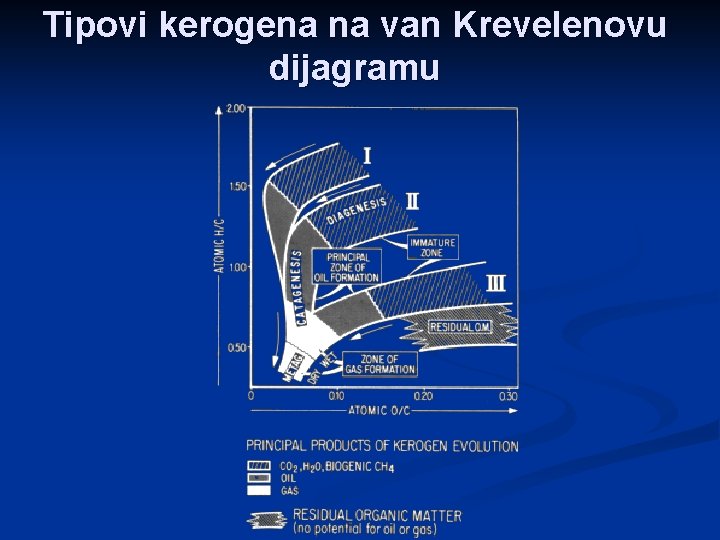
Klasifikacija kerogena …je moguća na temelju optičkih i fizičkokemijskih ispitivanja. Na temelju sadržaja ugljika, kisika i vodika tj. njihovih atomskih omjera razlikujemo 4 tipa kerogena

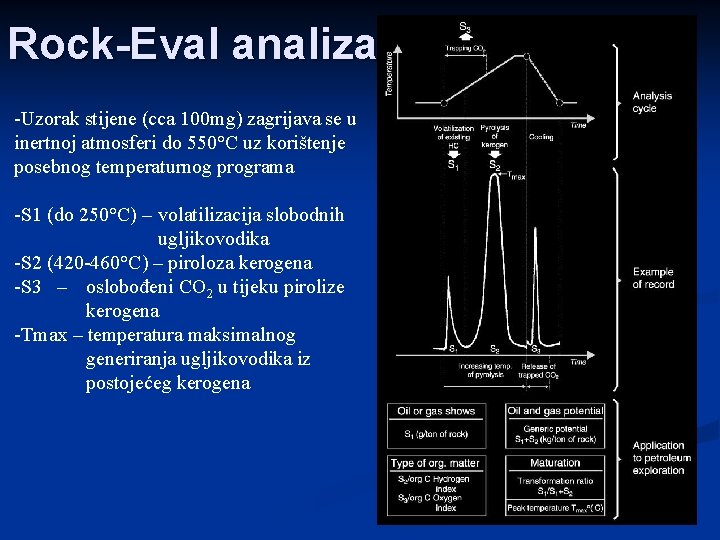
Rock-Eval analiza -Uzorak stijene (cca 100 mg) zagrijava se u inertnoj atmosferi do 550°C uz korištenje posebnog temperaturnog programa -S 1 (do 250°C) – volatilizacija slobodnih ugljikovodika -S 2 (420 -460°C) – piroloza kerogena -S 3 – oslobođeni CO 2 u tijeku pirolize kerogena -Tmax – temperatura maksimalnog generiranja ugljikovodika iz postojećeg kerogena

Tipovi kerogena na van Krevelenovu dijagramu

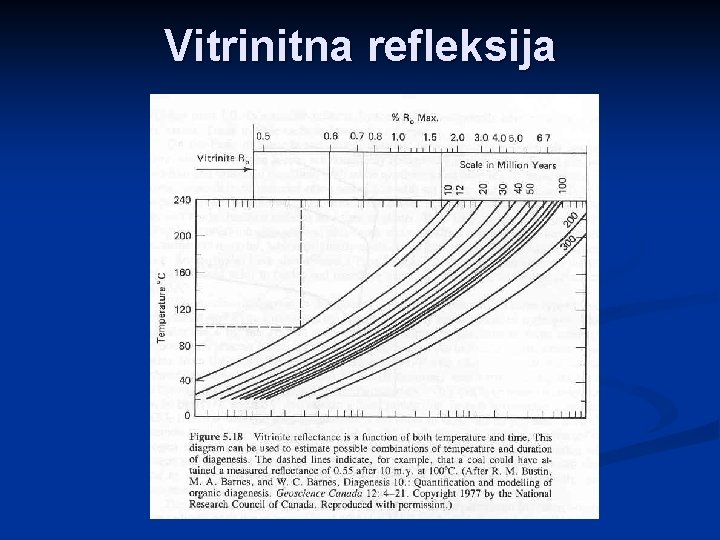
Vitrinitna refleksija

Komponente u bitumenu Zasićeni ugljikovodici n Aromatski ugljikovodici n NOS-spojevi n Biomarkeri (geokemijski fosili) n

Biomarkeri i njihovi prekursori

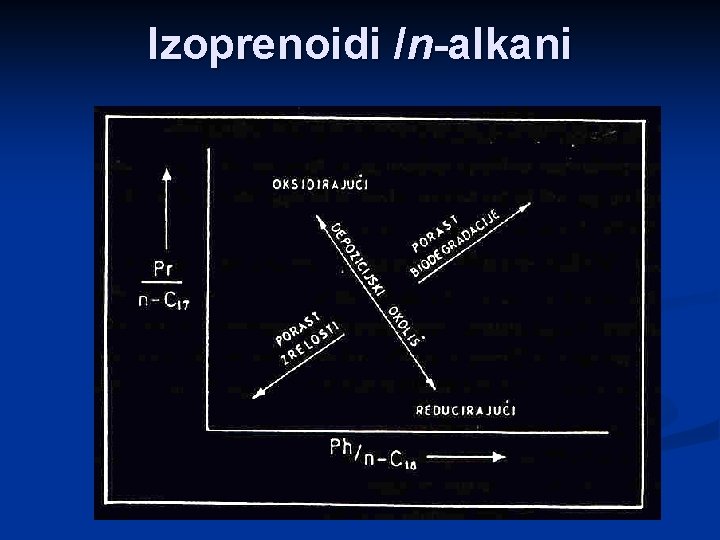
Specifični parametri n-alkanska distribucija n izoprenoidna distribucija n odnos izoprenoidi/n-alkani n triterpani (hopani) n sterani n

Izoprenoidi /n-alkani

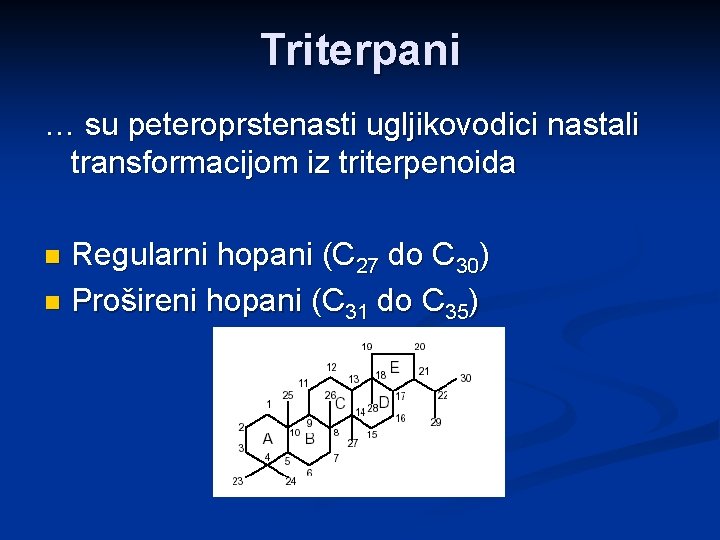
Triterpani … su peteroprstenasti ugljikovodici nastali transformacijom iz triterpenoida Regularni hopani (C 27 do C 30) n Prošireni hopani (C 31 do C 35) n

Sterani … su četveroprstenasti ugljikovodici nastali iz sterola

 Uvod u organsku hemiju
Uvod u organsku hemiju Uvod u teoriju računarstva fer
Uvod u teoriju računarstva fer Uvod u ekologiju
Uvod u ekologiju Pravopisni znakovi kviz
Pravopisni znakovi kviz Gdje se čuvaju slikovni povijesni izvori
Gdje se čuvaju slikovni povijesni izvori Uvod u baze podataka
Uvod u baze podataka Unutarnja kompozicija
Unutarnja kompozicija Radno vreme vozaca nocni rad
Radno vreme vozaca nocni rad Uvod u rehabilitaciju
Uvod u rehabilitaciju Pravila ponasanja u laboratoriji
Pravila ponasanja u laboratoriji Stativ hemija
Stativ hemija Iz velegradskog podzemlja ispit
Iz velegradskog podzemlja ispit Razlagalni esej
Razlagalni esej Arhitektura baze podataka
Arhitektura baze podataka Sloh charakteristika osoby
Sloh charakteristika osoby Uvod zapletka
Uvod zapletka Maturski rad primjer
Maturski rad primjer Moždanik
Moždanik Objektno orijentirano programiranje
Objektno orijentirano programiranje Uvod u teoriju računarstva fer
Uvod u teoriju računarstva fer Uvod seminarskog rada
Uvod seminarskog rada Uradjene laboratorijske vezbe iz fizike
Uradjene laboratorijske vezbe iz fizike Znanstveni rad primjer
Znanstveni rad primjer Fictional character
Fictional character Uvod u psihologiju
Uvod u psihologiju Uvod u knjigovodstvo
Uvod u knjigovodstvo Informatika definicija
Informatika definicija Uvod u geografiju
Uvod u geografiju Vnútorná kompozícia textu
Vnútorná kompozícia textu Uvod u excel
Uvod u excel A ja za ljubav samo na taj dođoh svijet
A ja za ljubav samo na taj dođoh svijet Strah u ulici lipa uvod zaplet vrhunac rasplet
Strah u ulici lipa uvod zaplet vrhunac rasplet