UGLJIK VODIK I NITA VIE UGLJIKOVO DICI Svojstva










- Slides: 19

UGLJIK, VODIK I NIŠTA VIŠE – UGLJIKOVO DICI

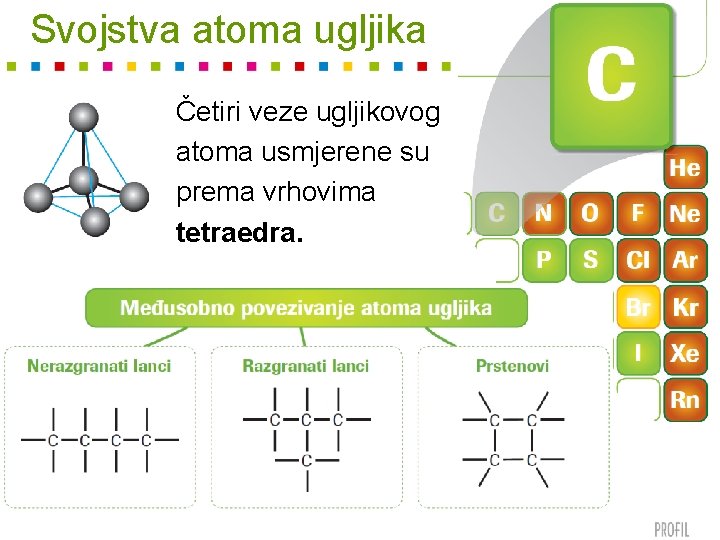
Svojstva atoma ugljika Četiri veze ugljikovog atoma usmjerene su prema vrhovima tetraedra.

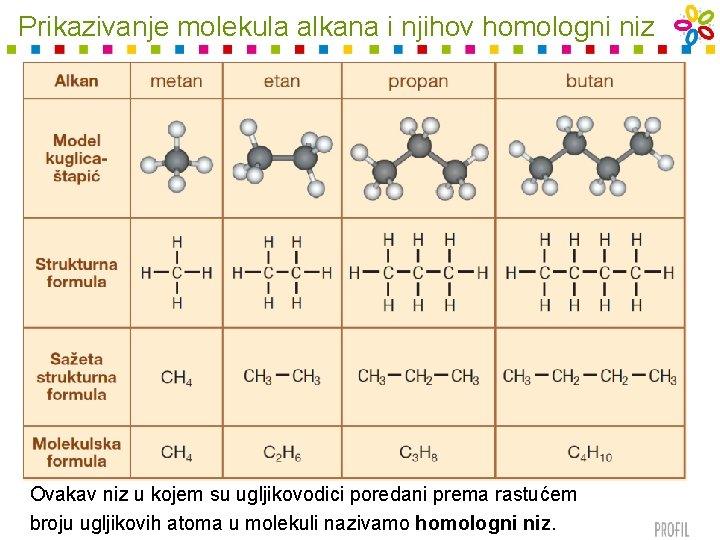
Zasićeni ugljikovodici – alkani • najjednostavniji organski spojevi • sastoje se od ugljika i vodika • ugljikovi su atomi uvijek povezani u lanac jednostrukim vezama • na ostale se veze na ugljiku vežu vodikovi atomi – stoga ih i nazivamo zasićeni ugljikovodici ili alkani • brojevni se odnos ugljika i vodika izvodi iz opće formule alkana: Cn. H 2 n + 2 • ime svakog alkana završava nastavkom –an (npr. metan, propan, butan, pentan. . . )

Prikazivanje molekula alkana i njihov homologni niz Ovakav niz u kojem su ugljikovodici poredani prema rastućem broju ugljikovih atoma u molekuli nazivamo homologni niz.

Svojstva i uporaba alkana • • alkani nisu kemijski reaktivni, pa se zbog toga nazivaju i parafini metan je u smjesi sa zrakom eksplozivan i lako zapaljiv etan, propan i butan također su lako zapaljivi konačni produkti gorenja su ugljikov(IV) oksid i voda: • izgaraju li uz nedovoljan pristup zraka nastaje otrovan ugljikov(II) oksid

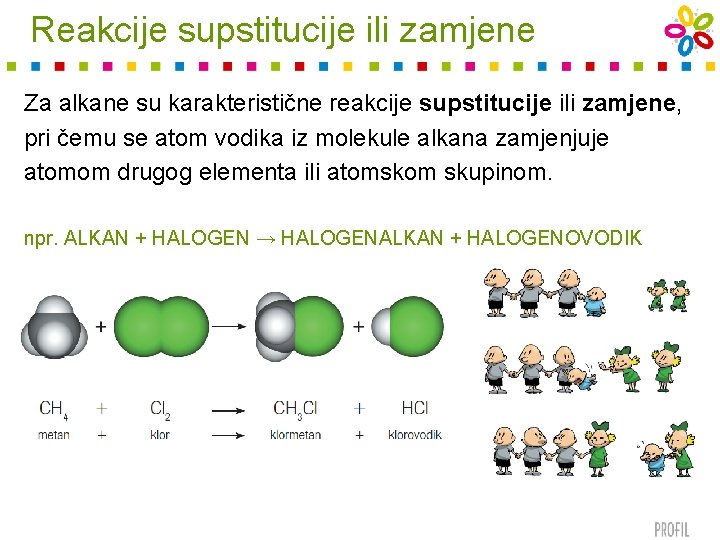
Reakcije supstitucije ili zamjene Za alkane su karakteristične reakcije supstitucije ili zamjene, pri čemu se atom vodika iz molekule alkana zamjenjuje atomom drugog elementa ili atomskom skupinom. npr. ALKAN + HALOGEN → HALOGENALKAN + HALOGENOVODIK

Uporaba alkana • gorivo u kućanstvima (zemni plin) • upaljači na ukapljeni plin • male plinske boce za izletnike punjene butanom, butanska boca • plin u automobilu

Nezasićeni ugljikovodici – alkeni i alkini • organski spojevi • sastoje se od ugljika i vodika • ugljikovi su atomi u lancu osim jednostrukim, povezani barem jednom dvostrukom (alkeni) ili trostrukom vezom (alkini) • na ostale se veze na ugljiku veže manji broj vodikovih atoma, pa su alkeni i alkini nezasićeni ugljikovodici • ime alkena završava nastavkom –en, a alkina nastavkom –in (npr. eten, propen, etin, propin. . . ) Propen u olimpijskoj baklji

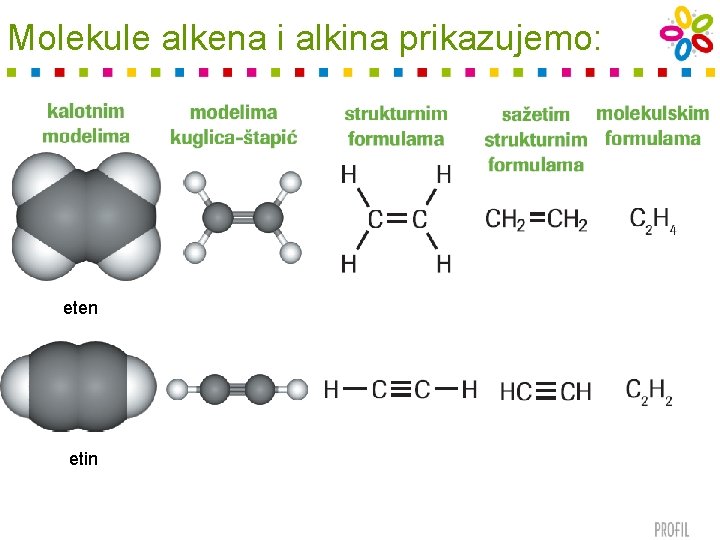
Molekule alkena i alkina prikazujemo: eten etin

Nomenklatura alkena i alkina Kod imenovanja alkena i alkina s više od tri ugljikova atoma bitno je uočiti na kojem se ugljikovom atomu nalazi dvostruka ili trostruka veza. Tu brojku treba upisati u imenu između korijena riječi i nastavka. Ugljikovi se atomi u lancu uvijek broje s onoga kraja kojemu je dvostruka ili trostruka veza bliža, npr. :

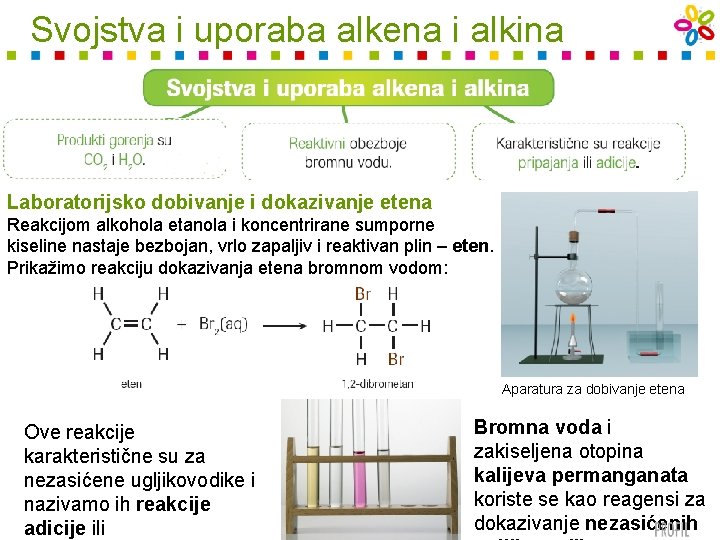
Svojstva i uporaba alkena i alkina Laboratorijsko dobivanje i dokazivanje etena Reakcijom alkohola etanola i koncentrirane sumporne kiseline nastaje bezbojan, vrlo zapaljiv i reaktivan plin – eten. Prikažimo reakciju dokazivanja etena bromnom vodom: Aparatura za dobivanje etena Ove reakcije karakteristične su za nezasićene ugljikovodike i nazivamo ih reakcije adicije ili Bromna voda i zakiseljena otopina kalijeva permanganata koriste se kao reagensi za dokazivanje nezasićenih

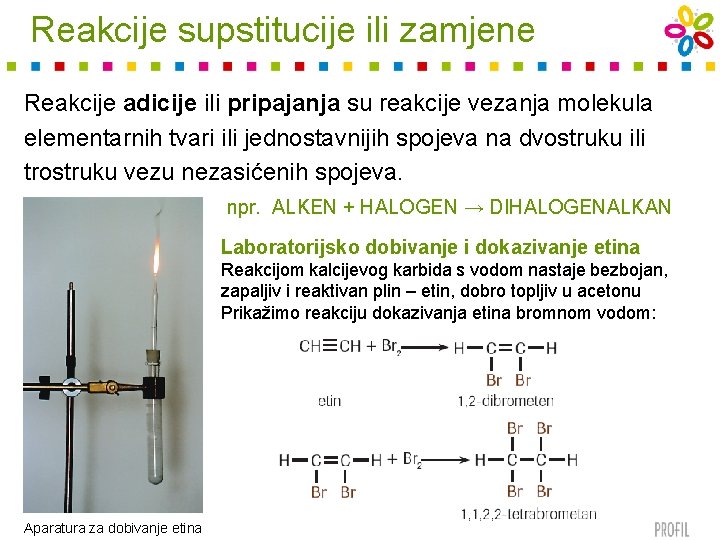
Reakcije supstitucije ili zamjene Reakcije adicije ili pripajanja su reakcije vezanja molekula elementarnih tvari ili jednostavnijih spojeva na dvostruku ili trostruku vezu nezasićenih spojeva. npr. ALKEN + HALOGEN → DIHALOGENALKAN Laboratorijsko dobivanje i dokazivanje etina Reakcijom kalcijevog karbida s vodom nastaje bezbojan, zapaljiv i reaktivan plin – etin, dobro topljiv u acetonu Prikažimo reakciju dokazivanja etina bromnom vodom: Aparatura za dobivanje etina

Uporaba alkena i alkina Uporaba etena: • • • Eten se u praksi često naziva etilen i koristi se kao sirovina u proizvodnji plastičnih masa. Neki derivati etena rabe se kao sredstvo za kemijsko čišćenje odjeće. Eten pospješuje sazrijevanje voća i povrća, pa se njime u hladnjačama, prije izlaska na tržnice, tretira zeleno voće i povrće. Uporaba etina: • • Uobičajeno ime etina je acetilen. Koristi se kao osnovna sirovina za proizvodnju plastičnih masa i mnogih drugih organskih spojeva. Izgaranjem etina u kisiku postiže se temperatura i do 3 000 °C – koristi se za rezanje i zavarivanje metala. Etin sa zrakom čini eksplozivnu smjesu, pa se zbog sigurnosti otapa u organskom otapalu acetonu i transportira u čeličnim bocama.

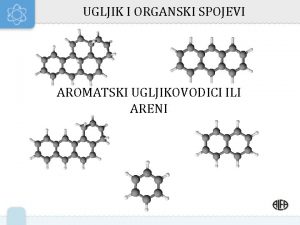
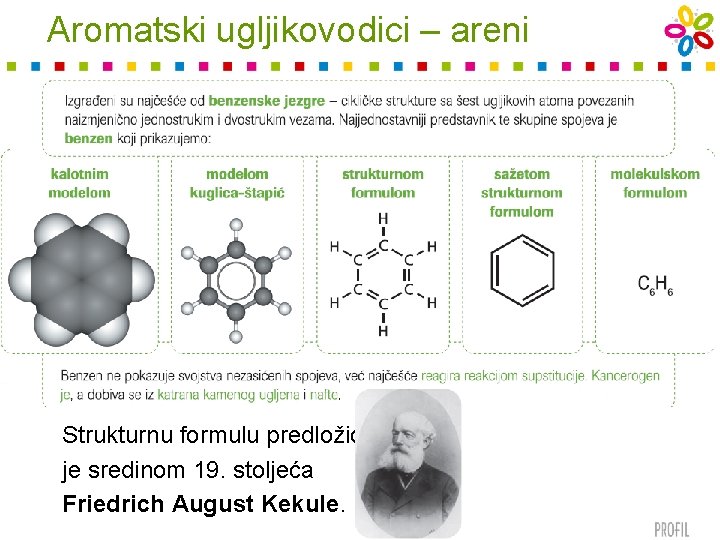
Aromatski ugljikovodici – areni Strukturnu formulu predložio je sredinom 19. stoljeća Friedrich August Kekule.

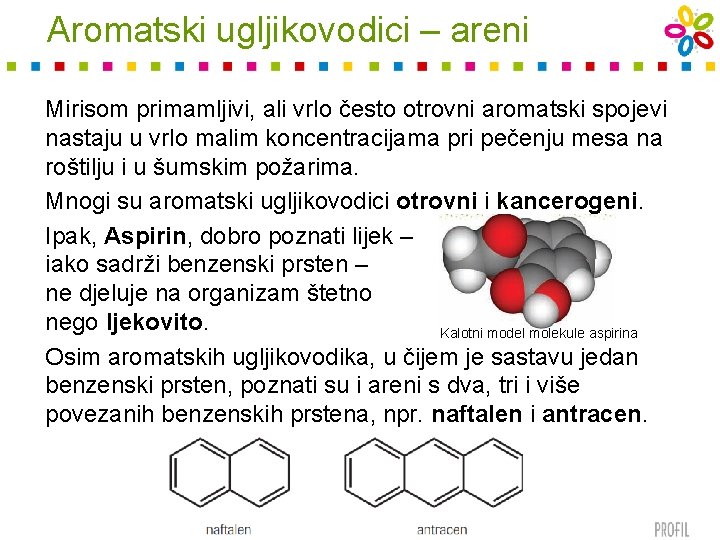
Aromatski ugljikovodici – areni Mirisom primamljivi, ali vrlo često otrovni aromatski spojevi nastaju u vrlo malim koncentracijama pri pečenju mesa na roštilju i u šumskim požarima. Mnogi su aromatski ugljikovodici otrovni i kancerogeni. Ipak, Aspirin, dobro poznati lijek – iako sadrži benzenski prsten – ne djeluje na organizam štetno nego ljekovito. Kalotni model molekule aspirina Osim aromatskih ugljikovodika, u čijem je sastavu jedan benzenski prsten, poznati su i areni s dva, tri i više povezanih benzenskih prstena, npr. naftalen i antracen.

Izomerija Spojevi koji imaju istu molekulsku formulu, ali različit način međusobna povezivanja ugljikovih atoma u molekuli, tj. različitu strukturu, nazivaju se izomeri, a pojava izomerija. Na primjerima ćemo upoznati osnovna pravila za izvođenje imena ugljikovodika:

Ponovimo zajedno! 1. Među navedenim molekulskim formulama odaberi one koje pripadaju alkanima: a) C 3 H 6, b) C 5 H 12, c) C 6 H 12, d) C 2 H 2, e) C 7 H 14, f) C 4 H 10. 2. Ako atom ugljika u molekuli alkana ostvaruje dvije veze sa susjednim atomima ugljika, koliko će veza ostvariti s atomima vodika? Obrazloži odgovor i potkrijepi ga strukturnom formulom jednog alkana. 3. Možeš li promatrajući model molekule pentena dobiti više podataka nego iz molekulske formule kojom ga prikazujemo? Obrazloži odgovor.

Ponovimo zajedno! 4. Izvedi sažetu strukturnu formulu zasićenog ugljikovodika molekulske formule C 6 H 14 i imenuj ga. 5. Prikaži kemijskom jednadžbom gorenje zasićenog ugljikovodika iz prethodnoga zadatka i imenuj produkte gorenja. 6. Koji od navedenih spojeva neće obezbojiti bromnu vodu: acetilen (etin), butan, buten, benzen, eten, heksen? 7. Prikaži kemijskim jednadžbama reakcije: a) etan + 2 molekule klora b) etin + 2 molekule klora. 8. Prikaži strukturnu formulu benzena. Objasni zašto se benzen često prikazuje kao šesteročlani prsten s upisanom kružnicom. 9. Izvedi sažete strukturne formule za molekule: a) 1, 2 -dibrometen b) 1 -klor-2 -metilpropan.

Ponovimo zajedno! 10. Molekulska formula otrovnog spoja dioksina C 12 H 4 Cl 4. Jesu li maseni udjeli vodika i klora u toj molekuli jednaki? Odgovor potvrdi računom. 11. Pomiješamo u epruveti 5 m. L vode i 2 m. L benzena te promućkamo. Nakon kratkog vremena u epruveti se vide dva sloja. Sloj benzena nalazi se na sloju vode. a) Koja smo svojstva benzena dokazali pokusom? b) Možeš li plamen benzena gasiti vodom? c) Napiši jednadžbu gorenja benzena. d) Smijemo li udisati pare benzena? Objasni odgovor. 12. Napiši sažete strukturne formule spojeva: heks-2 -en i 2, 2 -dimetilheksana te napiši još po dva izomera istih molekulskih formula i imenuj ih.
 Je vodík nekov
Je vodík nekov Nascentní vodík
Nascentní vodík Praskavi plin
Praskavi plin Vodík palivo budoucnosti
Vodík palivo budoucnosti Hygroskopické látky
Hygroskopické látky Dici è faticoso frequentare i bambini
Dici è faticoso frequentare i bambini Piove di montale e la pioggia nel pineto
Piove di montale e la pioggia nel pineto Nita mosby tyler
Nita mosby tyler Dr lucian chirila
Dr lucian chirila Dr silaghi tiberiu
Dr silaghi tiberiu Ejemplos de conclusiones de un informe
Ejemplos de conclusiones de un informe Električna svojstva materijala
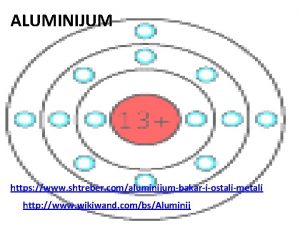
Električna svojstva materijala Fizicka svojstva aluminijuma
Fizicka svojstva aluminijuma Masti i ulja hemija prezentacija
Masti i ulja hemija prezentacija Svojstva alkohola
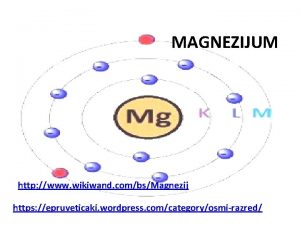
Svojstva alkohola Fizicka svojstva magnezijuma
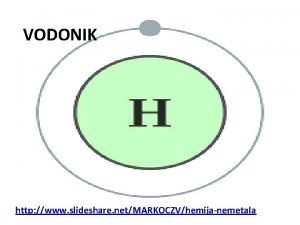
Fizicka svojstva magnezijuma Dobijanje vodonika
Dobijanje vodonika Svojstva supstanci
Svojstva supstanci Svojstva masti i ulja
Svojstva masti i ulja Predmeti od gume
Predmeti od gume