Uvod u organsku hemiju Organska hemija je hemija







- Slides: 9

Uvod u organsku hemiju

Ø Organska hemija je hemija ugljenikovih jedinjenja. Ø Ugljenih gradi veoma mali broj neorganskih jedinjenja: ugljenik(IV)oksid, ugljenik(II)oksid, ugljenu kiselinu i njene soli karbonate i bikarbonate. Ø Sva ostala jedinjenja ugljenika (preko 20 miliona danas poznatih) ubrajamo u organska jedinjenja. Ø Danas je poznat ogroman broj orgnaskih jedinjenja. Da bi se organska hemija lakše izučavala neikm jedinjenjima pridaje se posebna važnost. To su jedinjenja koja se nalaze u živom svetu ili jedinjenja koja nalaze praktičnu primenu.

Sinteza karbamida (uree) iz amonijum-cijanida koju je izveo Fridrih Veler 1828. bila je prva laboratorijska sinteza nekog organskog jedinjenja. Nakon čega je razvoj organske hemije bio rapidan.

Osobine ugljenikovog atoma Ø Ø Ugljenik je element četvrte grupe i druge periode PSE-a atomskog broja šest, relativne atomske mase 12 i elektronske konfiguracije [He]2 s 2, 2 p 2. U organskim jedinjenjima uvek je i samo četvorovalentan. Važna osobina ugljenika je hibridizacija orbitala (uglovi između hibridizovanih orbitala su najveći mogući, što daje veliku stabilnost ugljenikovim jedinjenjima)

Za karakterizaciju organskih jedinjenja obično se koriste: 1. tačka ključanja 2. tačka topljenja 3. rastvorljivost 4. boja 5. miris. . . Usled prisustva ugljenikovih atoma i kovalentnih veza organska jedinjenja pokazuju neke osobine po kojima se razlikuju od neorganskih jedinjenja. Neke od tih osobina su: 1. Većina se ugljeniše usled zagrevanja i sagoreva bez ostatka 2. Većina se topi na temperaturama ispod 300 C° 3. Većina ključa na veoma niskim temperaturama 4. Većina je nerastvorljiva u neorganskim rastvaračima, ali se veoma dobro rastvara u organskim kao što je na primer alkohol 5. Većina hemijskih reakcija organskih jedinjenja su molekulske i vrše se veoma sporo 6. Većina organskih jedinjenja elektroliti

Struktura organskih jedinjenja Da bi se mogle objasniti osobine organskih jedinjenja potrebno je znati iz kojih atoma se sastoji i koliko atoma ulazi u sastav datog molekula. Da bi se to saznalo potrebno je znati molekulsku formulu. Ipak poznavanje molekulske formule nekog jedinjenja daje veoma malo podataka o osobinama tog jedinjenja. Na primer molekulska formula C 2 H 6 O može da odgovara za dva u potpunosti različita jedinjenja. Ona odgovara etanolu ali odgovara i dimetil-etru. Kod etanola kiseonik je vezan za ugljenik i vodonik a kod dimetil-etra kiseonik je vezan za dva ugljenikova atoma. etanol dimetil-etar

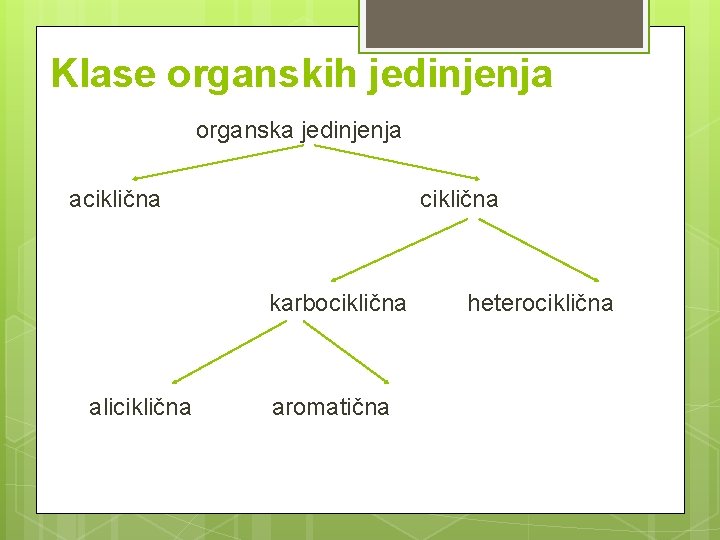
Klase organskih jedinjenja organska jedinjenja aciklična karbociklična aliciklična aromatična heterociklična

Funkcionaln grupe Funkcionalna grupa. Funkcinalnim grupama zovemo grupe atoma koje nekoj grupi organskih jedinjenja daju karakteristične osobine. Najvažnije funkcionalne grupe: 1. Hidrokslilna grupa (-OH), CH 3 CH 2 OH alkoholi (etanol) Fenoli 2. Karbonilna grupa (), CH 3 ketoni (propanon) 3. Karboksilna grupa (-COOH), H-COOH organske kiseline (metanska kiselina)

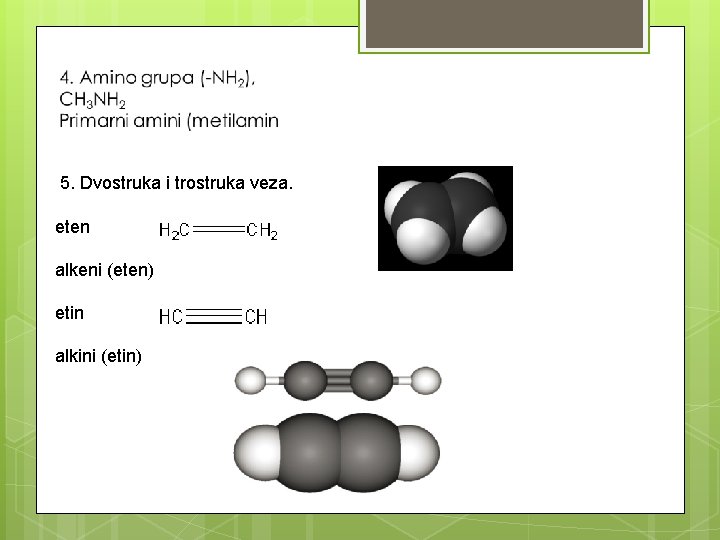
5. Dvostruka i trostruka veza. eten alkeni (eten) etin alkini (etin)