HEMIJA KARBOKSILNE KISELINE PREDAVA Saa Stevanovi Organska jedinjenja

HEMIJA KARBOKSILNE KISELINE PREDAVAČ: Saša Stevanović

§ Organska jedinjenja koja sadrže karboksilnu grupu ( - COOH ) zovu se karboksilne kiseline § Opšta formula karboksilnih kiselina je

NOMENKLATURA (ČITANJE) Ø IUPAC sistem Uzima se ime zasićenog ugljovodonika koji ima isti broj C-atoma kao i najduži niz koji sadrži karboksilnu grupu, pa se njemu doda nastavak -ska kiselina. l Primer: l

PODELA § Prema broju karboksinih grupa kiseline se dele da monokarboksilne, dikarboksilne i polikarboksilne. COOH HCOOH CH 3 COOH mravlja kiselina sirćetna kiselina MONOKARBOKSILNE oksalna DIKARBOKSILNA

§ § § Prema tipu veze koju sadrže karbokssilne kiseline se dela na zasićene i nezasićene Zasićene kiseline su one koje sadrže samo jednostruke veze između C-atoma. Nezasićene kiseline su one koje pored jednostrukih sadrže i dvostruke ili trostruke veze između C-atoma.

HOMOLOGI RED FORMULA HCOOH CH 3 CH 2 COOH CH 3 CH 2 CH 2 CH 2 CH 2 COOH NAZIV METANSKA PROPANSKA BUTANSKA PENTANSKA HEKSANSKA HEPTANSKA

VIŠEMASNE KISELINE Višemasne karboksilne kiseline su biološki važne kiseline pošto ulaze u sastav masti i ulja. § Višemasne karboksilne kiseline su na sobnoj temperaturi čvrste bele supstancije bez mirisa. § U sastav masti ulaze zasićene kiseline a u sastav ulja nezasićene višemasne kiseline. §

Zasićene kiseline: CH 3 -(CH 2)14 -COOH palmitinska CH 3 -(CH 2)16 -COOH stearinska Nezasićene kiseline: CH 3 -(CH 2)7 -CH=CH- (CH 2)7 -COOH oleinska

DOBIJANJE a) Iz Grinjarovog reagensa b) Oksidacijom primarnih alkohola R-CH 2 -OH + 2 O R-COOH + H 2 O

FIZIČKE OSOBINE § § Karboksilne kiseline sa manjim brojem ugljenikovih atoma se dobro rastvaraju u vodi zbog polarnosti karboksilne grupe. Sa povećanjem broja ugljenikovih atoma polarnost molekula se smanjuje pa se smanjuje i rastvoljivost u vodi, tako da su kiseline sa većim brojem C-atoma nerastvorne u vodi. Kiseline koje imaju od 1 do 3 C-atoma imaju oštar miris, od 4 do 6 C-atoma neprijatan miris, a one sa većim brojem C-atoma nemaju miris. Kiseline sa manjim brojuem C-atoma su tečne a one sa većim brojem C-atoma su čvrstog agregatnog stanja.
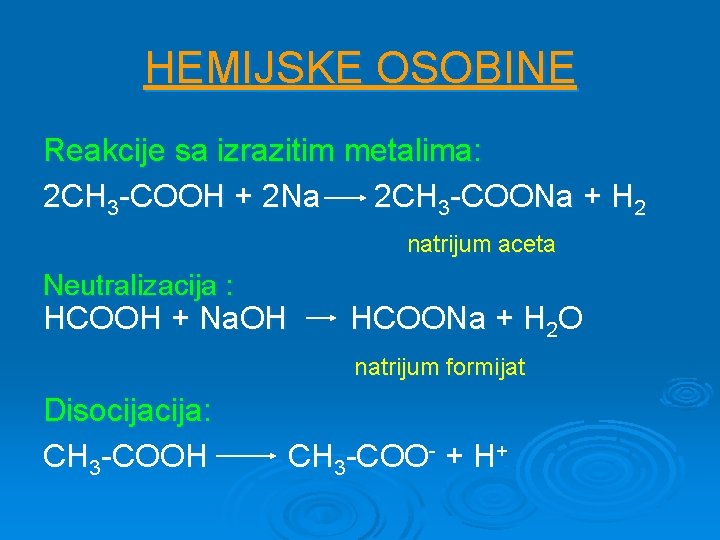
HEMIJSKE OSOBINE Reakcije sa izrazitim metalima: 2 CH 3 -COOH + 2 Na 2 CH 3 -COONa + H 2 natrijum aceta Neutralizacija : HCOOH + Na. OH HCOONa + H 2 O natrijum formijat Disocija: CH 3 -COOH CH 3 -COO- + H+
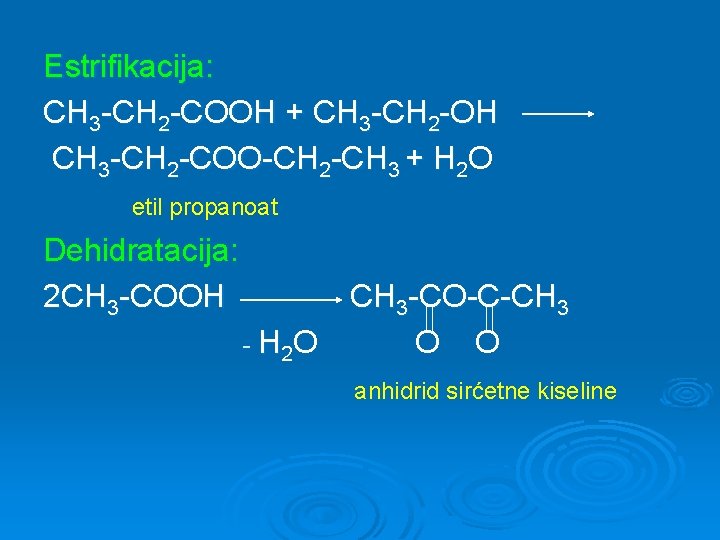
Estrifikacija: CH 3 -CH 2 -COOH + CH 3 -CH 2 -OH CH 3 -CH 2 -COO-CH 2 -CH 3 + H 2 O etil propanoat Dehidratacija: 2 CH 3 -COOH - H 2 O CH 3 -CO-C-CH 3 O O anhidrid sirćetne kiseline

PRIMENA Vodeni rastvor sirćetne kiseline se skoro svakodnevno koristi u ishrani kao sirće. Karboksilne kiseline se koriste za dobijanje estara koji se dalje koriste kao rastvarači boja i lakova ili kao mirisne supstance u parfemima. Karboksilne kiseline imaju primenu u hemijskoj industriji kao polazne sirovine.
- Slides: 13