UPOREDNI PREGLED SVOJSTAVA NEMETALA ELEMENATA 18 17 16




























- Slides: 31

UPOREDNI PREGLED SVOJSTAVA NEMETALA ELEMENATA 18, 17, 16, 15 I 14 GRUPE PSE


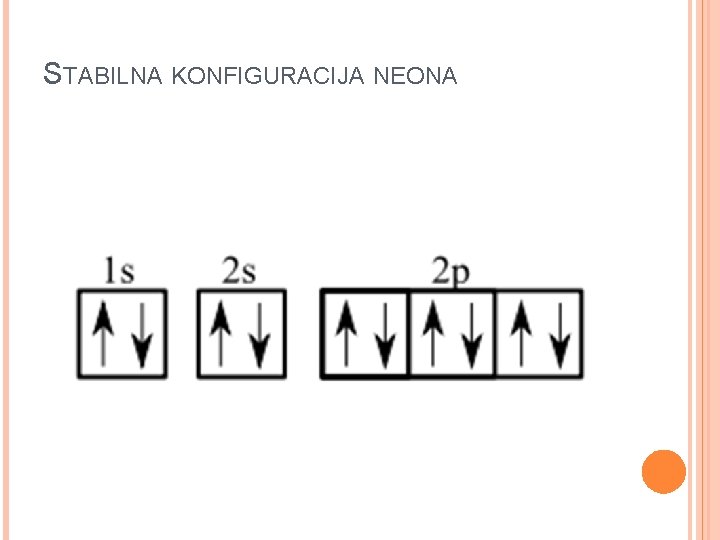
PLEMENTI GASOVI – 18 GRPSE Su He, Ne, Ar, Kr, Xe i Rn Imaju stabilnu konfiguraciju od 8 e na poslednjem energetskom nivou osim He koji ima 2 e (1 s 2) ns 2 np 6 Orbitale su maksimalno popunjene i svi elektroni spareni Zato se plemeniti gasovi nalaze u monomolekulskom obliku za razliku od ostalih gasovitih elemenata O 2, Cl 2, N 2. . . Nereaktivni jer su svi elektroni spareni.

STABILNA KONFIGURACIJA NEONA

JEDINJENJA PLEMENITIH GASOVA Plemeniti gasovi mogu da grade jedinjenja iako imaju veoma stabilnu elektronsku konfiguraciju. Čvrsto žuto kompleksno jedinjenje ksenonheksafluoroplatinat, Xe. Pt. F 6 Do danas je napravljeno više stotina jedinjenja ksenona; npr. sa fluorom Xe. F 2 , Xe. F 4 , Xe. F 6 ; sa kiseonikom Xe. O 3. Neka od njih su veoma stabilna, kao na primer Rb 2 Xe. F 8 koji se ne razlaže ni na 400°C. Dobijena su i neka jedinjenja kriptona i radona. Jedinjenja plemenitih gasova nemaju praktičnu primenu, te njihovo dobijanje ima samo teorijsku vrednost

ELEMENTI 17 GRUPE HALOGENI ELEMENTI To su Fluor(F), hlor (Cl), brom (Br), jod (J) i astat (At) F žuto-zeleni gas, Cl zeleno-žuti gas, Br jedini tečni nemetal crveno-smeđe boje, Jod crna čvrsta supstanca metalnog sjaja Promena agregatnog stanja zbog porasta atomskog radijusa Elektronske konfiguracije ns 2 np 5 1 nespareni e u p orbitali Do stabilne konfiguracije nedostaje 1 e i zato grade jedinjenja u kojima su XCl, Br i J grade jedinjenja sa pozitivnim oksidacionim brojem +1, +3, +5 i +7 kada raspare e i prebace u d podnivo F nema na drugom nivo d orbitale Grade dvoatomne molekule X 2

Hlor

ELEMENTI 17 GRUPE HALOGENI ELEMENTI Veoma reaktivni , reaguju sa skoro svim elementima Sličnost u hemijskom ponašanju, razlike samo u intenzitetu Najreaktivniji fluor a najmanje jod jer elektron dolazi na drugi energetski nivo i najjače ga privlači Grade halogenovodonične kiseline HF-fluorovodonična HCl- hlorovodonična, HBrbromovodonična, HJ- jodovodonična HF, HCl, HBr, HJ otrovni gasovi, njihovi vodeni rastvori su kiselog karatera Jačina raste od HF do HJ tj. HJ najjača, HF najslabija Soli fluoridi, hloridi, bromidi , jodidi

ELEMENTI 17 GRUPE HALOGENI ELEMENTI Osim fluora grade kiseonične kiseline HXO , HXO 2, HXO 3, HXO 4 X=Cl, Br, J HCl. O hipohlorasta soli hipohloriti HCl. O 2 hlorasta soli hloriti HCl. O 3 hlorna soli hlorati HCl. O 4 perhlorna soli perhlorati Jačina raste od HCl. O do HCl. O 4

ELEMENTI 16 GRUPE HALKOGENI ELEMENTI To su kiseonik (O), sumpor (S), selen (Se), telur(Te) i polonijum (Po) Kiseonik je gas, sumpor žuta čvrsta amorfna(nekristalna) supstanca, selen, telur i polonijum takođe čvrste supstance Elektronske konfiguracije ns 2 np 4 Dva nesparena e u p orbitalama kiseonik samo dvovalentan -2 Sumpor -2, +4, +6 Zbog veličine atoma kiseonik O 2 i O 3 a sumpor S 4 i S 8 molekuli

KISEONIK O 2 i ozon O 3 alotropska modifikacija kiseonika O 2 gas bez boje, ukusa i mirisa, ne gori, potpomaže gorenje Dvostruka veza u molekulu Jedini se sa skoro svim elementima dajući okside

KISEONIK OKSIDI : a) kiseli nemetala, sa vodom daju kiseline SO 2+ H 2 O H 2 SO 3 B) bazni metala, sa vodom daju baze Mg. O + H 2 O Mg(OH)2 Neutralni oksidi ne reaguju sa vodom(N 2 O, CO) Mešoviti oksidi imaju element sa dve valence Pb 3 O 4 (2 Pb. O * Pb. O 2) Amfoterni: i kiseli i bazni- nekih metala Al 2 O 3+ 3 H 2 O 2 Al(OH)3 HAl. O 2 aluminati

OZON O 3 O O O gas svetlo plave boje(nebo) , svežeg mirisa, u većim koncentracijama mirisa na beli luk Štiti Zemlju od UV zračenja (ozonske rupe)

SUMPOR S 4 ako su orbitale paralelne S S, ako nisu S 8 S S S S S Takođe ima alotropske modifikacije u zavisnosti od broja S 8 molekula. Čvrst, žut, slabog mirisa, slabo se rastvara u vodi

OKSIDI SUMPORA OKSIDI SO 2 sumpor (IV) oksid i SO 3 sumpor (VI) oksid Gasovi otrovni neugodnog mirisa, kiseli, sa vodom grade kiseline S + O 2 SO 2 2 SO 2 + O 2 2 SO 3

SUMPOR KISELINE SUMPORA H 2 S- gas bez boje, mirisa na pokvarena jaja, otrovan, vodeni rastvora kiselog karaktera sumporvodonična kiselina, slaba kiselina, soli SULFIDI H 2 SO 3 - sumporasta kiselina, nastaje rastvaranjem SO 2 u vodi, slaba kiselina, soli SULFITI H 2 SO 4 - sumporna kiselina, nastaje rastvaranjem SO 3 u vodi, jedna od najjačih kiselina (HCl. O 4 iste jačine), jako oksidaciono i dehidrataciono sredstvo Soli SULFATI Najpoznatiji sulfati plavi kamen, zeleni kamen i gips

ELEMENTI 15 GRUPE To su azot(N), fosfor (P), arsen (As), antimon (Sb) i bizmut (Bi) Azot i fosfor nemetali, As i Sb metaloidi a Bi metal Elektronske konfiguracije ns 2 np 3 Tri nesparena e Grade kovalentna jedinjenja sa +3 i +5 Azot N 2 molekul sa trostrukom vezom, gas, ostali višeatomni molekuli, čvrsti

AZOT Gas bez boje, ukusa i mirisa, ne gori i ne potpomaže gorenje, slabo reaktivan jer je molekul N 2 veoma stabilan (trostrukom vezom povezani) Ima ga slobodnog u vazduhu 78% (inertan gas) Ipak gradi veliki broj jedinjenja Pet oksida N 2 O, N 2 O 3, NO 2, N 2 O 5 Svi gasovi, otrovni N 2 O „smejavac“ neutralan N 2 O 3 i. N 2 O 5 kiseli oksidi

AMONIJAK - NH 3 Sa H gradi NH 3 amonijak, gas, neprijatnog mirisa na urin, otrovan Dobro se rastvara u vodi i gradi amonijum hidroksid baznog karaktera NH 3 + H 2 O → NH 4 OH → NH 4+ + OH

AZOT KISELINE AZOTA : HNO 2 - azotasta kiselina, slaba kiselina soli NITRITI HNO 3 - azotna kiselina, jaka kiselina, soli NITRATI, jako oksidaciono sredstvo

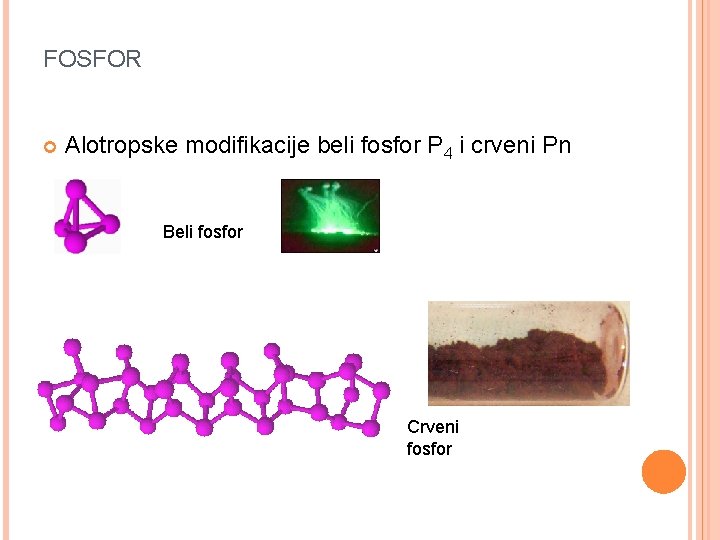
FOSFOR Alotropske modifikacije beli fosfor P 4 i crveni Pn Beli fosfor Crveni fosfor

FOSFOR Beli fosfor nestabilan, veoma reaktivan, samozapaljiv, svetluca u mraku(fosforescencija), čuva se pod petroleumu, jak otrov, u dodiru sa kožom stvara teške rane (napalm bombe) Crveni fosfor stabilniji od belog, manje reaktivan, nije zapaljiv, ne svetluca

FOSFOR Sa H gradi PH 3 gas fosfin, mirisa na trulu ribu (riba ima mnogo fosforovih jedinjenja), veoma otrovan, slabo se rastvara u vodi, nije bazan kao NH 3 OKSIDI FOSFORA P 4 O 6 i P 4 O 10 čvrsti, kiseli oksidi, sa vodom grade kiseline KISELINE FOSFORA H 2 PHO 3 - fosforasta kiselina, slaba kiselina soli FOSFORITI H 3 PO 4 - fosforna kiselina srednje jačine, soli FOSFATI

OKSIDI FOSFORA I KISELINE FOSFORA OKSIDI FOSFORA P 4 O 6 i P 4 O 10 čvrsti, kiseli oksidi, sa vodom grade kiseline P 4 O 10 sa vlagom iz vazduha daje beo dim- dimne bombe KISELINE FOSFORA H 2 PHO 3 - fosforasta kiselina, slaba kiselina soli FOSFORITI H 3 PO 4 - fosforna kiselina srednje jačine, soli FOSFATI

ELEMENTI 14 GRUPE To su ugljenik (C), silicijum (Si), germanijum (Ge), kalaj (Sn) i olovo (Pb) C nemetal, Si metaloid i metalna svojstva rastu Elektronske konfiguracije ns 2 np 2 Dva nesparena elektrona i jedna prazna p orbitala, zato s elektron lako prelazi u praznu p orbitalu i onda 4 nesparena elektrona tako da su četvorovalentni

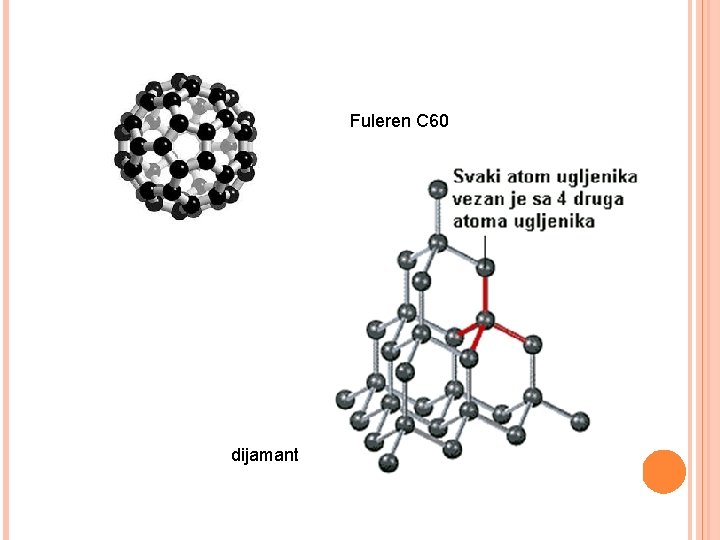
Alotropske modifikacije C: dijamant i grafit i fuleren dijamant grafit

Fuleren C 60 dijamant

UGLJENIK Dijamant beskonačna prostorna rešetka, ne provodi struju i toplotu, najtvrđa prirodna supstanca, 1 C povezan sa 4 C, svi elektroni u vezama, prelama svetlost, blještav, providan Grafit slojevite strukture, u sloju povezani šestouglovi , 1 C povezan sa 3 C, tako da ima slobodan elektro pa provodi struju i toplotu, mekan, skidaju se slojevi pri pisanju, metalnog sjaja

UGLJENIK Molekul C 60 -fuleren, gradi kristalnu formu koja po svojoj simetričnosti spada u najviši rang uređenosti. Kao individualni molekul, C 60 čvršći je od dijamanta, međutim, kada kristališe, kristalna rešetka mu je meka skoro kao kod grafita. Kako C 60 ima osu petog reda, to su njegova struktura i energetska stanja vrlo stabilan, molekul C 60 je neočekivano reaktivan, tako da je danas poznato više od 6500 potpuno novih jedinjenja na bazi ovog molekula.

UGLJENIK Na sobnoj temperaturi slabo reaktivan, na povišenoj veoma reaktivan OKSIDI C: 2 C+O 2 2 CO C+O 2 CO 2 Dva oksida CO ugljenik (II) oksid, otrovan gas, krvni otrov, bez boje, ukusa i mirisa, lakši od vazduha, neutralan oksid CO 2 - ugljen (IV)oksid, gas, bezboje, ukusa i mirisa, nije otrovan, teži od vazduha pa može izazvati gušenje(nedostatak kiseonika), kiseo oksid CO 2 + H 2 O H 2 CO 3 1% EFEKAT STAKLENE BAŠTE

UGLJENIK KISELINE C H 2 CO 3 - ugljena kiselina, slaba kiselina, soli KARBONATI- soda bikarbona Na. HCO 3 natrijum hidrogenkarbonat HCN-Cijanovodonik, gas bez boje, mirisa na gorki badem, veoma otrovan, rastvara se u vodi i daje cijanovodoničnu kiselinu , slaba kiselina , soli CIJANIDI takođe otrovni –KCN cijankalij – jak otrov
 Uporedni metod u sociologiji
Uporedni metod u sociologiji Tup ugao
Tup ugao Opruženi ugao
Opruženi ugao Zahtev za sanitarni pregled
Zahtev za sanitarni pregled Ich du er sie es wir ihr sie
Ich du er sie es wir ihr sie Istorija periodnog sistema elemenata
Istorija periodnog sistema elemenata Mendeljejeva tablica
Mendeljejeva tablica Pregled sinonim
Pregled sinonim Pozitivni i negativni prostor plohe
Pozitivni i negativni prostor plohe Kruzenje kiseonika u prirodi
Kruzenje kiseonika u prirodi Jedinjenja bora
Jedinjenja bora Periodni sistem elemenata prezentacija
Periodni sistem elemenata prezentacija Valencije
Valencije Kodomen funkcije zadaci
Kodomen funkcije zadaci 14 grupa pse
14 grupa pse Zdravstveni pregled s svetovanjem
Zdravstveni pregled s svetovanjem Sistematski pregled slavonski brod
Sistematski pregled slavonski brod Mikciona cistouretrografija
Mikciona cistouretrografija Naponski niz elemenata
Naponski niz elemenata Koliko ce se dobiti grama hlornog kreca
Koliko ce se dobiti grama hlornog kreca Otvoreni strujni krug
Otvoreni strujni krug Elementi 16 grupe
Elementi 16 grupe Odnos masa elemenata
Odnos masa elemenata Sistematski pregled 1 razred
Sistematski pregled 1 razred Prelazni elementi
Prelazni elementi Savska dom zdravlja
Savska dom zdravlja Lekarski za sportiste
Lekarski za sportiste Tehnicki pregled izduvni gasovi
Tehnicki pregled izduvni gasovi Pooblaščeni izvajalci kontrolnih zdravstvenih pregledov
Pooblaščeni izvajalci kontrolnih zdravstvenih pregledov Mendeljejev periodni sistem elemenata
Mendeljejev periodni sistem elemenata