ELEMENTI VII A GRUPE PERIODNOG DISTEME Halogeni elementi













- Slides: 16

ELEMENTI VII- A GRUPE PERIODNOG DISTEME

Halogeni elementi Elementi VIIa grupe nazivaju se halogenim elementima. Grupu čine nemetali: fluor (F), hlor (Cl), brom (Br), jod (I) i metaloid astat (At), nedovoljno ispitani radioaktivni element s malim poluvremenom raspadanja. Zajednička konfiguracija za elemente ove grupe je: n. S 2 np 6, sa nesparenim elektronom u r orbitali. U elementarnom stanju ovi elementi se javljaju u vidu dvoatomnih molekula. Atomi u molekulu vezani su jednostrukom kovalentnom vezom. Svi elektroni su spareni. Veze između molekula su slabe, potiču od van der Valsovih privlačnih sila. Sa porastom atomskog broja elemenata rastu i atomske zapremine, privlačne sile među molekulima, temperatura topljenja i ključanja. Fluor i hlor su gasovi, brom je tečnog, a astat čvrstog agregatnog stanja. Boja elemenata sa porastom atomskog broja postaje sve tamnija. Svi su oštrog mirisa, otrovnog dejstva. Udisanje malih količina halogena izaziva nadražaj organa za disanje, upalu sluzokože nosa i grla, dok veće količine izazivaju trovanje. U vodi se halogeni elementi slabo rastvaraju, a bolje u organskim rastvaračima.

Energija jonizacije i elektronegativnost opadaju sa porastom atomskog broja elemenata u grupi. Velike vrednosti prve energije jonizacije kao i visoke vrednosti koficijenata elektronegativnosti ukazuju na to da su halogeni elementi oksidaciona sredstva (primaju elektrone). Energija veze ima najveću vrednost kod hlora (iako bi se očekivalo da najveću vrednost ima fluor), a opada ka jodu. Na sličan način se menja i elektronski afinitet (najviši je kod hlora). Za ove anomalije još nema prihvatljivog objašnjenja. Redoks-potencijal i aktivnost elemenata opada analogno sa vrednostim a elektronegativnosti od fluora prema jodu. Halogeni sa većim redoks-potencijalom oksiduju ona sa manjim standardnim redoks-potencijalima. Elementi VIIa grupe pokazuju veliku sličnost u hemijskom ponašanju. Razlike se, ukoliko postoje, više iskazuju u intezitetu nego u vrsti hemijskih reakcija. To su tipični nemetali. Stupaju u reakciju sa gotovo svim elementima. U prirodi se javljaju samo u vidu jedinjenja.

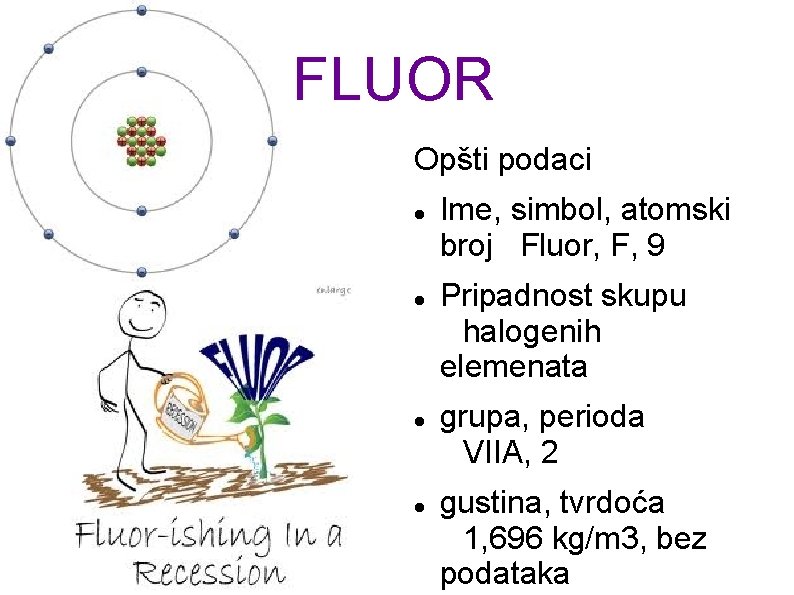
FLUOR Opšti podaci Ime, simbol, atomski broj Fluor, F, 9 Pripadnost skupu halogenih elemenata grupa, perioda VIIA, 2 gustina, tvrdoća 1, 696 kg/m 3, bez podataka

Elementarni fluor je gas žutozelene boje. On je najreaktivniji od svih elemenata. Direktno reaguje na sve metale i nemetale. Vodu razlaže gradeći fluorovodonik, HF. Reaktivnost fluora bila je dugo godina prepreka za njegovo dobijanje u elementarnom stanju. Danas se fluor industrijski dobija elektrolizom istopljenog kalijum-fluorida na anhidrovanom fluorovodoniku. U prirodi se fluor nalazi u vidu jedinjenja sa oksidacionim brojem -1 i to najčešće u vidu fluorita, Ca. F 2, i karnalita, Na 3 Al. F 6. Tragovi jedinjenja fluora nalaze se u morskoj vodi, kostima, zubima, krvi i mleku. Fluorovi derivati metana i etana su veoma slabi otroavi za razliku od ostalih jedinjenja fluora te se stoga te se zbog svoje velike inertnosti upotrebljavaju u rashladnim uređajima pod nazivom freon. Fluor se koristi i za sintezu uran-heksafluorida koji se primjenjuje u izradi nuklearnog oružija.

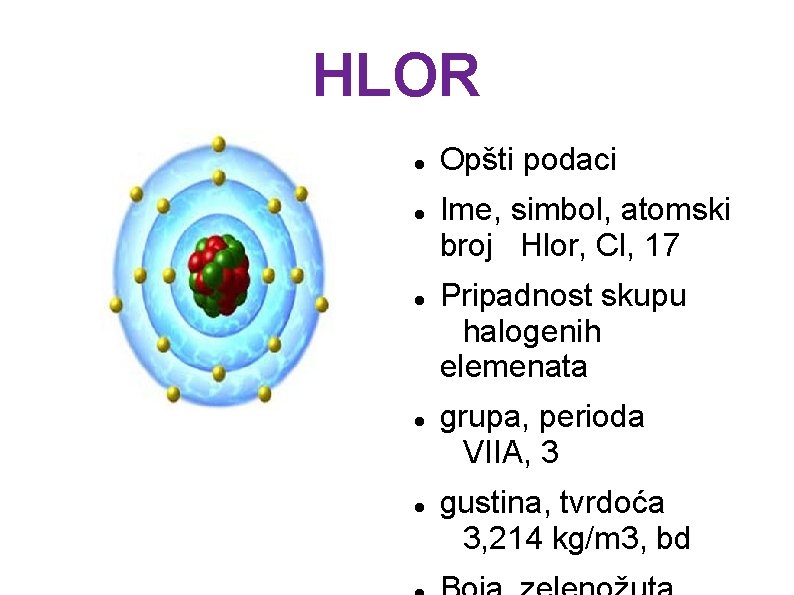
HLOR Opšti podaci Ime, simbol, atomski broj Hlor, Cl, 17 Pripadnost skupu halogenih elemenata grupa, perioda VIIA, 3 gustina, tvrdoća 3, 214 kg/m 3, bd

Hlor ili klor (Cl, latinski - chlorium, od grčke reči chloros koja znači "zelenožuti") je nemetal sa atomskim brojem 17, pripada VIIA grupi. Stabilni izotopi su mu: 35 Cl i 37 Cl. Hlor je žuto zelen gas oko 2, 5 puta teži od vazduha, neprijatnog, zagušljivog mirisa, veoma otrovan. Hlor je sredstvo za izbeljivanje i dezinfekciju. Sastojak je mnogih soli i drugih jedinjenja. Hlor je veoma rasprostranjen u prirodi i može se naći u skoro svakom živom organizmu. Hlor ima veoma velik biološki značaj, spada u makroelemente. Joni hlora su jedni od najbitnijih anjona u vodenim organizmima, a sonu kiselinu mnoge životinje koriste za varenje. U organizmu čoveka od 70 kilograma nalazi se oko 95 grama hlora.

Osobine Čist hlor se javlja u vidu dvoatomskih molekula Cl 2. U jedinjenjima se javlja sa oksidacionim brojem od -1 do +7. Hlor se dobro rastvara u vodi i gradi hlornu vodu, koja zbog nascentnog kiseonika ima baktericidno dejstvo, a služi i za beljenje organskih boja. Hlor je hemijski veoma aktivan. U prisustvu prigušene sunčeve svetlosti jedini se sa vodonikom gradeći hlorovodonik. U punoj sunčevoj svetlosti ova reakcija se odigrava eksplozivno. Hlor neposredno reaguje sa većinom elemenata i u tim reakcijama nastaju uglavnom hloridi. U jednom litru vode temperature 10 °C rastvara se 3, 10 litara hlora dok pri temperaturi od 30°C samo 1, 77 litara. Sa vodom reaguje sporo gradeći hlorovodonik i perhlornu kiselinu (HCl. O). Sa kiseonikom gradi 5 različitih oksida. Hlor gradi nekoliko kiselina i odgovarajuće soli: hlorovodoničnu (sonu) kiselinu i hloride kao soli perhlornu kiselinu i soli perhloride hlorastu kiselinu i soli hlorite hlornu kiselinu i soli hlorate

Dobijanje U labaratorijama hlor se može dobiti oksidovanjem hlorovodonične kiseline jakim oksidacionim sretstvima Mn. O 2: Mn. O 2 + 4 HCl → Mn. Cl 2 + Cl 2↑ + 2 H 2 O U industriji se dobija elektrolizom vodenog rastvora Na. Cl. Tom prilikom se dobijaju natrijum-hidroksid i hlor. Primjena Hlor se koristi za dezinfekciju vode, za dezinfekciju i izbeljivanje papira i tkanina. Korišćen je kao bojni otrov za vreme I svetskog rata, ali je zamenjen praktičnijim sredstvima. Hlor se dosta koristi za izradu produkata koji se koriste u svakodnevnici - boje, namirnice, insekticidi, plastičnih masa, naftnih produkata, lekova, rastvarača i bojnih otrova. Hlor se koristi i za dobijanje hlornog kreča i broma. Organska hemija je takođe područije na kome se primenjuje hlor. Koristi se kao oksidans, a i kao zamena za atom vodonika u organskim jedienjeima. Upotreba hlora za beljenje industrijske celuloze, lana, pamuka i dezinfekciju vode zasniva se na njegovom oksidacionom dejstvu.

Istorija Hlor je otkriven 1774 od Šelea (Carl Wilhelm Scheele) reakcijom: Mn. O 2 + Hcl za koju je pogrešno mislio da je dobio gas koji sadrži kiseonik. Ime ovom elementu je 1810 godine dao Humphry Davy, koji je utvrdio da je supstancija koju je Šele otkrio element a ne neko jedinjenje u gasovitom obliku. Zastupljenost U prirodi hlor je zastupljen u obliku jona Cl-, koji je glavni anjon u okeanima (joni hlora čine 1, 9% mase svih okeana). Još veća koncentracija hlorovih jona je u slanim jezerima (u. Mrtvom Moru oko 21%). Većina hlorida je rastvorljiva u vodi zato veće količine se mogu naći samo u suvim predelima ili u podzemnim ležištima soli. Toksičnost Gasoviti hlor nadražuje sistem za disanje i sluzne žlezde, u većim količinama izaziva smrt. U vazduhu se može osetiti već u količini od 3. 5 ppm, ali opasna koncentracija je tek preko 1000 ppm. Zbog tih osobina je korišćen kao bojni otrov u I svetskom ratu. Da bi se neutralisao udišu se pare etanola, ili razblaženog rastvora amonijaka.

Opšti podaci Ime, simbol, atomski broj Brom, Br, 35 Pripadnost skupu halogenih elemenata grupa, perioda VIIA, 4 gustina, tvrdoća 3119 kg/m 3, bez podataka Boja crvenkasta

Jedinjenja Najpoznatija jedinjenja broma su: bromovodonik (HBr) - veoma jaka kiselina, kao i njene soli natrijum bromid i kalijum broid. Veliki značaj u hemiji imaju njegove fluoridne soli Na. Br. Fx x=4, 5, 6. Bromid srebra se masovno koristi u fotografiji. Biološki značaj Brom je zastupljen u čovekovom organizmu u količini od oko 50 ppm, ali on nema nikakvu bitnu ulogu. Pare broma oštećuju sluzokožu organa za disanje, a ako dospe na kožu brom pravi rane koje veoma teško zarastaju. U velikim količinama čist brom je veoma otrovan. Njegova smrtonosna doza iznosi 35 grama. Joni broma Br- su bozopasn ukoliko njihova količina ne prelazi preko one koja je u morskoj vodi. Osobine i primena Na sobnoj temperaturi čist brom je mrkocrvena tečnost oštrog, neprijatnog mirisa, koja lako isparava. Koristi se u brojnim hemijskim reakcijama. Brom se upotrebljava i u farmaceutskoj i hemijskoj industriji.

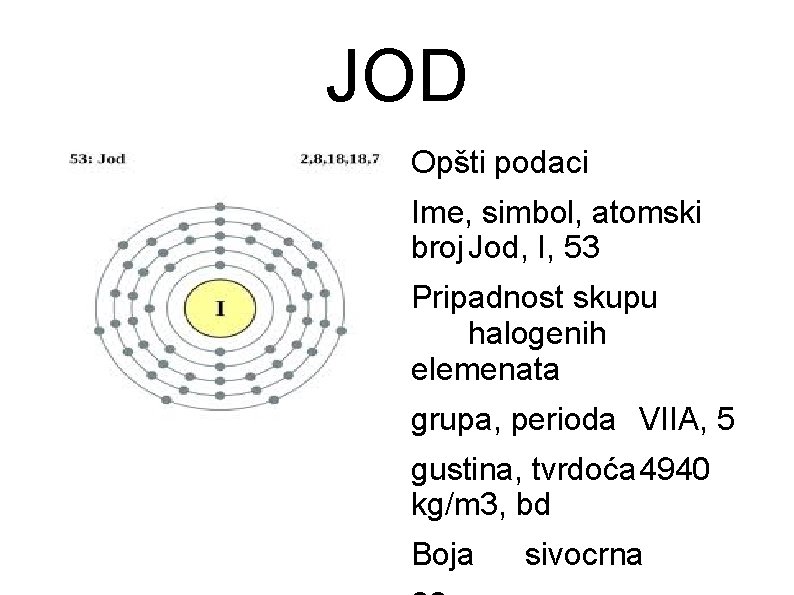
JOD Opšti podaci Ime, simbol, atomski broj Jod, I, 53 Pripadnost skupu halogenih elemenata grupa, perioda VIIA, 5 gustina, tvrdoća 4940 kg/m 3, bd Boja sivocrna

Osobine Jod spada u grupu halogenih elemenata Jod je čvrsta supstanca, tamnosive boje, metalnog sjaja. Na sobnoj temperaturi jod se javlja u čvrstom agregatnom stanju, kao sjajna plavo-crna supstanca. Pri zagrevanju jod sublimira, gradi ljubičaste pare karakterističnih mirisa koje se pri hlađenju odmah kristališu. U čistom obliku jod ima otrovno dejstvo. Postoji samo jedan postojan izotop joda u prirodi. Radioaktivni izotopi su: 123 I, 125 I, 127 I 129 I, 131 I. Jod je kao i svi halogeni elementi veoma reaktivan. U vodi se slabo rastvara, ali ga zato organski rastvarači odlično rastvaraju. Jod je jako dezinfekciono sredstvo, ubija bakterije i gljivice. Jedinjenja joda Jod gradi brojna hemijska jedinjenja u kojima se javlja sa oksidacionim brojem 1, 5 ili 7. Osobine jodovih jedinjenja su slične analognim jedinjenjima broma ili hlora. Najbolje reaguje sa metalima gradeći jodide. Najvažnija jedinjenja joda su kalijumjodid, jodoform i jodovodonik. Fluor, hlor i brom ga istiskuju iz jedinjenja, što se koristi za njegovo labaratorijsko dobijanje: KI + Br 22= KBr + I 2

ASTAT Važnije osobine Ime, simbol, atomski broj Astat, As, 85 Pripadnost skupu halogenih elemenata grupa, perioda VIIA, 6 atomska masa 210 u elektronska konfiguracija [Xe]4 f 145 d 106 s 26 p 5 e- na energetskim nivoima 2, 8, 18, 32, 18, 7 oksidacioni brojevi ± 1, 3, 5, 7 agregatno stanje čvrsto Elektronegativnost 2, 2 (Pauling) 1, 96 (Alred) Astat (As, latinski - astatium) - je halogeni element. Ime je dobio po grčkoj reči astatos koja znači nepostojan

 Bor periodni sistem
Bor periodni sistem Kiseline fosfora
Kiseline fosfora Elementi 16 grupe periodnog sistema
Elementi 16 grupe periodnog sistema S hemijski element
S hemijski element Elementi 17 grupe periodnog sistema
Elementi 17 grupe periodnog sistema Halogeni elementi
Halogeni elementi Kalaj 4 oksid
Kalaj 4 oksid Hlorni krec formula
Hlorni krec formula Halogeni elementi prezentacija
Halogeni elementi prezentacija Bromovodonik
Bromovodonik Halogeni elementi prezentacija
Halogeni elementi prezentacija Halogeni vlagomjer
Halogeni vlagomjer Pse tablica
Pse tablica Istorija periodnog sistema elemenata
Istorija periodnog sistema elemenata Kohezivnost grupe
Kohezivnost grupe Dinamika grupe
Dinamika grupe Atlantic grupa dionice
Atlantic grupa dionice