HALOGENOVODONINE KISELINE v Halogeni elementi se jedine sa






- Slides: 10

HALOGENOVODONIČNE KISELINE v. Halogeni elementi se jedine sa vodonikom pri čemu nastaju halogenovodonici koji se dobro rastvaraju u vodi v. Afinitet halogena ka vodoniku opada od fluora ka jodu zbog porasta poluprečnika halogenog elementa v. Na isti način se smanjuje i postojanost halogenovodonika

FLUOROVODONIČNA KISELINA l Nastaje rastvaranjem hlorovodonika (t. k. 20 C) u vodi HF + H 2 O ↔ H 3 O+ + F – K=? l fluorovodonična kiselina je slaba kiselina -veza između vodonika i fluora jaka - sa molekulima vode gradi vodoničnu vezu

HF nagriza sve metale osim Au, Pt i Pb l Razara staklo l Zašto? Si. O 2 + 4 HF → Si. F 4 +2 H 2 O l Sa bazama gradi soli koje podležu hidrolizi većina soli je rastvorna u vodi, osim fluorida metala II gr. Na. OH+HF → Na. F +H 2 O Na+ + F- +H 2 O → Na+ + HF + OHl

Upotreba: v Antibaktericidna svojstva- pri dobijanju alkohola alkoholnim vrenjem v Analitička hemija- rastvaranje ruda Si v Šaranje stakla v Soli HF se koriste za fluorisanje vode

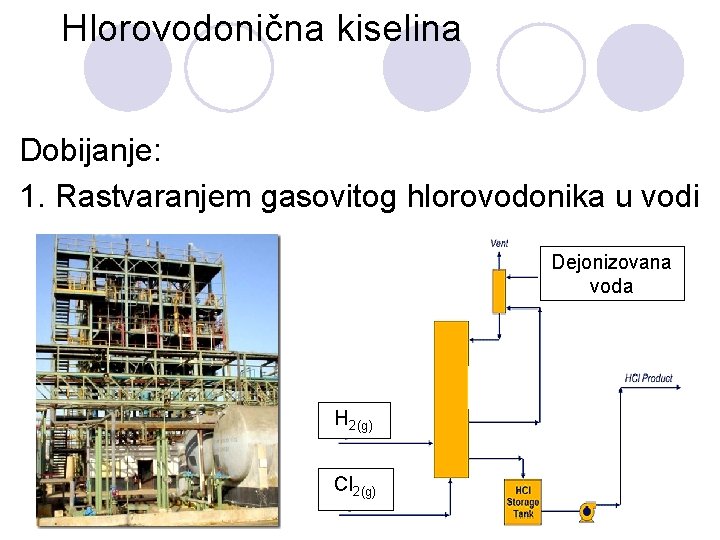
Hlorovodonična kiselina Dobijanje: 1. Rastvaranjem gasovitog hlorovodonika u vodi Dejonizovana voda H 2(g) Cl 2(g)

l Hlor i vodonik prolaze kroz kvarcni plamenik pri čemu hlor mirno gori u vodoniku bez eksplozije H 2 + Cl 2 → 2 HCl Δr. H= - 183, 5 k. J/mol HCl + H 2 O → H 3 O+ + Cl- Δr. H= -74, 9 k. J/mol l Na. Cl + H 2 SO 4 → Na. HSO 4 + HCl Na. Cl + Na. HSO 4 → Na 2 SO 4 + HCl l. U laboratoriji NH 4 Cl + H 2 SO 4 → NH 4 HSO 4 + HCl

Hlorovodonik je bezbojan gas, oštrog mirisa, kiselog ukusa na vazduhu se puši, dobro se rastvara u vodi; Max koncentracija hlorovodonika u vodi je 42, 7% v Azeotropna smeša (20% HCl i 80% vode) v Jaka kiselina – otporni na njeno dejstvo su Hg, Cu, Ag, Pb, Au i Pt v Sa nitratnom kiselinom gradi “carsku vodu” v Gradi soli –hloride ; većina rastvorna u vodi osim Ag. Cl, Cu. Cl i Hg 2 Cl 2 v

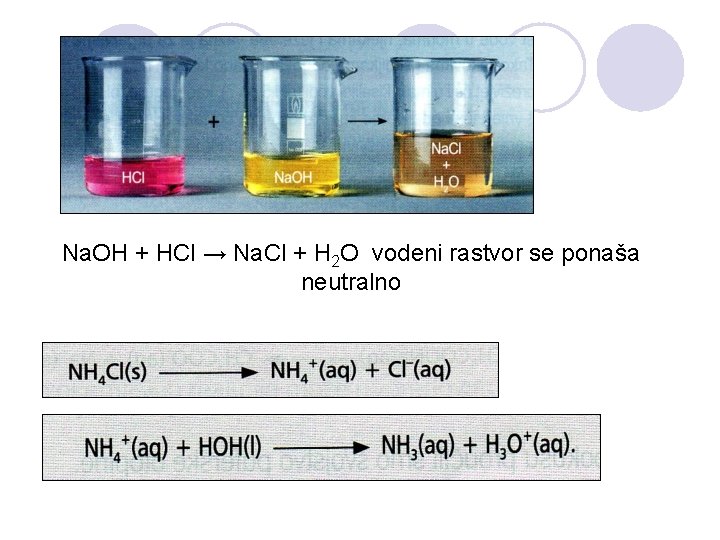
Na. OH + HCl → Na. Cl + H 2 O vodeni rastvor se ponaša neutralno

Bromovodonična kiselina l Bromovodonik je bezbojan, zagušljiv gas, na vazduhu se puši, u vodi se bolje rastvara od hlorovodonika ( jedna zapremina vode i 672 zapremina HBr) l Bromovodonična kiselina je jača od HCl l Gradi azeotropnu smešu l Stajanjem na vazduhu dobija mrku boju (Br 2) l Gradi soli bromide

Jodovodonična kiselina Jodovodonik je gas oštrog mirisa, dobro se rastvara u vodi HJ + H 2 O → H 3 O+ +J • Najjača halogenovodnična kiselina • Stajanjem na vazduhu se oksiduje; još brže na povišenoj temperaturi (redukciono sredstvo) 4 HJ + O 2 → 2 J 2 + 2 H 2 O • gradi soli jodide koji su većinom rastvorni u vodi KJ → K+ + J •