UNIVERZITET U NOVOM SADU PRIRODNOMATEMATIKI FAKULTET DEPARTMAN ZA


















- Slides: 27

UNIVERZITET U NOVOM SADU PRIRODNO-MATEMATIČKI FAKULTET DEPARTMAN ZA HEMIJU FENOLI

STRUKTURA I NOMENKLATURA • Fenoli (ili po IUPAC-u benzenoli) su jedinjenja kod kojih je OH-grupa direktno vezana za aromatično jezgro • Kod fenola postoji keto-enolna tautomerija, ali ketotautomer u ovom slučaju nije stabilnija struktura, jer nema aromatični elektronski sistem

• Rasprostranjeni su u prirodi • Imaju izraženo fiziološko dejstvo, pa nalaze primenu u medicini, zatim kao herbicidi, a pojedini su važni industrijski materijali • Prema broju hidroksilnih grupa dele se na: • monohidroksilne • dihidroksilne • polihidroksilne fenole • Nose ime po svom najjednostavnijem predstavniku fenolu, C 6 H 5 OH • Prema IUPAC nomenklaturi, hidroksi derivati benzena i ostalih aromatičnih karbocikličnih sistema imenuju se tako da se imenu ugljovodonika doda sufiks "-ol", "-diol", itd.

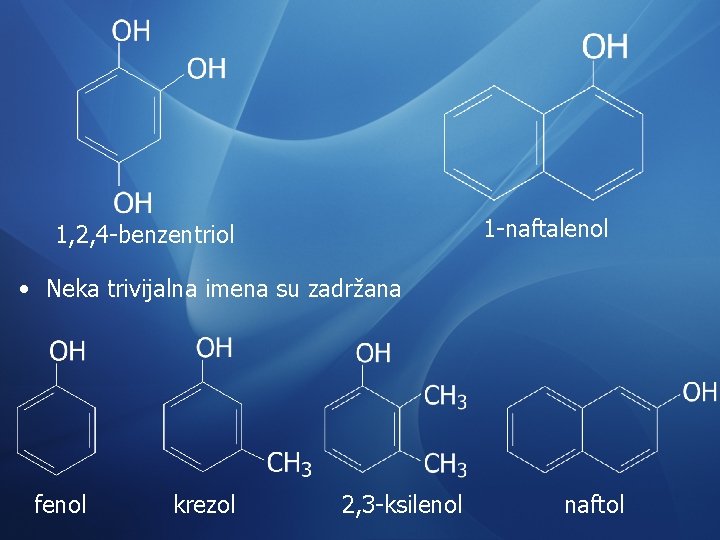
1 -naftalenol 1, 2, 4 -benzentriol • Neka trivijalna imena su zadržana fenol krezol 2, 3 -ksilenol naftol

fenantrol pirogalol pirokatehol floroglucinol rezorcinol o-hlorfenol hidrohinon p-aminofenol

DOBIJANJE FENOLA • Iz halogenarena 1 -hlor-2, 4 dinitrobenzen 2, 4 -dinitrofenol

• Hidroliza diazonijum soli - Ova reakcija teče polako na temperaturi od 0 C, dok je na povišenoj temperaturi to glavna reakcija diazonijum-soli • Iz aromatičnih sulfonskih kiselina ili njihovih soli Na-benzensulfonat Na-fenoksid

FIZIČKE OSOBINE FENOLA • Bistre tečnosti ili čvrste supstance sa niskom t. t. , ali prilično visokom t. k. • Sam fenol je donekle rastvoran u vodi (9 g u 100 g vode na 25 C), uglavnom zbog vodoničnih veza koje gradi sa vodom • Ukoliko nisu prisutne neke grupe koje uzrokuju obojenost, sami fenoli su bezbojni. Međutim, lako se oksidišu. Zato, ukoliko nisu pažljivo prečišćeni, većina fenola je obojena crvenkastom bojom, koja potiče od oksidovanih produkata • Tečni fenoli imaju više t. k. od normalnih alifatičnih homologa koji imaju istu molekulsku masu, zbog vodonične veze među molekulima

• Izomeri nitro-fenola pokazuju zanimljive razlike u fizičkim osobinama: T. k. , o. C na 9, 3 k. Pa Rastv. u vodi g/100 g vode o-nitro-fenol 100 0, 2 m-nitrofenol 194 1, 35 p-nitrofenol rasp. 1, 69 • Meta- i p-izomeri imaju visoke tačke ključanja zbog intermolekulske vodonične veze:

• Kod o-izomera dolazi do građenje intramolekulske vodonične veze, zbog čega nema asocijacije među molekulima, niti sa molekulima vode. Zato oni imaju nižu tačku ključanja i malu rastvorljivost u vodi

HEMIJSKE OSOBINE FENOLA

HEMIJSKE OSOBINE FENOLA 1. Reakcije hidroksilne grupe • • Kiselost - nastajanje soli Dobijanje etara - Williamson-ova sinteza Dobijanje estara Supstitucija -OH grupe fenola halogenom

HEMIJSKE OSOBINE FENOLA 2. Reakcije aromatičnog prstena • • Oksidacija Sulfonovanje Nitrovanje Halogenovanje Friedel-Crafts-ovo alkilovanje fenola Friedel-Crafts-ova reakcija acilovanja fenola Sinteza fenolnih kiselina - Kolbe-ova reakcija Sinteza fenolnih aldehida - Reimer-Tiemann-ova reakcija

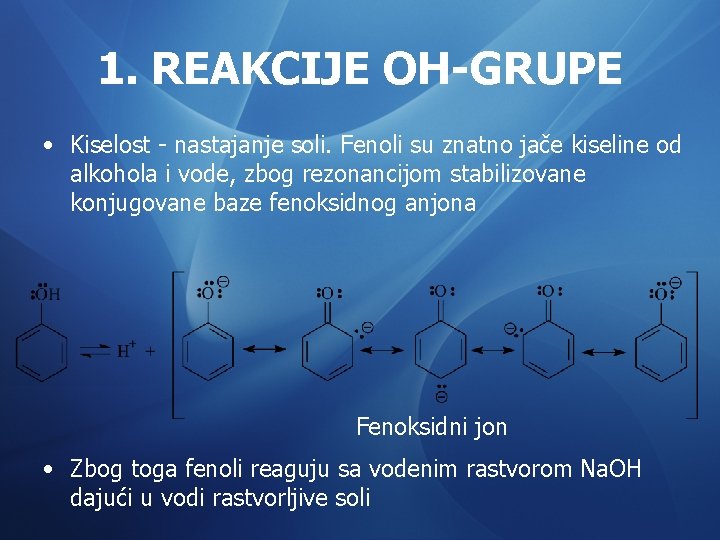
1. REAKCIJE OH-GRUPE • Kiselost - nastajanje soli. Fenoli su znatno jače kiseline od alkohola i vode, zbog rezonancijom stabilizovane konjugovane baze fenoksidnog anjona Fenoksidni jon • Zbog toga fenoli reaguju sa vodenim rastvorom Na. OH dajući u vodi rastvorljive soli

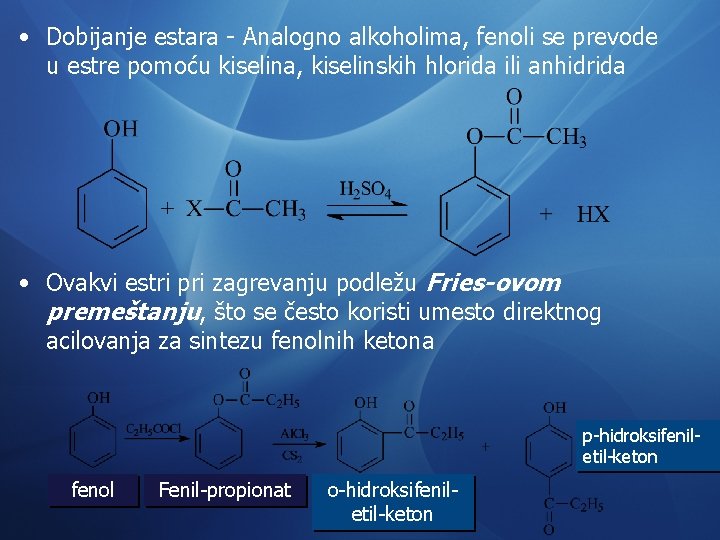
• Dobijanje estara - Analogno alkoholima, fenoli se prevode u estre pomoću kiselina, kiselinskih hlorida ili anhidrida • Ovakvi estri pri zagrevanju podležu Fries-ovom premeštanju, što se često koristi umesto direktnog acilovanja za sintezu fenolnih ketona p-hidroksifeniletil-keton fenol Fenil-propionat o-hidroksifeniletil-keton

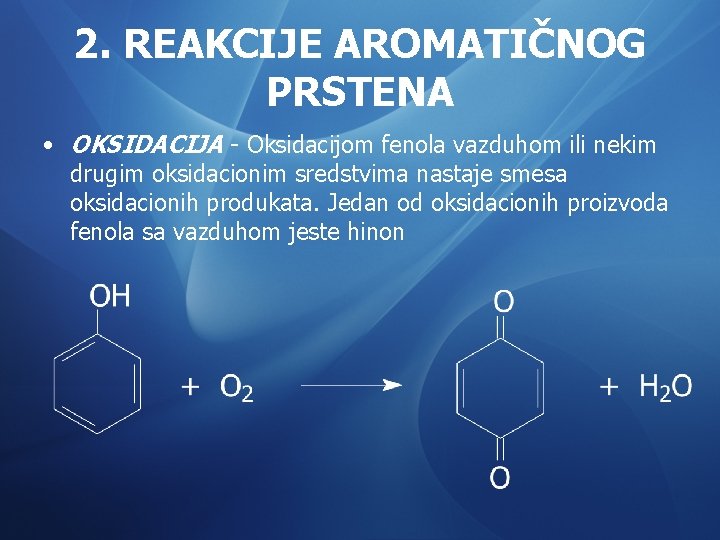
2. REAKCIJE AROMATIČNOG PRSTENA • OKSIDACIJA - Oksidacijom fenola vazduhom ili nekim drugim oksidacionim sredstvima nastaje smesa oksidacionih produkata. Jedan od oksidacionih proizvoda fenola sa vazduhom jeste hinon

Elektrofilna aromatična supstitucija Reakcije Fenol Benzen Nitriranje raz. HNO 3 u H 2 O ili CH 3 COOH HNO 3 / H 2 SO 4 konc. H 2 SO 4 ili SO 3 / H 2 SO 4 X 2 / Fe ili Fe. X 3 Alkilovanje ROH / H+ ili RCl / Al. Cl 3 Acilovanje RCOCl / Al. Cl 3 Sulfoniranje Halogenovanje Nitroziranje vod. ras. Na. NO 2 / H+

• BROMOVANJE - bromna voda – suspstitucija svih H atoma u o- i p-položaju prema OH-grupi; vrši se slabo polarnim rastvaračima (CS 2, CHCl 3, CCl 4) 2, 4, 6 -tribromfenol (100%) p-bromfenol (80 -84%)

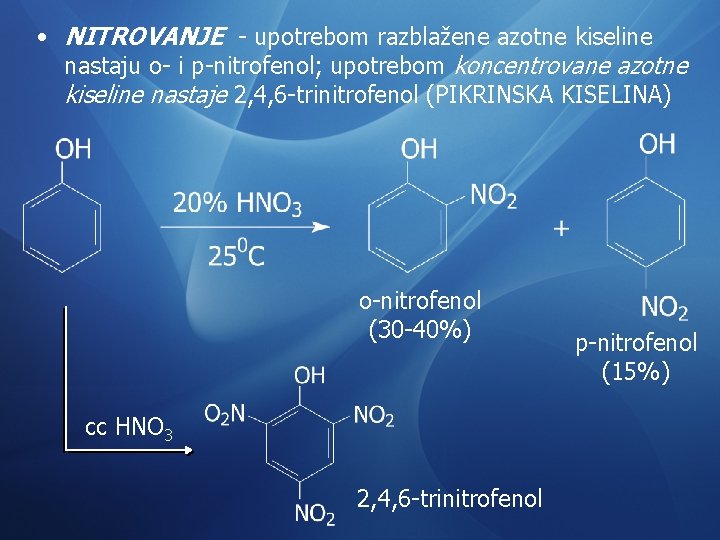
• NITROVANJE - upotrebom razblažene azotne kiseline nastaju o- i p-nitrofenol; upotrebom koncentrovane azotne kiseline nastaje 2, 4, 6 -trinitrofenol (PIKRINSKA KISELINA) o-nitrofenol (30 -40%) cc HNO 3 2, 4, 6 -trinitrofenol p-nitrofenol (15%)

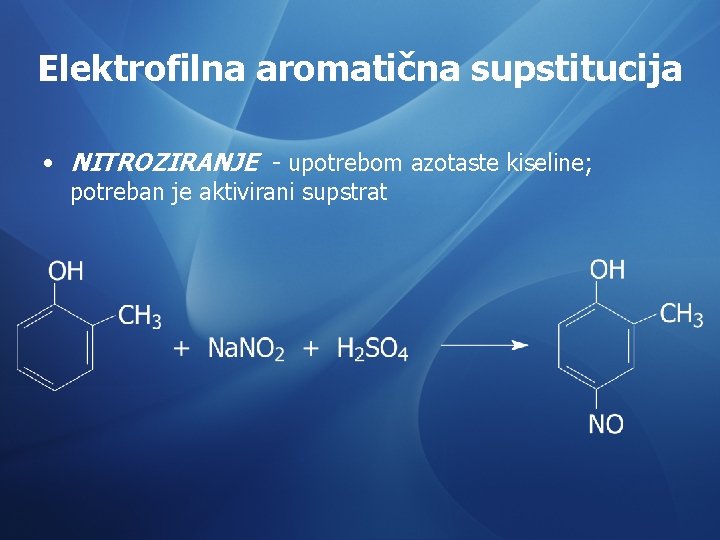
Elektrofilna aromatična supstitucija • NITROZIRANJE - upotrebom azotaste kiseline; potreban je aktivirani supstrat

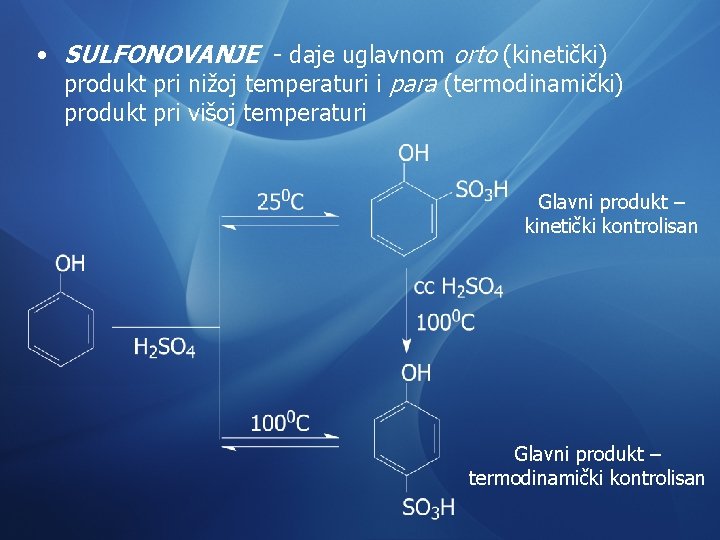
• SULFONOVANJE - daje uglavnom orto (kinetički) produkt pri nižoj temperaturi i para (termodinamički) produkt pri višoj temperaturi Glavni produkt – kinetički kontrolisan Glavni produkt – termodinamički kontrolisan

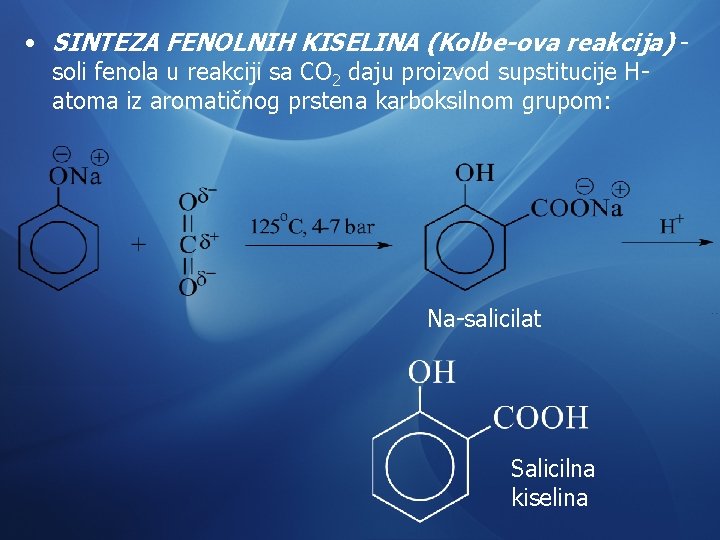
• SINTEZA FENOLNIH KISELINA (Kolbe-ova reakcija) - soli fenola u reakciji sa CO 2 daju proizvod supstitucije Hatoma iz aromatičnog prstena karboksilnom grupom: Na-salicilat Salicilna kiselina

• U reakciji snažno aktivirani aromatični prsten vrši nukleofilni napad na inače ne tako reaktivan ugljenikov atom iz CO 2 • Kolbe-ova sinteza je ravnotežni proces, koji je pod termodinamičkon kontrolom • Položaj ravnoteže pomeren je u pravcu nastajanja slabije baze salicilatnog anjona, u odnosu na jaču bazu fenoksidni anjon.

• Termodinamička kontrola je takođe odgovorna i za dominantno dobijanje orto- u odnosu na para-derivat. • Salicilatni anjon (o-izomer) je slabija baza nego phidroksibenzoat, jer je stabilizovan već pomenutom intramolekulskom vodoničnom vezom: vodonična veza

• REIMER-TIEMANN-OVA REAKCIJA - Dejstvom hloroforma na fenol u vodenom rastvoru Na. OH uvodi se, uglavnom u o-položaj prema OH-grupi, aldehidna grupa • Elektrofilni reagens u ovoj reakciji je dihlorkarben : CCl 2 koji se dobija dejstvom baze na hloroform: dihlor-karben

POLIHIDROKSILNI FENOLI • Orto-, m- i p-dihidroksibenzeni poznati su kao pirokatehol, rezorcinol i hidrohinon. pirokatehol rezorcinol hidrohinon

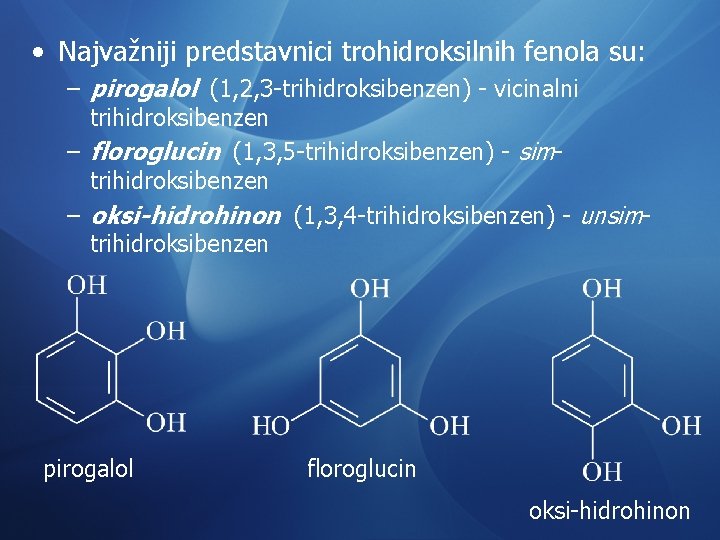
• Najvažniji predstavnici trohidroksilnih fenola su: – pirogalol (1, 2, 3 -trihidroksibenzen) - vicinalni trihidroksibenzen – floroglucin (1, 3, 5 -trihidroksibenzen) - simtrihidroksibenzen – oksi-hidrohinon (1, 3, 4 -trihidroksibenzen) - unsimtrihidroksibenzen pirogalol floroglucin oksi-hidrohinon
 Univerzitet u novom sadu erasmus
Univerzitet u novom sadu erasmus Univerzitet u novom sadu konkursi
Univerzitet u novom sadu konkursi Masinski fakultet podgorica centar za motore i vozila
Masinski fakultet podgorica centar za motore i vozila Direktni sporazum po novom zakonu o javnim nabavkama
Direktni sporazum po novom zakonu o javnim nabavkama Wniosek o powołanie świadka wzór
Wniosek o powołanie świadka wzór Sąd drugiej instancji dla sądu okręgowego
Sąd drugiej instancji dla sądu okręgowego Masoud sadjadi
Masoud sadjadi Departman za geografiju
Departman za geografiju Departman za proizvodno masinstvo
Departman za proizvodno masinstvo Departman za hemiju
Departman za hemiju Departman za proizvodno masinstvo
Departman za proizvodno masinstvo Departman za proizvodno masinstvo
Departman za proizvodno masinstvo Departman za matematiku
Departman za matematiku Departman za proizvodno masinstvo
Departman za proizvodno masinstvo Departman za proizvodno masinstvo
Departman za proizvodno masinstvo Univerzitet u kragujevcu
Univerzitet u kragujevcu Slobomir p
Slobomir p Univerzitet odbrane vojna akademija
Univerzitet odbrane vojna akademija Univerzitet u vitezu
Univerzitet u vitezu Univerzitet odbrane
Univerzitet odbrane Kallos tuzla akreditacija
Kallos tuzla akreditacija Visoka medicinska skola bitola predmeti
Visoka medicinska skola bitola predmeti Suburbanizacija definicija
Suburbanizacija definicija Univerzitet odbrane vojna akademija
Univerzitet odbrane vojna akademija Slobomir p univerzitet
Slobomir p univerzitet Erythrazma
Erythrazma Univerzitet za poslovne studije banja luka
Univerzitet za poslovne studije banja luka Gonoreja slike
Gonoreja slike















































