VIIa GRUPA P S E HALOGENI ELEMENTI ns

- Slides: 3

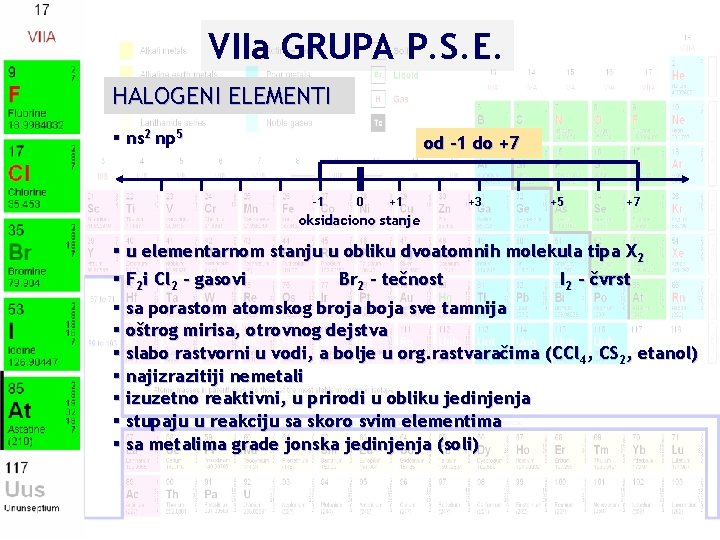
VIIa GRUPA P. S. E. HALOGENI ELEMENTI § ns 2 np 5 od -1 do +7 -1 0 +1 +3 +5 +7 oksidaciono stanje § u elementarnom stanju u obliku dvoatomnih molekula tipa X 2 § F 2 i Cl 2 – gasovi Br 2 – tečnost I 2 - čvrst § sa porastom atomskog broja boja sve tamnija § oštrog mirisa, otrovnog dejstva § slabo rastvorni u vodi, a bolje u org. rastvaračima (CCl 4, CS 2, etanol) § najizrazitiji nemetali § izuzetno reaktivni, u prirodi u obliku jedinjenja § stupaju u reakciju sa skoro svim elementima § sa metalima grade jonska jedinjenja (soli)

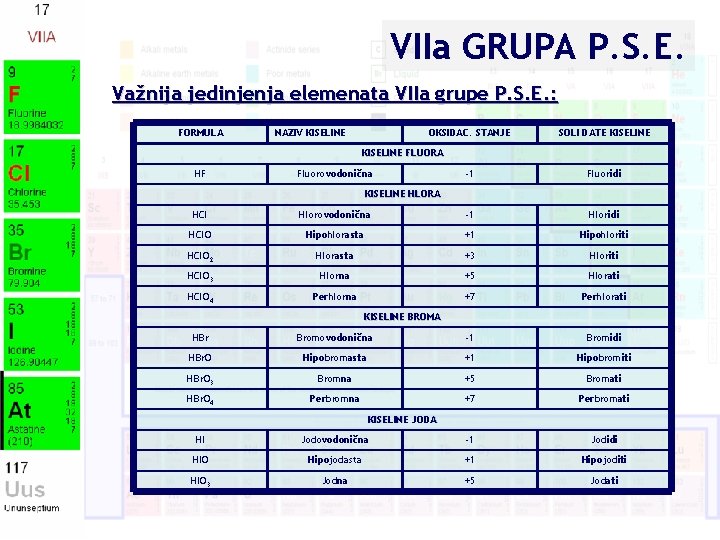
VIIa GRUPA P. S. E. Važnija jedinjenja elemenata VIIa grupe P. S. E. : FORMULA NAZIV KISELINE OKSIDAC. STANJE SOLI DATE KISELINE FLUORA HF Fluorovodonična -1 Fluoridi KISELINE HLORA HCl Hlorovodonična -1 Hloridi HCl. O Hipohlorasta +1 Hipohloriti HCl. O 2 Hlorasta +3 Hloriti HCl. O 3 Hlorna +5 Hlorati HCl. O 4 Perhlorna +7 Perhlorati KISELINE BROMA HBr Bromovodonična -1 Bromidi HBr. O Hipobromasta +1 Hipobromiti HBr. O 3 Bromna +5 Bromati HBr. O 4 Perbromna +7 Perbromati KISELINE JODA HI Jodovodonična -1 Jodidi HIO Hipojodasta +1 Hipojoditi HIO 3 Jodna +5 Jodati

VIIa GRUPA P. S. E. § organska jedinjenja fluora § freoni (fluorovi derivati ugljovodonika) § teflon (politetrafluoreten) § HF (fluorovodonik, fluorovodonična kiselina) § HCl (hlorovodonik, hlorovodonična kiselina) § HBr (bromovodonik, bromovodonična kiselina) § HI (jodovodonik, jodovodonična kiselina) § Na. OCl – Natrijum hipohlorit § Ca. Cl(OCl) – so HCl i HCl. O (“hlorni kreč”) § HCl. O 4 – Perhlorna kiselina § najjača neorganska kiselina § vrlo jako oksidaciono sredstvo jačina kiselina raste