UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA









































- Slides: 57

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � � � � Perspectiva Histórica: De Que Se Compone la Materia (Teoría Atómica) (Cap. 2 sec. 2. 1 -2. 3) Teoría Cuántica y Estructura Electrónica de los Atomos (Cap. 7 sec. 7. 1 -7. 8) Clasificación de la Materia (Cap. 1 sec. 1. 4) Estados de la Materia (Cap. 1 sec. 1. 5) Propiedades Físicas y Químicas de la Materia (Cap. 1 sec. 1. 6) Relaciones Periódicas entre Elementos: Tabla Periódica (Cap. 8 sec. 8. 1 -8. 6) Moléculas, Iones, Fórmulas, Nombre de Compuestos (Cap. 2 sec. 2. 5 -2. 7)

VISIÓN DE LA MATERIA ¿Qué es la materia? ¿De qué está formada la materia? ¿Cuál es su naturaleza, cómo está hecha, de qué se compone? Es importante la búsqueda de ayudas visuales, símbolos, para estudiar y entender lo que observamos en la naturaleza (lo que se puede y no se puede ver). Importante para entender las propiedades y estados de la materia. Desarrollar un entendimiento del proceso de formación de la materia.

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � � Perspectiva Histórica: De De Que Se Compone la Materia Teoría Atómica : Hipótesis de John Dalton (1808) � Toda la materia está compuesta por partículas llamada átomos. � Se llama elementos a aquellas sustancias que están compuestos por átomos que son iguales. � Se llama compuesto a aquellas sustancias que son producto de la combinación de átomos de dos o más elementos. Ley de Proporciones Definidas �Muestras diferentes del mismo compuesto siempre mantienen sus elementos en la misma proporción por masa. Ley de Proporciones Múltiples �Si dos elementos se pueden combinar para formar más de un compuesto, las masas de un elemento que se combina con una masa fija del otro elemento será a razón de números enteros pequeños.

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Las reacciones entre átomos de elementos iguales y diferentes envuelve solamente la separación, combinación o re-arreglo de los átomos. Esto no resulta en su creación o destrucción. Ley de Conservación de Masa �La materia ni se crea ni se destruye, solo se transforma. � Estructura del Atomo (Conceptos Estructurales) Atomos están compuestos por partículas subatómicas: protones, neutrones y electrones. � Los protones y neutrones se encuentran en la porción central del átomo. Este lugar se llama el núcleo. � Los electrones están localizados fuera del núcleo y se estima que se mueven a través de un espacio relativamente grande alrededor del núcleo. �

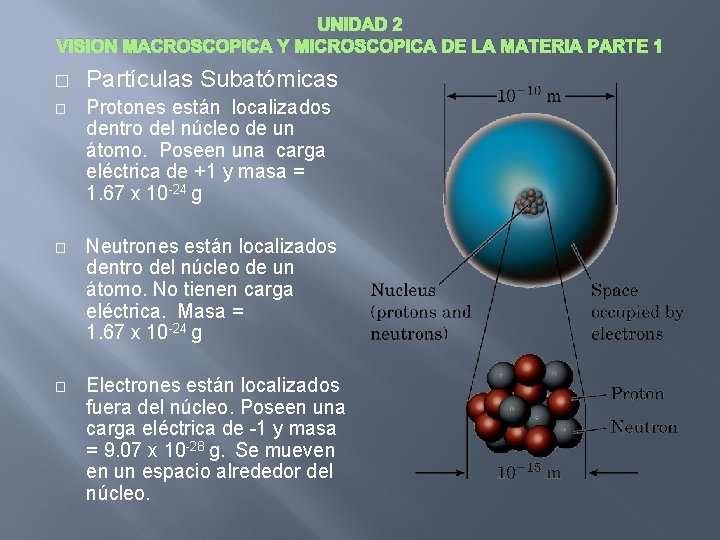
UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Partículas Subatómicas � Protones están localizados dentro del núcleo de un átomo. Poseen una carga eléctrica de +1 y masa = 1. 67 x 10 -24 g � Neutrones están localizados dentro del núcleo de un átomo. No tienen carga eléctrica. Masa = 1. 67 x 10 -24 g � Electrones están localizados fuera del núcleo. Poseen una carga eléctrica de -1 y masa = 9. 07 x 10 -28 g. Se mueven en un espacio alrededor del núcleo.

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Modelo Atómico: Nomenclatura y Conceptos Estructurales � Todos los átomos se puede identificar por el número de protones y neutrones que contienen. � Al número de protones en el núcleo se le llama número atómico. Como los átomos de elementos no tienen carga, el número atómico también es igual al número de electrones del elemento. � Cada elemento: no. de protones = no. de electrones � La suma del número de protones y neutrones se conoce como el número de masa. � Atomos de un elemento que tiene el mismo número atómico (no. de protones) pero distinto número de neutrones se llama Isótopo.

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Teoría Cuántica (Quantum Theory) � Nos ayuda a entender y predecir el rol importante de los electrones en la química. � ¿Cuántos electrones contiene un átomo? � ¿Qué energías poseen los electrones? � ¿Dónde se encuentran los electrones en el átomo? � El conocimiento de esta información está relacionada directamente con el comportamiento de las sustancias y de sus interacciones unas con otras. � Max Planck (1900) Sugirió que los átomos y moléculas pueden emitir o absorber energía solamente en cantidades discretas (i. e. paquetes o manojos). Se llama cuántica (quantum) a la menor cantidad de energía que es emitida o absorbida en forma de radiación electromagnética.

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Radiación electromagnética es la emisión y transmisión de energía en forma de ondas electromagnéticas. � Una onda puede ser percibida como un disturbio en vibración por el cual la energía es transmitida. � La luz visible consiste de ondas electromagnéticas compuestas por un campo eléctrico y un campo magnético. (Teoría de J. Maxwell 1873). � Características que describen una onda. Largo de onda (λ): distancia entre puntos idénticos en ondas sucesivas. Frecuencia ( )ע : número de ondas que pasan por un punto en particular en 1 segundo. Amplitud : distancia vertical del medio de la onda al punto más alto de la cresta.

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Efecto Fotoeléctrico Electrones salen de la superficie de un metal al ser expuestos a una fuente lumínica de una frecuencia mínima. � Esta fuente lumínica está compuesta por partículas llamadas fotones. Cada fotón tiene una energía E = h ע donde = ע frecuencia de la luz. (A. Einstein 1905). � E = h = ע KE + W, KE = h – ע W � � Teoría de Orbitales de Energía (N. Bohr 1913) La energía de los electrones está cuantificada (quantized) en cada orbital que ocupan alrededor del núcleo. Cada orbital se puede presentar como un nivel de energía (n =1 , 2 , 3……) donde n =1 es el estado más estable más cerca del núcleo. � Energía radiante es emitida (en forma de un fotón) cuando un electrón se mueve de un nivel mayor a uno menor. � Energía radiante es absorbida por el átomo causa que el electrón se mueva de un nivel menor energía a uno mayor. �

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Naturaleza Dual de un Electrón (L. Broglie 1924) � Cuando un electrón se comporta como una onda, el largo de onda debe caber en la circunferencia de su orbita. � Las ondas pueden comportarse como partículas y éstas pueden exhibir propiedades de ondas. λ = h / mu Las propiedades de ondas son observables para partículas sub-microscópicos (i. e. electrones). � Los Conceptos de Orbitales y del Comportamiento de Partícula/Onda: � No explican múltiples líneas en los espectros de emisión para átomos con más de un electrón. � Si los electrones se comportan como ondas, ¿cómo se puede precisar su posición?

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Mecánica Cuántica ( Quantum Mechanics) � Principio de Incertidumbre de Heisenberg Es imposible saber simultaneamente el momentum p (p = masa x aceleración) y la posición de la partícula con certeza. � Ecuación de Schrodinger (1926) Incorpora el comportamiento simultáneo de las partículas en términos de masa (m) y una función de onda (ᴪ) que depende de la localización en el espacio del sistema. Se asocia (ᴪ)2 con la teoría de que la intensidad de la luz es proporcional a la amplitud de una onda. El lugar con mayor probabilidad de encontrar un fotón es donde la intensidad de la luz es mayor. Por ende, se puede argumentar que un habrá mayor probabilidad de encontrar el electrón en regiones que rodean al núcleo.

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Ecuación de Schrodinger � Especifica los posibles niveles de energía que el electrón puede ocupar en un átomo e identifica su función de onda correspondiente. � Define el concepto de densidad electrónica como la probabilidad de encontrar el electrón en una región del átomo. La distribución de la densidad electrónica es vista como un espacio tridimensional alrededor del núcleo. � El concepto orbital atómico se puede asociar a la función de onda de un electrón en un átomo. Cuando decimos que un electrón se encuentra en cierto orbital, se entiende que la distribución de la densidad electrónica (o la probabilidad de encontrar al electrón) es descrita por el cuadrado de la función de onda (ᴪ)2 asociado con ese orbital. � Un orbital atómico tiene una energía y distribución de densidad electrónica característica.

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Para describir la distribución de los electrones en los átomos, se utilizan los siguientes números cuánticos (quantum numbers): � n Número Cuántico Principal (Principal Quantum Number) Se relaciona con el nivel de energía de un orbital atómico y la distancia promedio que hay entre el orbital donde se encuentra el electrón y el núcleo. (n =1, 2, 3, 4…) � l Número Cuántico de Momentum Angular (Angular Momentum Quantum Number) Se relaciona con la forma de los orbitales. Los orbitales asociados al valor de l son: s, p, d, f, g, h… � ml Número Cuántico Magnético (Magnetic Quantum Number) Describe la orientación de un orbital en espacio. � Ms Rotación Cuántica del Electrón (Electron Spin Quantum Number) Se asume que los electrones tiene propiedades magnéticas. Una carga rotacional genera un campo magnético. En el orbital atómico, una mitad de los electrones gira en una dirección y la otra mitad en la dirección opuesta.

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � � Orbitales Atómicos (visualización en el espacio) Orbital s � Más estable (ground state). Electrones están más cerca del núcleo y son atraídos por la fuerza del núcleo. � Orbital p � Definen la orientación en el espacio. Se representa en tres orbitales Px , PY , Pz. � Son iguales en tamaño, forma y energía. Difieren uno del otro en su orientación. � Orbitales d, f, g

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Configuración Electrónica � Ayuda a visualizar como los electrones está distribuidos a través de los orbitales atómicos. � Para describir dicha configuración, se hacen cálculos matemáticos usando los 4 números cuánticos (n, l, ml , y ms ) con la ecuación de Schrodenger.

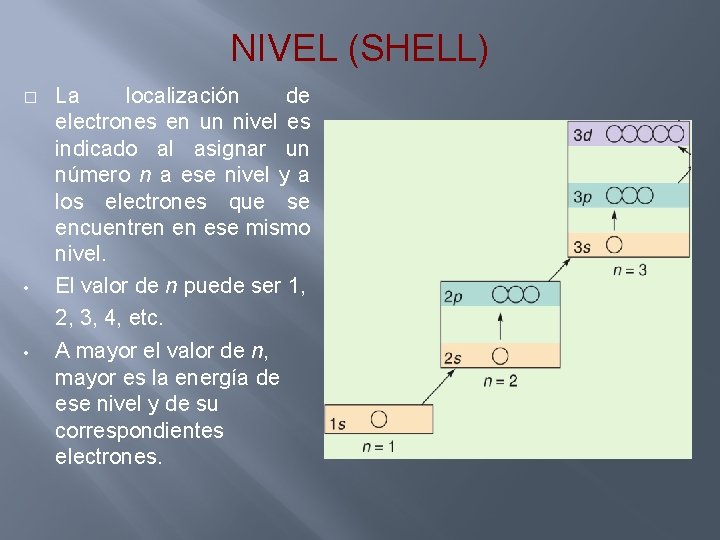
NIVEL (SHELL) � • • La localización de electrones en un nivel es indicado al asignar un número n a ese nivel y a los electrones que se encuentren en ese mismo nivel. El valor de n puede ser 1, 2, 3, 4, etc. A mayor el valor de n, mayor es la energía de ese nivel y de su correspondientes electrones.

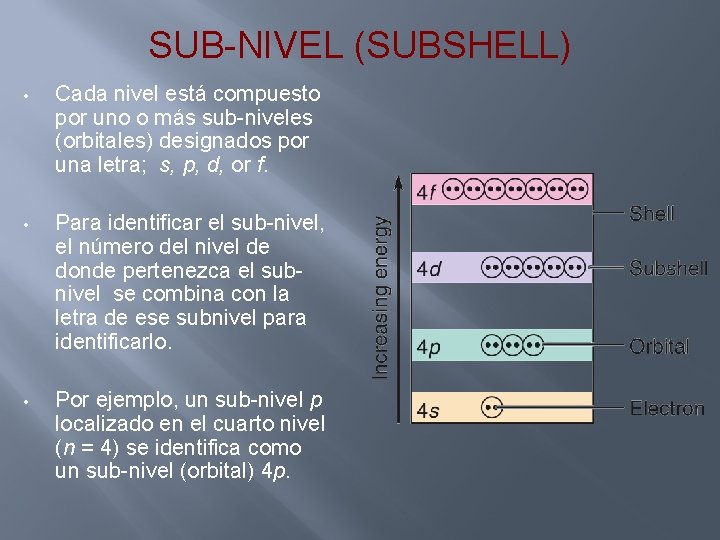
SUB-NIVEL (SUBSHELL) • Cada nivel está compuesto por uno o más sub-niveles (orbitales) designados por una letra; s, p, d, or f. • Para identificar el sub-nivel, el número del nivel de donde pertenezca el subnivel se combina con la letra de ese subnivel para identificarlo. • Por ejemplo, un sub-nivel p localizado en el cuarto nivel (n = 4) se identifica como un sub-nivel (orbital) 4 p.

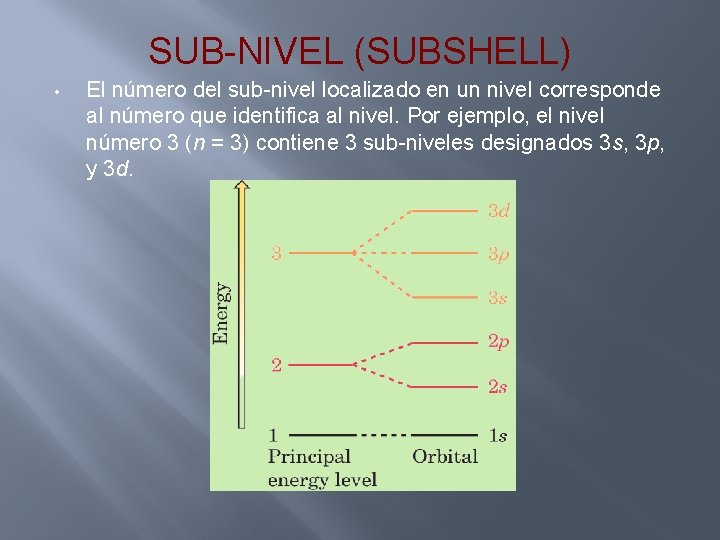
SUB-NIVEL (SUBSHELL) • El número del sub-nivel localizado en un nivel corresponde al número que identifica al nivel. Por ejemplo, el nivel número 3 (n = 3) contiene 3 sub-niveles designados 3 s, 3 p, y 3 d.

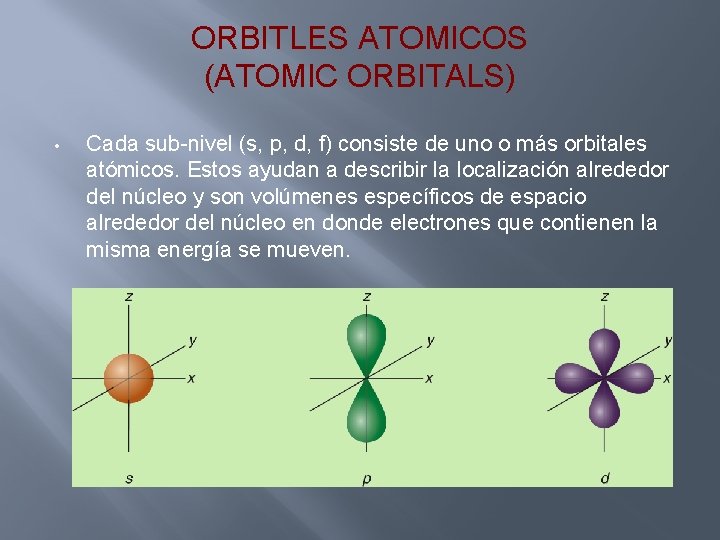
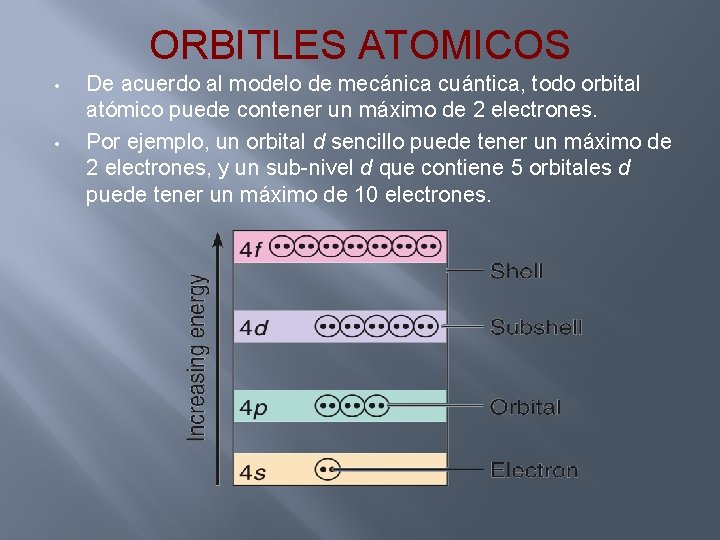
ORBITLES ATOMICOS (ATOMIC ORBITALS) • Cada sub-nivel (s, p, d, f) consiste de uno o más orbitales atómicos. Estos ayudan a describir la localización alrededor del núcleo y son volúmenes específicos de espacio alrededor del núcleo en donde electrones que contienen la misma energía se mueven.

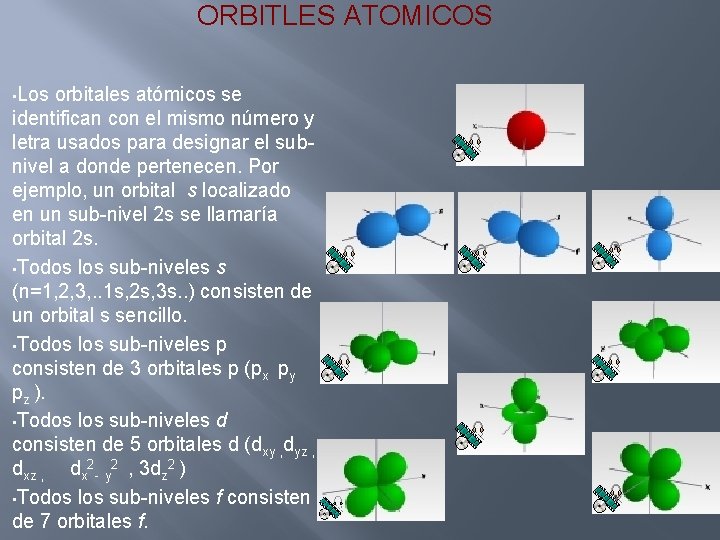
ORBITLES ATOMICOS • Los orbitales atómicos se identifican con el mismo número y letra usados para designar el subnivel a donde pertenecen. Por ejemplo, un orbital s localizado en un sub-nivel 2 s se llamaría orbital 2 s. • Todos los sub-niveles s (n=1, 2, 3, . . 1 s, 2 s, 3 s. . ) consisten de un orbital s sencillo. • Todos los sub-niveles p consisten de 3 orbitales p (px py pz ). • Todos los sub-niveles d consisten de 5 orbitales d (dxy , dyz , dx 2 - y 2 , 3 dz 2 ) • Todos los sub-niveles f consisten de 7 orbitales f.

ORBITLES ATOMICOS • • De acuerdo al modelo de mecánica cuántica, todo orbital atómico puede contener un máximo de 2 electrones. Por ejemplo, un orbital d sencillo puede tener un máximo de 2 electrones, y un sub-nivel d que contiene 5 orbitales d puede tener un máximo de 10 electrones.


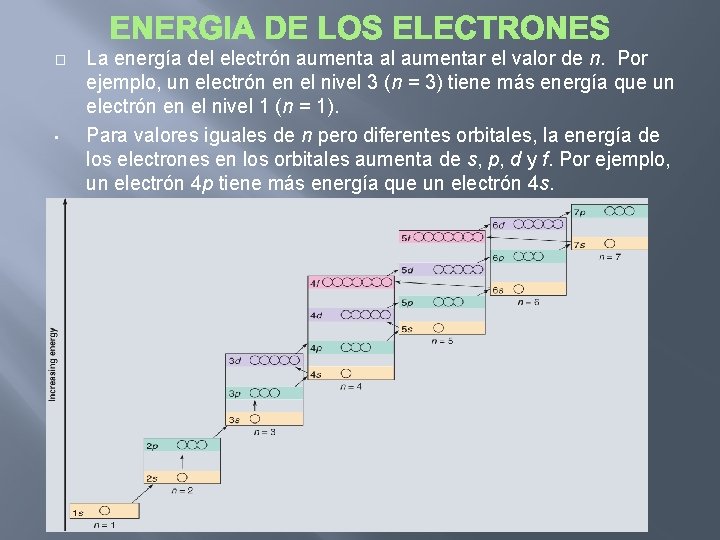
� • La energía del electrón aumenta al aumentar el valor de n. Por ejemplo, un electrón en el nivel 3 (n = 3) tiene más energía que un electrón en el nivel 1 (n = 1). Para valores iguales de n pero diferentes orbitales, la energía de los electrones en los orbitales aumenta de s, p, d y f. Por ejemplo, un electrón 4 p tiene más energía que un electrón 4 s.

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 CONFIGURACION ELECTRONICA � � Describe como los electrones están distribuidos en los átomos. Reglas para escribir la configuración electrónica. � Electrones se colocan en sub-niveles en el orden de aumento energético de los sub-niveles (s > p > d > f). Por ejemplo, el sub-nivel 1 s se llena primero que el sub-nivel 2 s y el 2 p. � Regla de Hund Electrones no se unirán a otros electrones en un orbital de un sub-nivel si existe un orbital vacio con la misma energía en el sub-nivel. � Principio/Regla de Exclusión de Pauli Solamente electrones girando en direcciones opuestas (indicado por ↑ y ↓) pueden ocupar el mismo orbital en el sub-nivel correspondiente.

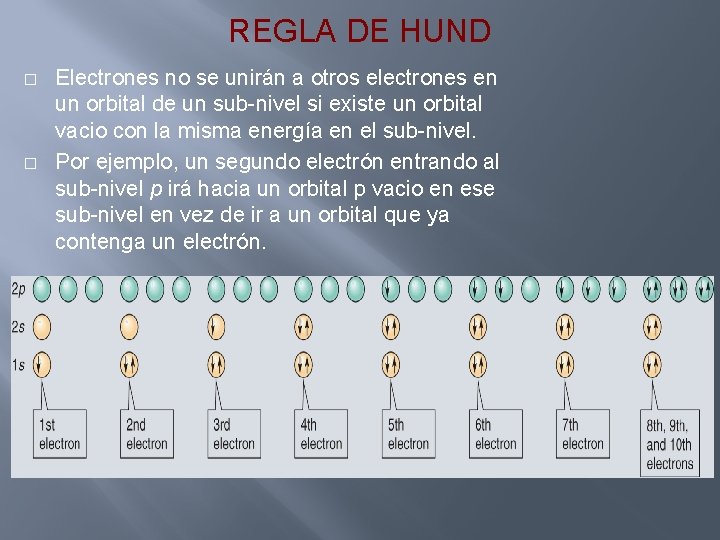
REGLA DE HUND � � Electrones no se unirán a otros electrones en un orbital de un sub-nivel si existe un orbital vacio con la misma energía en el sub-nivel. Por ejemplo, un segundo electrón entrando al sub-nivel p irá hacia un orbital p vacio en ese sub-nivel en vez de ir a un orbital que ya contenga un electrón.

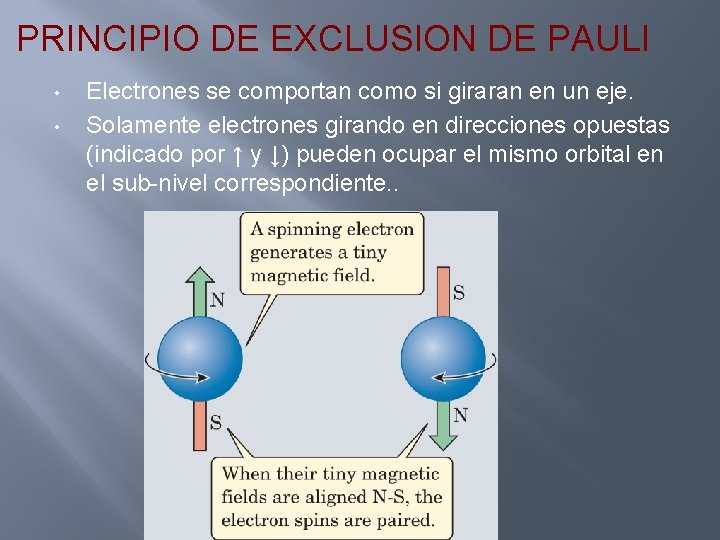
PRINCIPIO DE EXCLUSION DE PAULI • • Electrones se comportan como si giraran en un eje. Solamente electrones girando en direcciones opuestas (indicado por ↑ y ↓) pueden ocupar el mismo orbital en el sub-nivel correspondiente. .

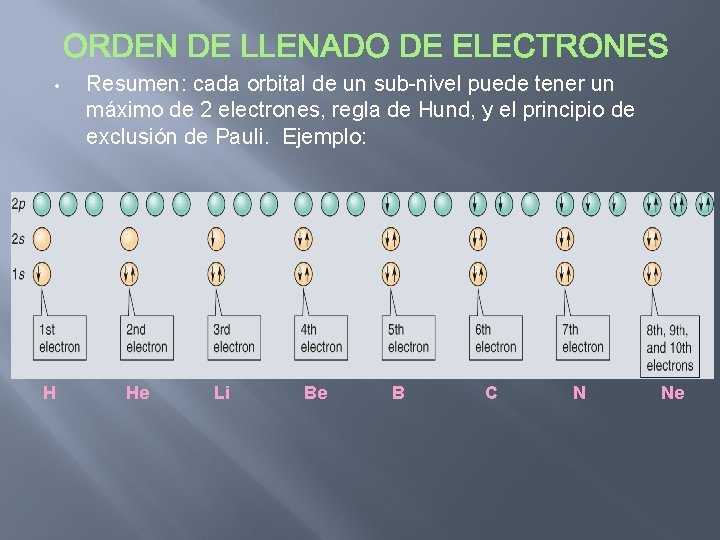
• H Resumen: cada orbital de un sub-nivel puede tener un máximo de 2 electrones, regla de Hund, y el principio de exclusión de Pauli. Ejemplo: He Li Be B C N Ne

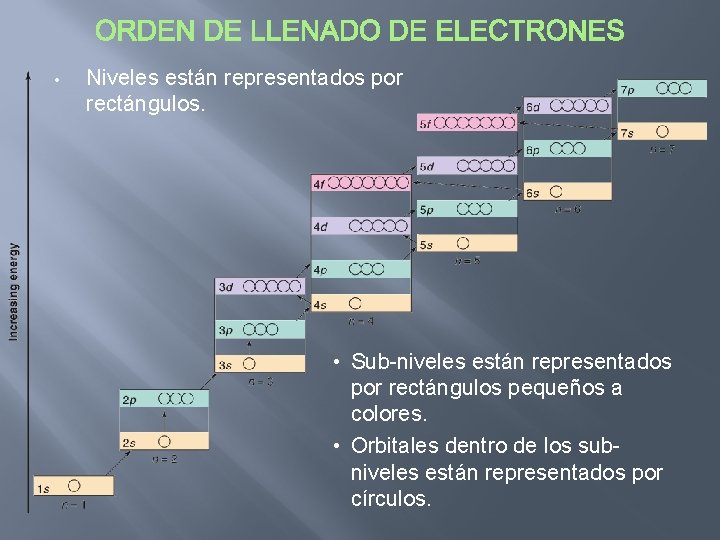
• Niveles están representados por rectángulos. • Sub-niveles están representados por rectángulos pequeños a colores. • Orbitales dentro de los subniveles están representados por círculos.

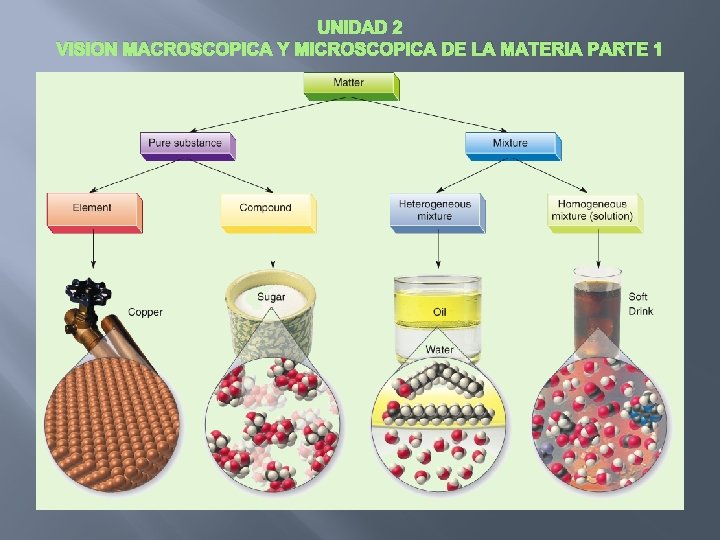
UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � � Clasificación de la Materia Sustancias Puras � Tienen una composición constante y propiedades físicas y químicas únicas. Elemento �Sustancia pura compuesta por moléculas del mismo átomo Compuesto �Sustancia pura compuesta por moléculas de distintos átomos � Mezclas � Combinación de dos o más sustancias puras � Sus propiedades pueden variar de acuerdo a la cantidad de cada sustancia. Homogéneas: composición uniforme Heterogéneas: composición no uniforme

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Los Estados de la Materia � Sólidos Las moléculas están más cerca unas de otras con poca libertad para el movimiento. � Líquidos Las moléculas están cerca unas de otras pero no en posiciones tan rígidas permitiendo mayor movimiento. � Gases Las moléculas están más separadas y poseen mayor libertad de movimiento.

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Propiedades Físicas y Químicas de la Materia � Propiedades Físicas La materia puede ser medida, observada y caracterizada por cambios que no afectan su composición e identidad como sustancia. � Propiedades Químicas La materia representa un cambio (transformación) de las propiedades originales de las sustancias originales � Propiedades Extensivas Depende de cuanta materia esté presente cuando se va a hacer una medición (masa, volumen). � Propiedades Intensivas No depende de cuanta materia esté presente cuando se va a hacer una medición (densidad, temperatura)

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 Diversidad en la Materia � Basado en la obervación y curiosidad para caracterizar la materia, se han descubierto 117 elementos (117 átomos diferentes). � 86 elementos son de origen natural: tierra (suelo), océano y la atmósfera. � El resto han sido sintetizado en laboratorios. � Cada elemento se caracteriza y se identifica por sus propiedades físicas y químicas. � A cada elemento se la asignó un nombre y símbolo en específico. Nombrados por el científico que lo descubrió Lugares famosos Personajes mitológicos

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 Nomenclatura para Elementos y Compuestos � El símbolo de un elemento está basado en su nombre y consiste de una letra mayúscula o una letra mayúscula seguida de una minúscula. � Ejemplos: � N (nitrógeno), Ca (calcio) El símbolo de un compuesto (sustancias hechas de dos o más átomos diferentes) es la combinación los símbolos de cada elemento. � Ejemplos: sodio) HCl (ácido clorídico), Na. Cl (cloruro de

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 Nomenclatura y Conceptos Estructurales � Al número de protones en el núcleo se le llama número atómico. Como los átomos de elementos no tienen carga, el número atómico también es igual al número de electrones del elemento. � Cada � � elemento: no. de protones = no. de electrones La suma del número de protones y neutrones se conoce como el número de masa. Atomos de un elemento que tiene el mismo número atómico (no. de protones) pero distinto número de neutrones se llama Isótopo.

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 Número Atómico y Número de Masa � El número atómico de fluor es 9. � En el símbolo F, el número 9 se encuentra en la parte inferior izquierda. ( 9 protones y 9 electrones) � El número de masa de fluor es 19. � En el símbolo F, el número 19 se encuentra el la parte superior izquierda. (la suma de protones y neutrones)

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 ISOTOPOS � � Isótopos son átomos que tienen el mismo número de protones en el núcleo pero diferente número de neutrones. Esto es, tienen el mismo número atómico pero diferente número de masa. Debido a que tienen el mismo número de protones en el núcleo, todos los isótopos del mismo elemento tienen el mismo número de electrones afuera de núcleo.

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 ISOTOPOS y PESOS ATOMICOS � Muchos elementos se encuentran en la Naturaleza como una mezcla de varios isótopos. � El peso atómico de elementos compuestos por mezclas de isótopos corresponde al promedio de la masa de los átomos en la mezcla de isótopos.

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 Organización de los Elementos � � Julius Lothar Meyer (Alemán) y Dmitri Mendeleev (Ruso) en 1869 diseñaron un esquema de clasificación para facilitar la identificación de los elementos. Basado en sus observaciones y el modelo atómico se formuló la Ley de Periodicidad. � Cuando los elementos son colocados en orden de aumento en el número atómico y su masa atómica, otros elementos con igual características aparacerán en períodos regulares. � Las propiedades físicas y químicas de los elementos son función periódica de su número atómico. (i. e. el número de protones y electrones en el átomo)

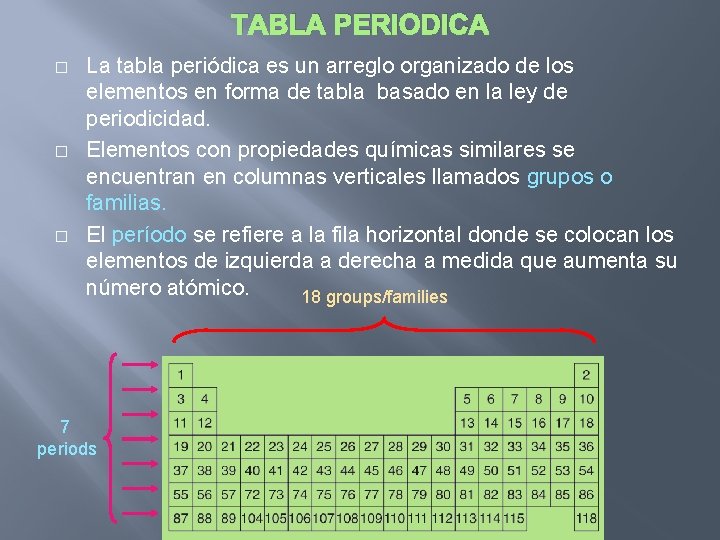
TABLA PERIODICA � � � La tabla periódica es un arreglo organizado de los elementos en forma de tabla basado en la ley de periodicidad. Elementos con propiedades químicas similares se encuentran en columnas verticales llamados grupos o familias. El período se refiere a la fila horizontal donde se colocan los elementos de izquierda a derecha a medida que aumenta su número atómico. 18 groups/families 7 periods

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Clasificación de los elementos � Se utiliza el número atómico en orden secuencial. Número Atómico = Número de Protones = Número de Electrones � La configuración electrónica ayuda a explicar la recurrencia de propiedades físicas y químicas. Principio de Aufbau: cuando de añaden protones uno al núcleo del átomo por cada elemento, igualmente se añaden electrones a los orbitales.

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Configuración Electrónica � Guías para recordar el número máximo de electrones por subnivel. s puede tener 2 p puede tener 6 d puede tener 10 f puede tener 14

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � � � Configuración Electrónica: Gases Nobles (8 A) Con la excepción de Helio, todos los gases nobles tienen una configuración electrónica que termina con los sub-niveles s y p completamente llenos de electrones en el nivel n más alto. He (1 s 2 ) Ne (1 s 2 2 p 6) Ar (1 s 2 2 p 6 3 s 2 3 p 6)

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Configuración Electrónica: Ejemplos Magnesium, Mg, 12 electrones: 1 s 22 p 63 s 2 • Silicon, Si, 14 electrones: 1 s 22 p 63 s 23 p 2 • Iron, Fe, 26 electrones: 1 s 22 p 63 s 23 p 64 s 23 d 6 • Gallium, Ga, 31 electrones: 1 s 22 p 63 s 23 p 64 s 23 d 104 p 1 •

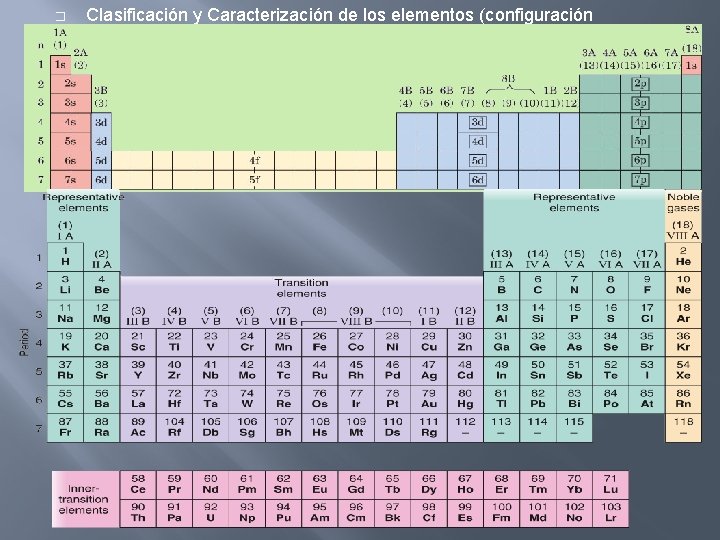
UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Clasificación y Caracterización de los Elementos (configuración electrónica) � La reactividad química de los elementos está caracterizada por los electrones que se encuentran en el nivel n más alto (electrones más lejanos del núcleo). � A estos electrones se les llama electrones de valencia. � Estos electrones son los que se comparten o pasan de un átomo a otro cuando dos elementos se unen para formar una molécula o un compuesto. • • • Elementos Representativos : subnivel s, p electron(es) valencia. Elementos de Transición: subnivel d electron (es) valencia. Elementos de Transición Interna: subnivel f electron(es) valencia

� Clasificación y Caracterización de los elementos (configuración electrónica)

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Caracterización de los Elementos � Tamaño de los Atomos (Radio Atómico) Elementos representativos en una mismo período (línea horizontal), el tamaño del átomo disminuye de izquierda a derecha (aumenta de derecha a izquierda). Elementos representativos en un mismo grupo (columna), el tamaño del átomo aumenta de arriba hacia abajo. • •

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Visual del Radio Atómico para Elementos Representativos (picómetros)

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Caracterización de los Elementos � Existe una correlación entre la configuración electrónica (propiedad microscópica) y el comportamiento químico (propiedad macroscópica). � Las propiedades químicas de un átomo son determinadas por la configuración electrónica en los átomos de los electrones de valencia. � La estabilidad y energía de los electrones de valencia se relaciona con sus distancia del núcleo. � Se llama Energía de Ionización a la energía mínima (kj/mol) que se necesita para remover un electrón de un átomo en estado gaseoso de un nivel más estable (ground state).

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 • • • La energía de ionización es la energía requerida para remover del nivel de valencia un electrón. Para los elementos representativos en un mismo período, la tendencia general es a aumentar de izquierda a derecha. La carga nuclear y el no. de electrones también aumenta. Por lo tanto , hay más atracción entre el núcleo y los electrones de valencia y se necesita más energía para removerlos. Para los elementos representativos en un mismo grupo, la tendencia general es a disminuir de arriba hacia abajo. Al aumentar el tamaño del átomo, los electrones de valencia están más lejos del núcleo y necesitan menos energía para removerlos.

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � � Caracterización de los Elementos Afinidad Electrónica � Se define como la habilidad de un átomo para aceptar un electrón. � Se representa como el cambio energético que ocurre cuando un electrón es aceptado por un átomo para formar un anión. � La tendencia general es aumentar de izquierda a derecha en la tabla periódica Grupo 1 A 7 A

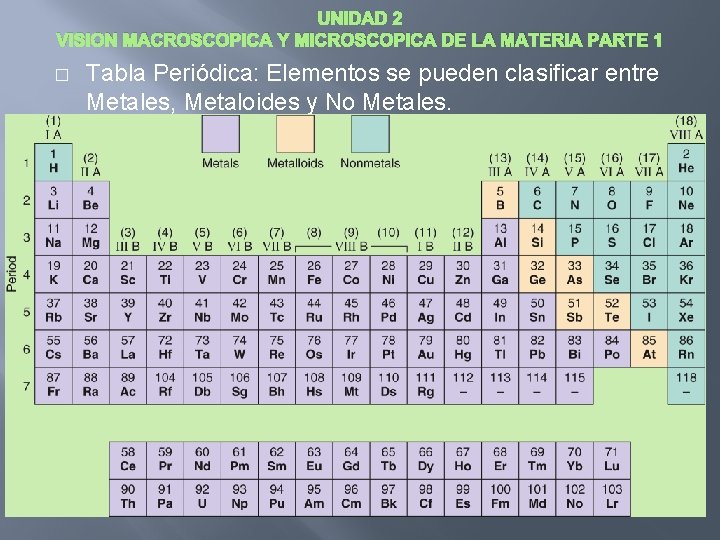
UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Tabla Periódica: Elementos se pueden clasificar entre Metales, Metaloides y No Metales.

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 • • • Metales tienen las siguientes propiedades: alta conductividad termal, alta conductividad eléctrica, ductilidad, maleabilidad y lustre metálico. Tienden a perder electrones en reacciones químicas. Muchos no metales tienen propiedades opuestas a aquellas de metales y generalmente se encuentran como sólidos polvorientos y quebradizos, o como gases. Tienden a ganar electrones en reacciones químicas. Los metaloides tiene propiedades parecidas a metales y no metales The Elements of Group VA(15) bismuth nitrogen phosphorous arsenic antimony

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � ¿Qué hemos visto hasta ahora? � La energía de ionización y la afinidad electrónica ayudan a entender las clases de interacciones que ocurren entre los elementos y la naturaleza de los elementos en el compuesto. � Tenemos una idea de la atracción de los electrones hacia los átomos. � Metales tienden a tener bajas energías de ionización. � No metales tienden a tener altas afinidades electrónicas.

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � � Características de la Materia: Conceptos Estructurales - Moléculas e Iones De todos los elementos, los gases nobles existen en la naturaleza como átomos sencillos (Grupo 8 A). La mayoría de la materia está compuesta de moléculas e iones. Molécula � Agregado de por lo menos 2 átomos en un arreglo determinado unidos por fuerzas químicas o enlaces químicos. � Puede tener átomos de un mismo elemento o átomos de elementos distintos unidos en una razón fija entera. � Moléculas diatómicas (H 2 , N 2 , O 2 , HCl � Moléculas poliatómicas (O 3 , H 2 O)

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � Ion � Atomo que tiene una carga neta positiva o negativa. � Catión Atomo que ha perdido uno o más electrones y tiene una carga neta positiva debido a los protones que están en el núcleo. Na Na+ + e- , Mg Mg 2+ + 2 e� Anión Atomo que ha ganado uno o más electrones y tiene una carga neta negativa debido a que el núcleo conserva su carga protónica, pero aumenta la carga negativa. Cl + e. Cl- , O + 2 e. O 2 -

UNIDAD 2 VISION MACROSCOPICA Y MICROSCOPICA DE LA MATERIA PARTE 1 � � Características de la Materia: Conceptos Estructurales – Fórmulas Químicas Se usan para expresar la composición de moléculas y compuestos iónicos en términos de símbolos químicos. Fórmula Molecular: describe el número exacto de átomos de cada elemento en la sustancia y representa la unidad más pequeña de ésta.
 Vision macroscopica
Vision macroscopica Structura macroscopica a lemnului
Structura macroscopica a lemnului Reprodução celular
Reprodução celular Testicolo
Testicolo Estructura microscopica de la fibra muscular
Estructura microscopica de la fibra muscular Ley de ohm microscopica
Ley de ohm microscopica Clasificarea bacteriilor
Clasificarea bacteriilor Pancreas anatomia microscopica
Pancreas anatomia microscopica Decena centena unidad
Decena centena unidad Human vision vs computer vision
Human vision vs computer vision Newton unidad
Newton unidad Avancemos 1 unidad 2 leccion 1
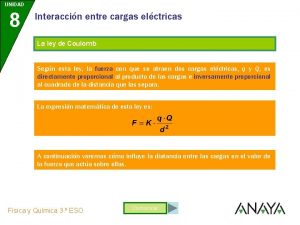
Avancemos 1 unidad 2 leccion 1 Coulomb unidad
Coulomb unidad Quinta unidad modelo
Quinta unidad modelo Unidad de muestreo ejemplo
Unidad de muestreo ejemplo Unidad de comunicaciones
Unidad de comunicaciones Combinaciones matematicas
Combinaciones matematicas Juan 17, 20-21
Juan 17, 20-21 Ciclo de servicio de una aerolinea
Ciclo de servicio de una aerolinea Unidad 8 spf
Unidad 8 spf Robert altman teoria celular
Robert altman teoria celular Parmalife
Parmalife Nanometro unidad de medida
Nanometro unidad de medida Unidad educativa seis de octubre de ventanas
Unidad educativa seis de octubre de ventanas Climaterico definicion
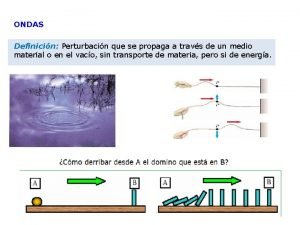
Climaterico definicion Velocidad de propagación de onda
Velocidad de propagación de onda Clase y periodo
Clase y periodo Partes de un transformador
Partes de un transformador Unidad 6 republica dominicana
Unidad 6 republica dominicana Interferencia de la luz
Interferencia de la luz Unidad fundamental de la vida
Unidad fundamental de la vida Como calcular el calor desprendido
Como calcular el calor desprendido Memos analiticos
Memos analiticos Https //padres.unidad ejecutiva.ml
Https //padres.unidad ejecutiva.ml Especies liricas
Especies liricas Neurona
Neurona Unidad en ingles
Unidad en ingles Unidades de medidas no estandarizadas ejemplos
Unidades de medidas no estandarizadas ejemplos Porque dios nos creó únicos e irrepetibles
Porque dios nos creó únicos e irrepetibles Educamos villamil
Educamos villamil Fuerza magnetica unidad
Fuerza magnetica unidad Unidad 12
Unidad 12 Unidad bit
Unidad bit Unidad 3 etapa 3 answers
Unidad 3 etapa 3 answers Claire bucaram de aivas
Claire bucaram de aivas Unidad educativa san juan bosco
Unidad educativa san juan bosco Unidad central de seguridad privada
Unidad central de seguridad privada Avancemos 3 unidad 3 leccion 1
Avancemos 3 unidad 3 leccion 1 Unidad trabajo
Unidad trabajo Torricelli unidad
Torricelli unidad Gravedad especifica
Gravedad especifica Unidad del trabajo
Unidad del trabajo Unidad 4 en romano
Unidad 4 en romano Derecho mercantil generalidades
Derecho mercantil generalidades Unidad derivada del sistema internacional
Unidad derivada del sistema internacional Unidad de medida de densidad
Unidad de medida de densidad Unidad de medida informatica
Unidad de medida informatica Enlace iónico ejemplos
Enlace iónico ejemplos