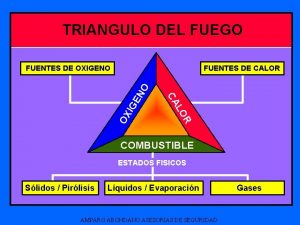
EL CALOR Q Energa en transito que se
























- Slides: 48

EL CALOR (Q) § Energía en transito, que se transmite de un cuerpo a otro en virtud de una diferencia de temperatura § El flujo normal y espontaneo del calor va desde el cuerpo de mayor temperatura al cuerpo de menor temperatura § El calor no se puede «guardar» . Por ejemplo, un termo para comida «no guarda el calor» , sino que mantiene la temperatura § El flujo de calor dura hasta que se consigue el equilibrio térmico

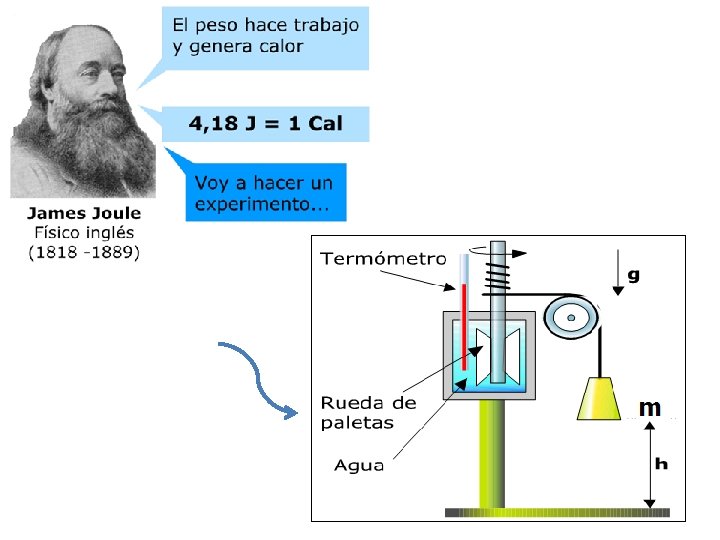
UNIDADES DE MEDIDA Como toda forma de energía el calor se mide en Joule (J) § § También se utiliza, como unidad de medida para el calor la caloría (cal) La unidad llamada caloría (cal) se define como la cantidad de calor que se necesita para elevar en 1ºC la temperatura de 1 gr de agua Equivalencia entre unidades




Observaciones: a) Se debe tener en cuenta el signo de Q a) Unidad de medida mas utilizada: b) ¿Cuál seria la unidad de medida en el sistema MKS?

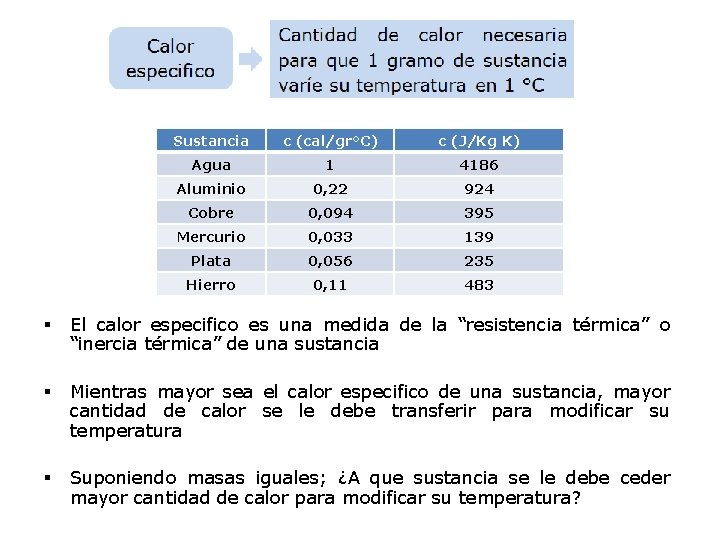
Sustancia c (cal/gr°C) c (J/Kg K) Agua 1 4186 Aluminio 0, 22 924 Cobre 0, 094 395 Mercurio 0, 033 139 Plata 0, 056 235 Hierro 0, 11 483 § El calor especifico es una medida de la “resistencia térmica” o “inercia térmica” de una sustancia § Mientras mayor sea el calor especifico de una sustancia, mayor cantidad de calor se le debe transferir para modificar su temperatura § Suponiendo masas iguales; ¿A que sustancia se le debe ceder mayor cantidad de calor para modificar su temperatura?

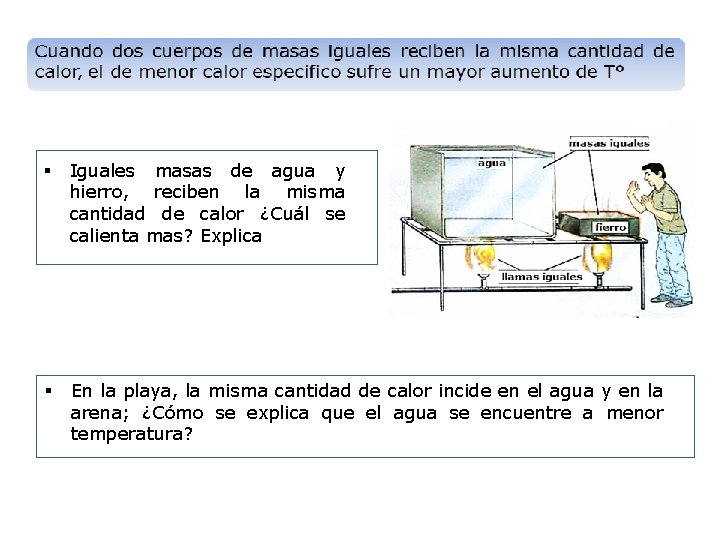
§ Iguales masas de agua y hierro, reciben la misma cantidad de calor ¿Cuál se calienta mas? Explica § En la playa, la misma cantidad de calor incide en el agua y en la arena; ¿Cómo se explica que el agua se encuentre a menor temperatura?

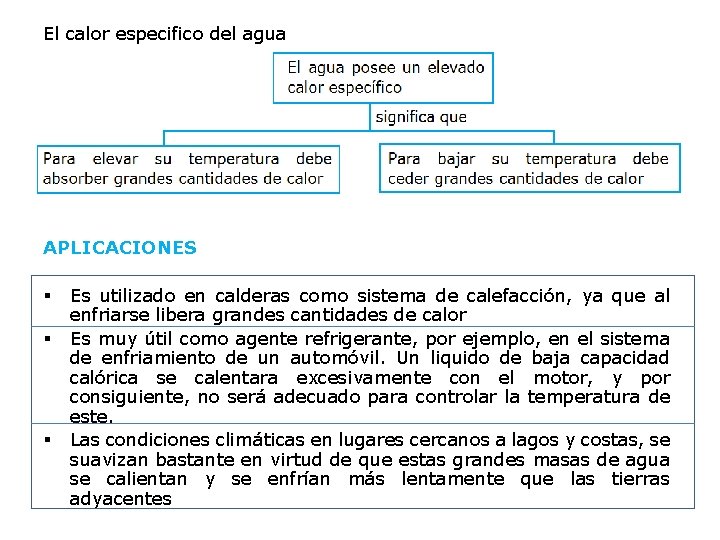
El calor especifico del agua APLICACIONES § § § Es utilizado en calderas como sistema de calefacción, ya que al enfriarse libera grandes cantidades de calor Es muy útil como agente refrigerante, por ejemplo, en el sistema de enfriamiento de un automóvil. Un liquido de baja capacidad calórica se calentara excesivamente con el motor, y por consiguiente, no será adecuado para controlar la temperatura de este. Las condiciones climáticas en lugares cercanos a lagos y costas, se suavizan bastante en virtud de que estas grandes masas de agua se calientan y se enfrían más lentamente que las tierras adyacentes

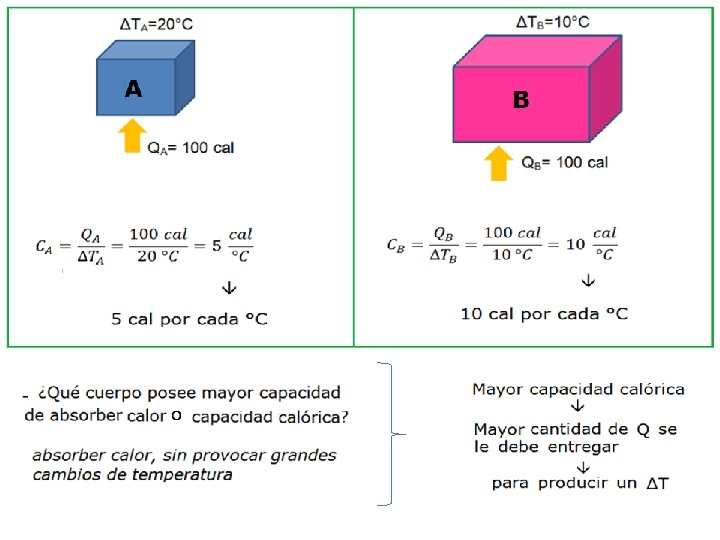
CAPACIDAD CALORICA “C” § Relación entre el calor absorbido o cedido por un cuerpo y la variación de temperatura producida § Unidad de medida: § Otra expresión:



EJEMPLOS

PREGUNTAS: 1. ¿De qué factores depende el calor cedido o absorbido por un cuerpo? 2. ¿Qué se entiende por CALOR ESPECÍFICO de una sustancia o material? 3. -¿Qué significa que el calor específico del Aluminio sea: 0, 22 (cal/g ºC)? 4. Si transferimos la misma cantidad de energía en forma de calor a iguales masas de Agua y Hierro, ¿cuál experimentará mayor variación de sus temperatura? , ¿por qué? 5. ¿Por qué el agua es buen refrigerante? 6. - Dos bloques de plomo A y B sufren la misma variación de temperatura ∆t= 50ºC. La masa del bloque P es el doble de la masa del bloque Q. ¿Cuál es la razón QA/QB?

7. Se tienen 4 cuerpos A, B, C y D de calores específicos en (cal/g. ºC) iguales a 0. 24; 0. 02; 0. 08 y 0. 12; respectivamente. Si todos son de la misma masa y están a la misma Tº a) ¿Cuál se enfría más rápido? b) ¿A cuál hay que suministrarle más energía para que aumente su Tº en 10ºC? c) Si a todos se les suministra igual cantidad de energía (Q) en forma de calor, señale el orden de menor a mayor Tº con quedan. 8. - Suponga que dos bloques, A y B, de cinc ambos, tienen masas m. A y m. B tales que m. A>m. B. a) ¿El calor especifico de A es mayor, menor o igual al de B? b) ¿La capacidad calórica de A es mayor, menor o igual al de B? c) Si A y B experimentaran la misma disminución de temperatura, ¿Cuál liberaría mayor cantidad de calor?

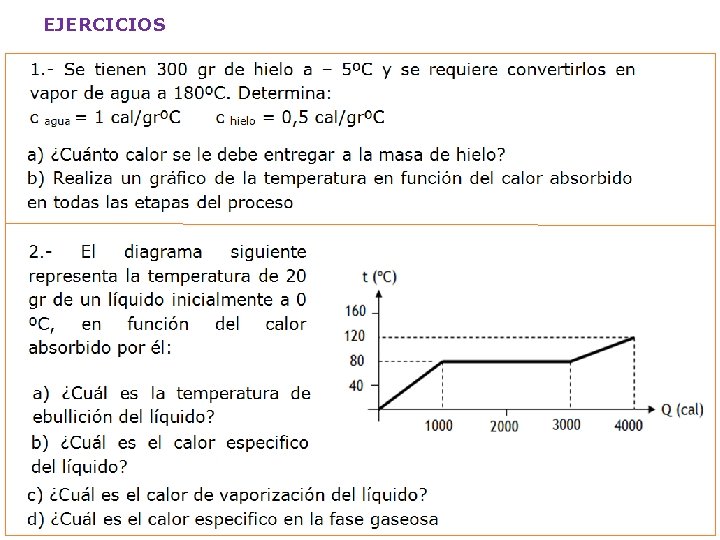
EJERCICIOS

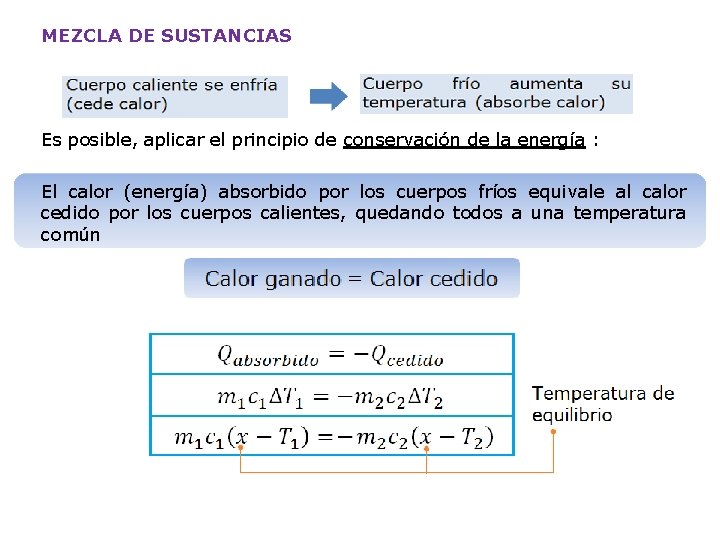
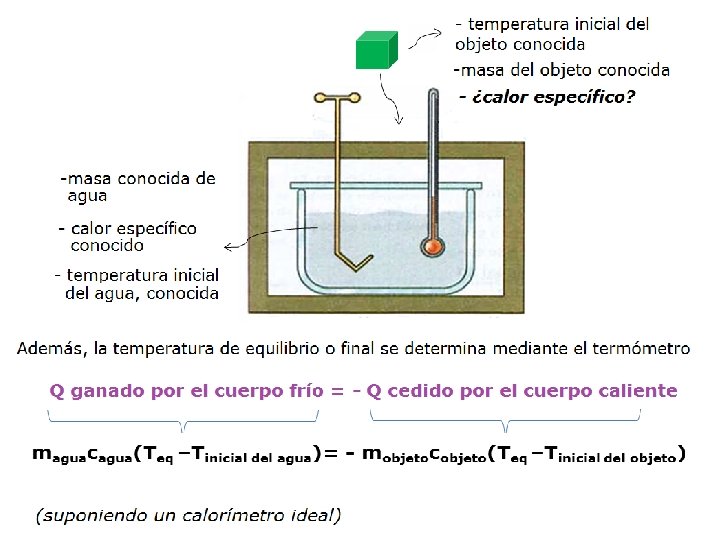
MEZCLA DE SUSTANCIAS Es posible, aplicar el principio de conservación de la energía : El calor (energía) absorbido por los cuerpos fríos equivale al calor cedido por los cuerpos calientes, quedando todos a una temperatura común

Aplicación: “el calorímetro” Recipiente térmicamente aislado que se utiliza para determinar el calor especifico de un solido o liquido cualquiera.


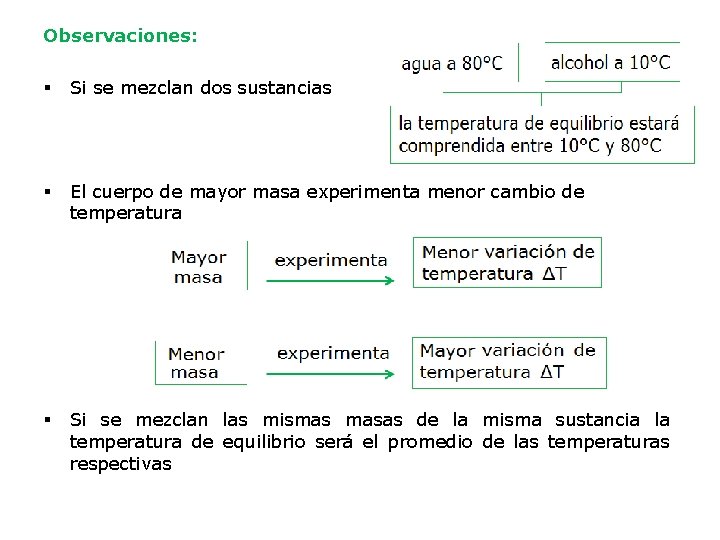
Observaciones: § Si se mezclan dos sustancias § El cuerpo de mayor masa experimenta menor cambio de temperatura § Si se mezclan las mismas masas de la misma sustancia la temperatura de equilibrio será el promedio de las temperaturas respectivas

EJEMPLOS:

EJERCICIOS

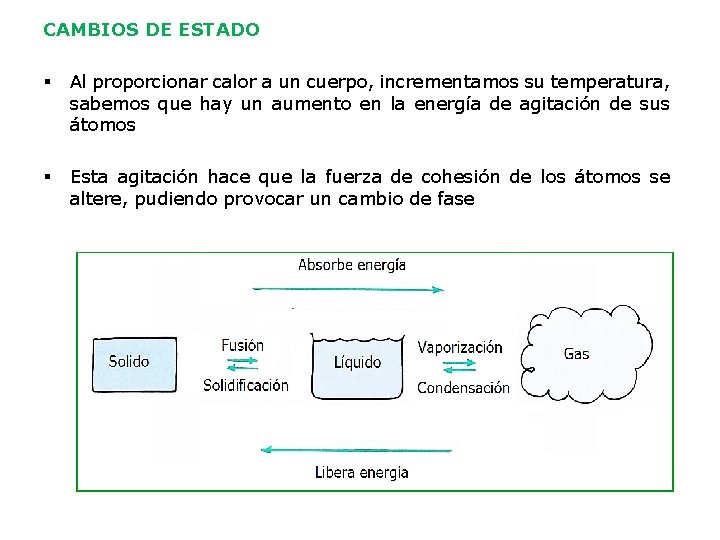
CAMBIOS DE ESTADO § Al proporcionar calor a un cuerpo, incrementamos su temperatura, sabemos que hay un aumento en la energía de agitación de sus átomos § Esta agitación hace que la fuerza de cohesión de los átomos se altere, pudiendo provocar un cambio de fase

LEYES GENERALES DE LOS CAMBIOS DE ESTADO

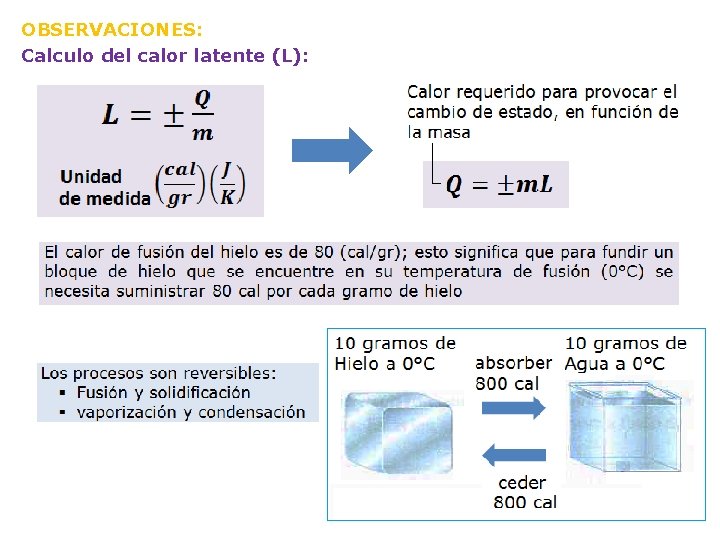
OBSERVACIONES: Calculo del calor latente (L):

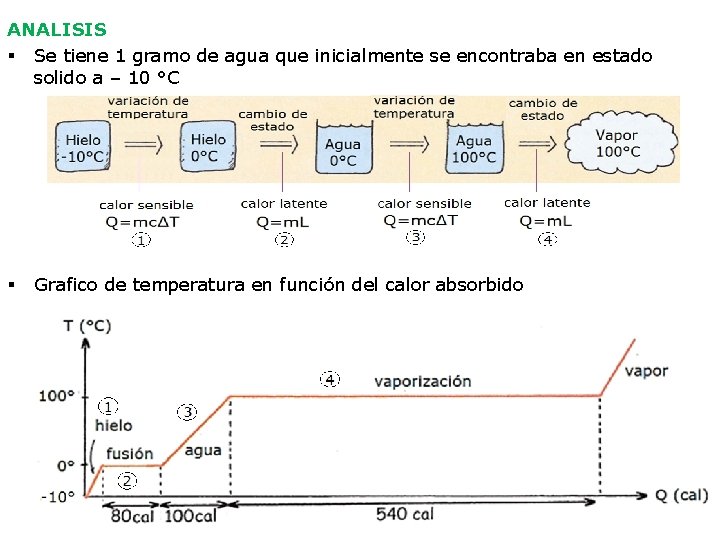
ANALISIS § Se tiene 1 gramo de agua que inicialmente se encontraba en estado solido a – 10 °C § Grafico de temperatura en función del calor absorbido

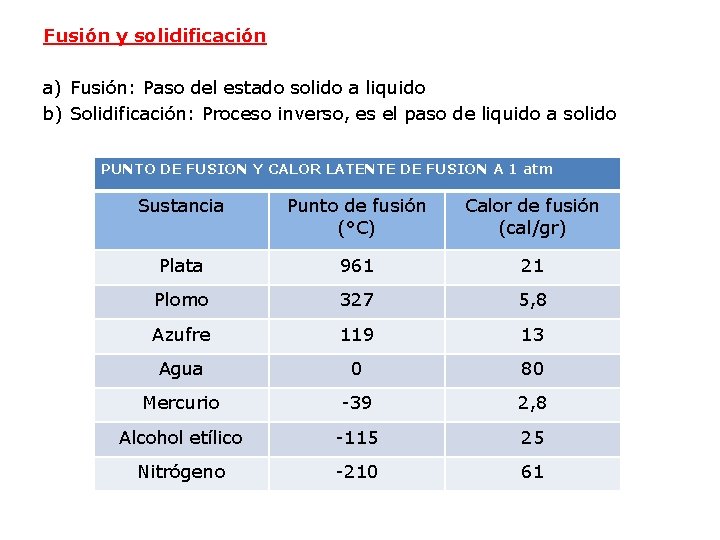
Fusión y solidificación a) Fusión: Paso del estado solido a liquido b) Solidificación: Proceso inverso, es el paso de liquido a solido PUNTO DE FUSION Y CALOR LATENTE DE FUSION A 1 atm Sustancia Punto de fusión (°C) Calor de fusión (cal/gr) Plata 961 21 Plomo 327 5, 8 Azufre 119 13 Agua 0 80 Mercurio -39 2, 8 Alcohol etílico -115 25 Nitrógeno -210 61

Vaporización y condensación a) Vaporización: Cambio de estado liquido a gaseoso que puede producirse de dos maneras:

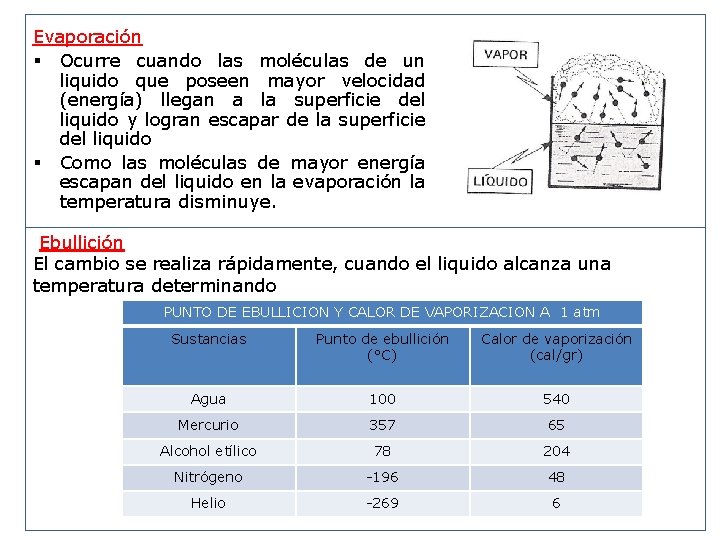
Evaporación § Ocurre cuando las moléculas de un liquido que poseen mayor velocidad (energía) llegan a la superficie del liquido y logran escapar de la superficie del liquido § Como las moléculas de mayor energía escapan del liquido en la evaporación la temperatura disminuye. Ebullición El cambio se realiza rápidamente, cuando el liquido alcanza una temperatura determinando PUNTO DE EBULLICION Y CALOR DE VAPORIZACION A 1 atm Sustancias Punto de ebullición (°C) Calor de vaporización (cal/gr) Agua 100 540 Mercurio 357 65 Alcohol etílico 78 204 Nitrógeno -196 48 Helio -269 6

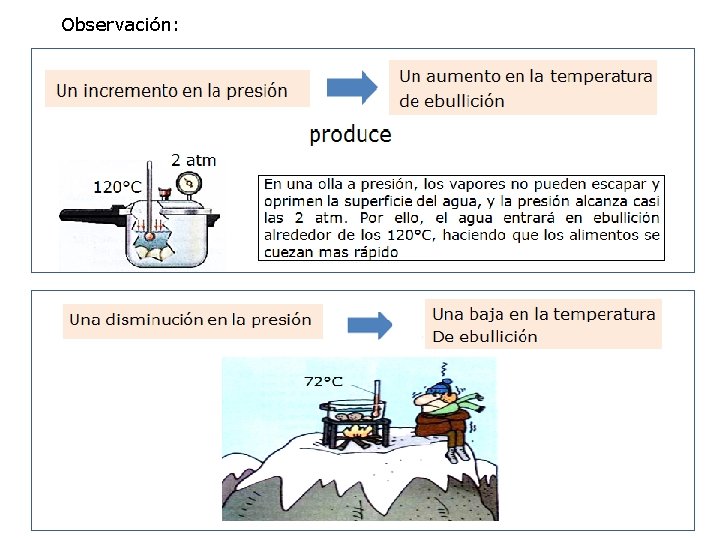
Observación:

EJEMPLOS:

EJERCICIOS


PREGUNTAS

EJERCICIOS

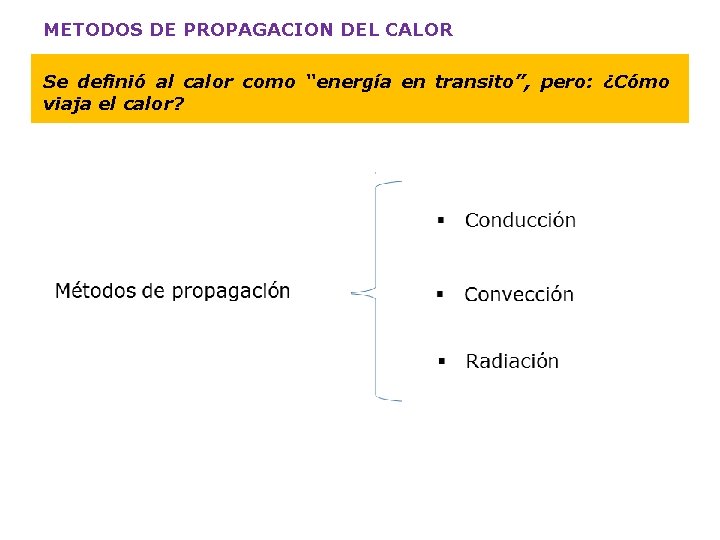
METODOS DE PROPAGACION DEL CALOR Se definió al calor como “energía en transito”, pero: ¿Cómo viaja el calor?

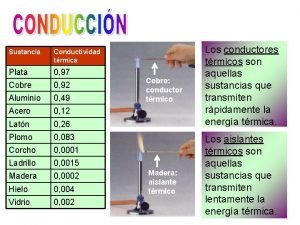
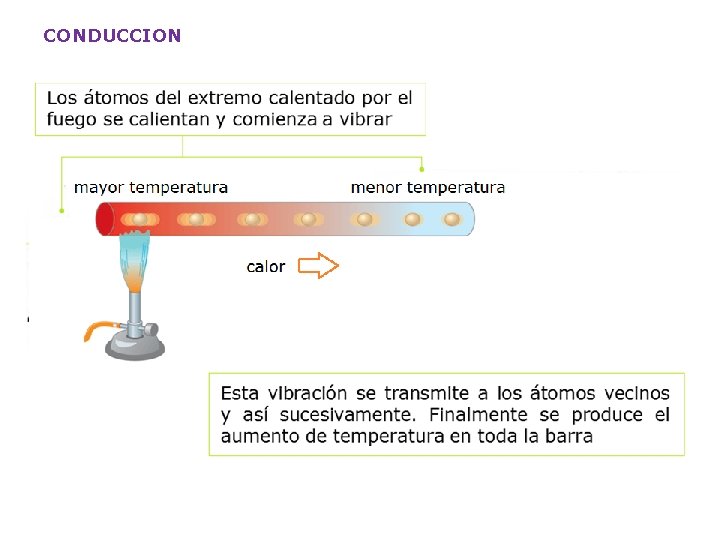
CONDUCCION

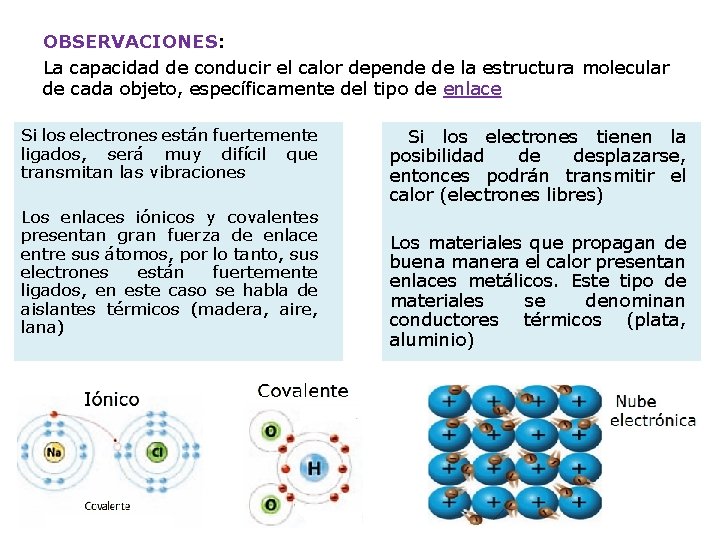
OBSERVACIONES: La capacidad de conducir el calor depende de la estructura molecular de cada objeto, específicamente del tipo de enlace Si los electrones están fuertemente ligados, será muy difícil que transmitan las vibraciones Los enlaces iónicos y covalentes presentan gran fuerza de enlace entre sus átomos, por lo tanto, sus electrones están fuertemente ligados, en este caso se habla de aislantes térmicos (madera, aire, lana) Si los electrones tienen la posibilidad de desplazarse, entonces podrán transmitir el calor (electrones libres) Los materiales que propagan de buena manera el calor presentan enlaces metálicos. Este tipo de materiales se denominan conductores térmicos (plata, aluminio)

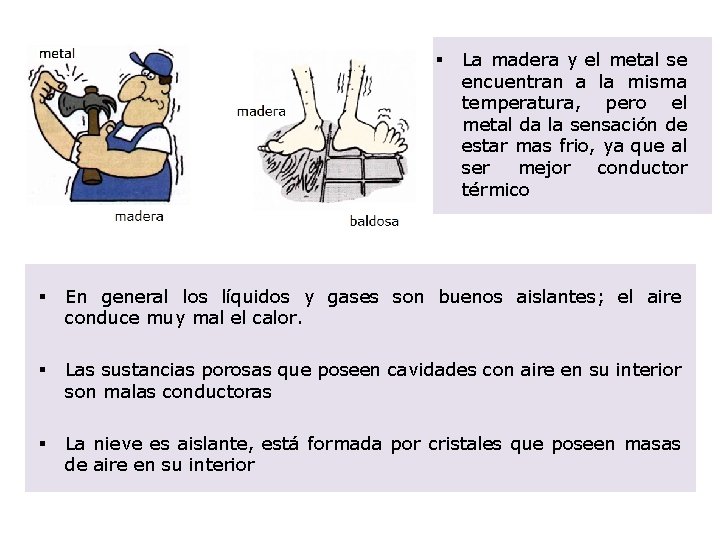
§ La madera y el metal se encuentran a la misma temperatura, pero el metal da la sensación de estar mas frio, ya que al ser mejor conductor térmico § En general los líquidos y gases son buenos aislantes; el aire conduce muy mal el calor. § Las sustancias porosas que poseen cavidades con aire en su interior son malas conductoras § La nieve es aislante, está formada por cristales que poseen masas de aire en su interior

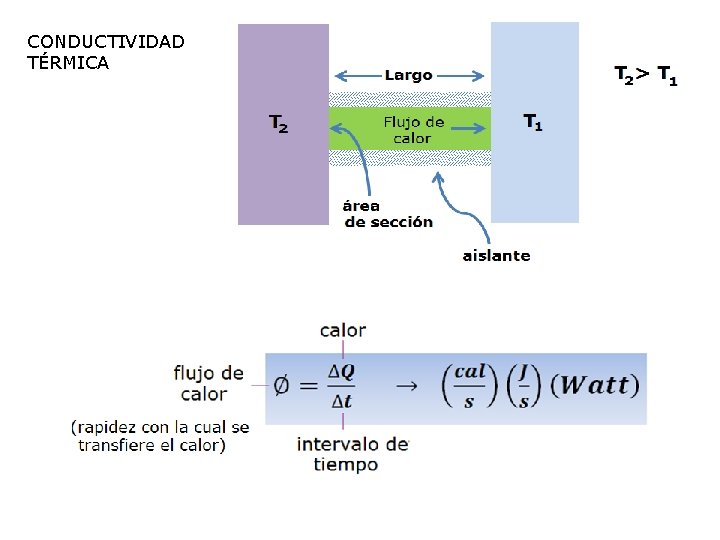
CONDUCTIVIDAD TÉRMICA

§ Experimentalmente se demostro que: § Introduciendo la constante de proporcionalidad (K)

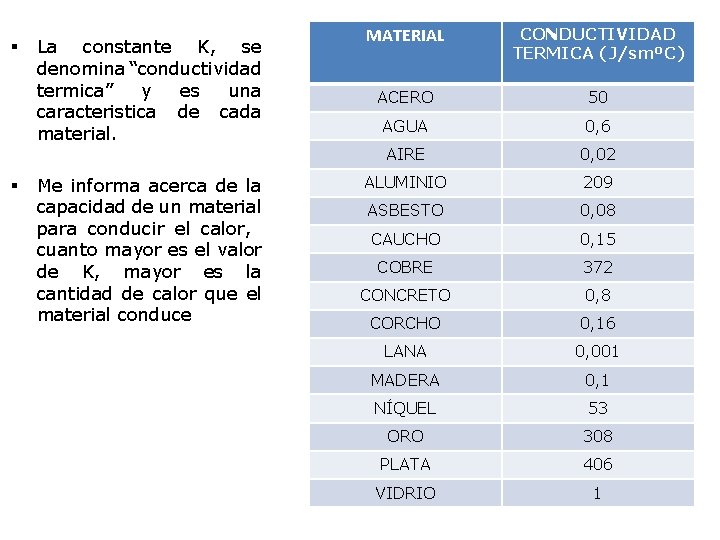
§ § La constante K, se denomina “conductividad termica” y es una caracteristica de cada material. Me informa acerca de la capacidad de un material para conducir el calor, cuanto mayor es el valor de K, mayor es la cantidad de calor que el material conduce MATERIAL CONDUCTIVIDAD TERMICA (J/smºC) ACERO 50 AGUA 0, 6 AIRE 0, 02 ALUMINIO 209 ASBESTO 0, 08 CAUCHO 0, 15 COBRE 372 CONCRETO 0, 8 CORCHO 0, 16 LANA 0, 001 MADERA 0, 1 NÍQUEL 53 ORO 308 PLATA 406 VIDRIO 1

CONVECCION Los líquidos y gases (fluidos) transmiten el calor por convección 1. El fluido se calienta y sus moléculas se agitan alejándose unas de otras 2. Esto provoca que el fluido se haga menos denso, y asciende 3. Por lo tanto baja el fluido mas denso y frio 4. Así se producen corrientes de convección, donde el fluido mas caliente se aleja de la fuente de calor, y el fluido más frio se mueve hacia la fuente de calor

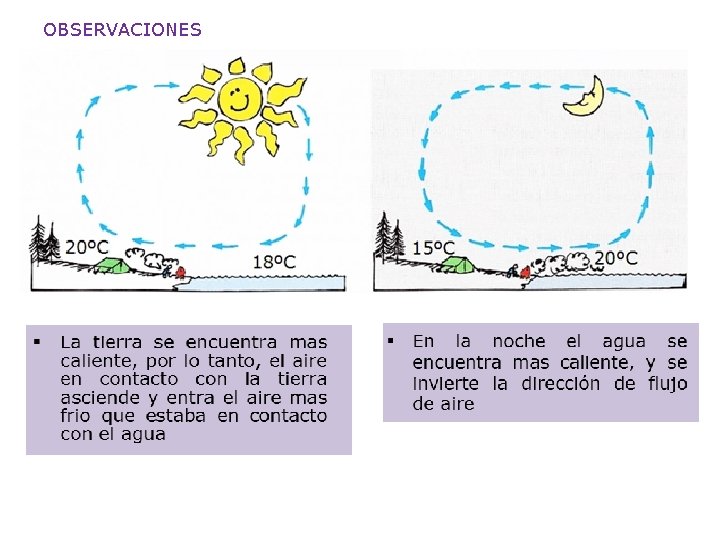
OBSERVACIONES


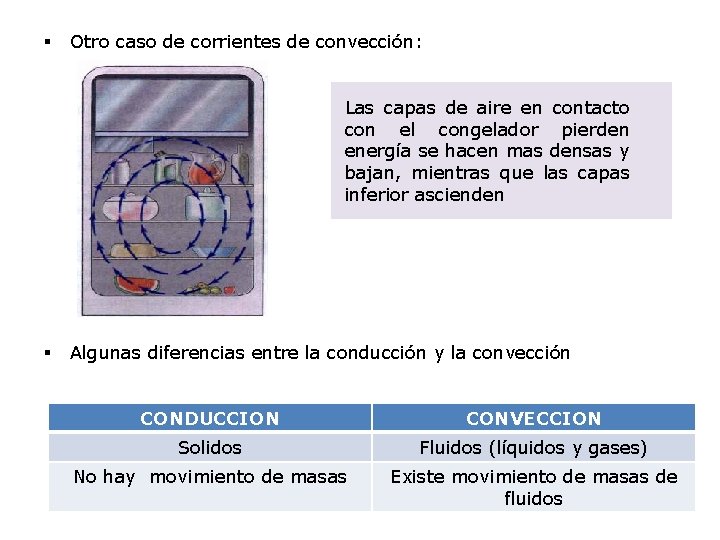
§ Otro caso de corrientes de convección: Las capas de aire en contacto con el congelador pierden energía se hacen mas densas y bajan, mientras que las capas inferior ascienden § Algunas diferencias entre la conducción y la convección CONDUCCION CONVECCION Solidos Fluidos (líquidos y gases) No hay movimiento de masas Existe movimiento de masas de fluidos

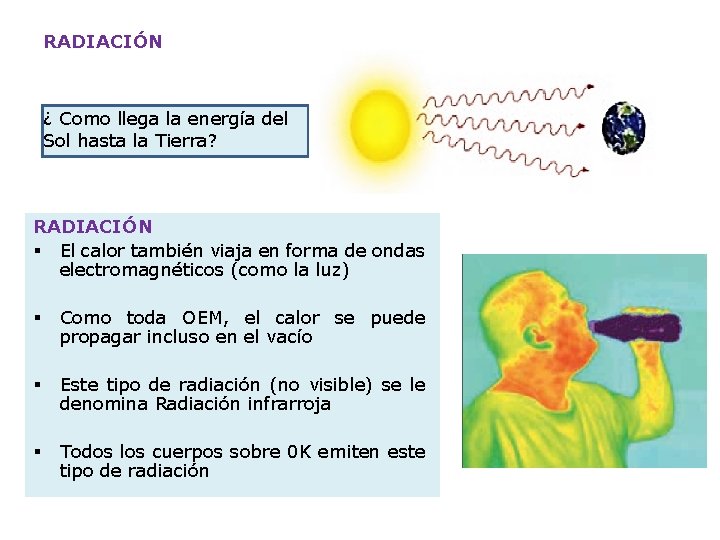
RADIACIÓN ¿ Como llega la energía del Sol hasta la Tierra? RADIACIÓN § El calor también viaja en forma de ondas electromagnéticos (como la luz) § Como toda OEM, el calor se puede propagar incluso en el vacío § Este tipo de radiación (no visible) se le denomina Radiación infrarroja § Todos los cuerpos sobre 0 K emiten este tipo de radiación

CUESTIONARIO
 Energia potencial gravitacional
Energia potencial gravitacional Energa solar
Energa solar Exergonico y exotermico
Exergonico y exotermico Segunda ley de angot
Segunda ley de angot Transito generado
Transito generado Sinalização semafórica de advertência
Sinalização semafórica de advertência El papa y el nuevo orden mundial
El papa y el nuevo orden mundial Señales de transito rojas
Señales de transito rojas Calor latente del aluminio
Calor latente del aluminio Donde se coloca un policia para tocar su silbato
Donde se coloca un policia para tocar su silbato Art 165 ley de transito
Art 165 ley de transito Que es el inventario final
Que es el inventario final Formal commands
Formal commands Definicion de valor monetario
Definicion de valor monetario Capsuloendoscopia
Capsuloendoscopia Normas de transito para niños
Normas de transito para niños Divieto di transito 7 5 t
Divieto di transito 7 5 t Demarcaciones viales en colombia colores
Demarcaciones viales en colombia colores Quien es transito amaguaña
Quien es transito amaguaña Sales de tránsito
Sales de tránsito Mapa mental de educación vial
Mapa mental de educación vial Señales de transito preventivas
Señales de transito preventivas Fluxo de calor
Fluxo de calor O que é quantidade de calor
O que é quantidade de calor Que es el coeficiente global de transferencia de calor
Que es el coeficiente global de transferencia de calor Coeficiente global de transferencia de calor
Coeficiente global de transferencia de calor Equilíbrio termico exemplo
Equilíbrio termico exemplo Que es la temperatura
Que es la temperatura Site:slidetodoc.com
Site:slidetodoc.com Calor especifico del acero
Calor especifico del acero Triangulo de calor
Triangulo de calor Transferencia de calor e massa
Transferencia de calor e massa Termologia conceitos fundamentais
Termologia conceitos fundamentais Procesos termodinamicos
Procesos termodinamicos Teoria del fuego
Teoria del fuego Calor especifico a presion constante
Calor especifico a presion constante Tipos de calor
Tipos de calor Velocidad de transferencia de calor
Velocidad de transferencia de calor Efectos
Efectos Conductividad de calor de la plata
Conductividad de calor de la plata Constante de calor especifico
Constante de calor especifico Propriedades térmicas da madeira
Propriedades térmicas da madeira Formas de propagação de calor 7 ano slide
Formas de propagação de calor 7 ano slide Calor cedido formula
Calor cedido formula Alto calor específico
Alto calor específico Mapa conceitual de temperatura e calor
Mapa conceitual de temperatura e calor Grafito calor especifico
Grafito calor especifico Troca de calor
Troca de calor Certa maquina termica recebe 500 j de calor
Certa maquina termica recebe 500 j de calor