CALOR Conceptos Generales CALOR QU ES EL CALOR








































- Slides: 57

CALOR

Conceptos Generales • CALOR: ¿QUÉ ES EL CALOR? • La palabra calor es un término muy común en nuestro lenguaje cotidiano. A diario escuchamos frases como: “hace mucho calor”, “está caliente”, etc. Pero ¿qué es el calor? • Es una forma de energía, que generalmente se asocia con la energía transferida entre distintos sistemas; en el lenguaje cotidiano, cuando ponemos un cuerpo frente a una fuente de calor (una cocina, estufa, etc. ) decimos que le aplicamos calor al cuerpo.


• Se llama calor a la energía que pasa de un cuerpo a otro, modificándose la Energía Interna de ambos. Para que haya transferencia de calor son precisos dos cuerpos a diferente temperatura o que uno ejerza un trabajo de rozamiento sobre el otro. • El calor es la energía que tiene un objeto debida al movimiento de sus átomos y moléculas que están constantemente vibrando, moviéndose y chocando unas con otras. Cuando añadimos energía a un objeto, sus átomos y moléculas se mueven más deprisa, incrementando su energía de movimiento o calor. Incluso los objetos más fríos poseen algo de calor porque sus átomos se están moviendo. • La materia está compuesta de átomos y moléculas (que son grupos de átomos) y la energía hace que los átomos y las moléculas estén en constante movimiento - rotando alrededor de si mismas, vibrando o chocándose unas con otras. • El movimiento de los átomos y moléculas crea una forma de energía llamada calor o energía térmica, que está presente en todo tipo de materia. Incluso en los vacios más frío de espacio hay materia que posee calor, muy pequeño pero medible.

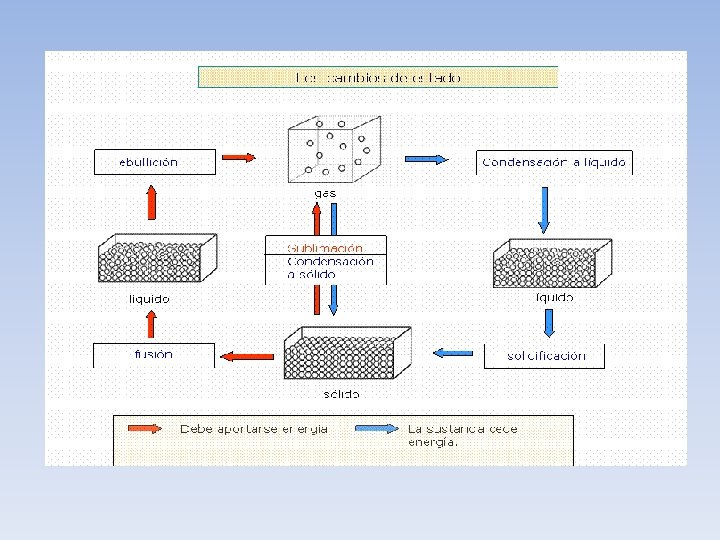
• Pero de dónde proviene esta energía? en realidad, el calor es una forma de movimiento que lleva energía asociada. Y las partículas en movimiento de las que estamos hablando son los átomos y moléculas que componen todos los objetos que nos rodean, por ejemplo, animales, aire, plantas, estrellas y hasta nosotros mismos. • Un ejemplo claro es el agua. A bajas temperaturas, el movimiento de las moléculas del agua, es decir su agitación térmica, es muy bajo, apenas vibran y se mantienen inmovilizadas en un sólido: el hielo. • Al aumentar la temperatura, la agitación térmica comienza a aumentar y las moléculas van adquiriendo más energía y comienzan a alejarse un poco entre sí aumentando su movimiento, lo que obtenemos es un líquido: el agua líquida.


• La energía puede presentarse de muy diferentes formas y pude cambiar de una a otra. Muchos tipos de energía pueden convertirse en calor. La energía electromagnética (luz), la electrostática (o eléctrica), la mecánica, la química, la nuclear, el sonido y la térmica, pueden calentar una sustancia haciendo que se incremente la velocidad de sus moléculas. • Si ponemos energía en un sistema éste se calienta, si quitamos energía se enfría. Por ejemplo, si estamos fríos podríamos ponernos a saltar para entrar en calor. • Estos son algunos ejemplos de los diferentes tipos de energía que pueden convertirse en energía térmica (calor).

La energía mecánica se convierte en energía térmica siempre que botamos una pelota. Cada vez que la pelota rebota en el suelo parte de la energía de su movimiento (energía cinética) se convierte en calor, haciendo que la pelota cada vez rebote menos. A continuación un ejemplo: Imagen térmica infrarroja de una pelota de tenis antes (izquierda) y después (derecha) de ser golpeada por la raqueta.

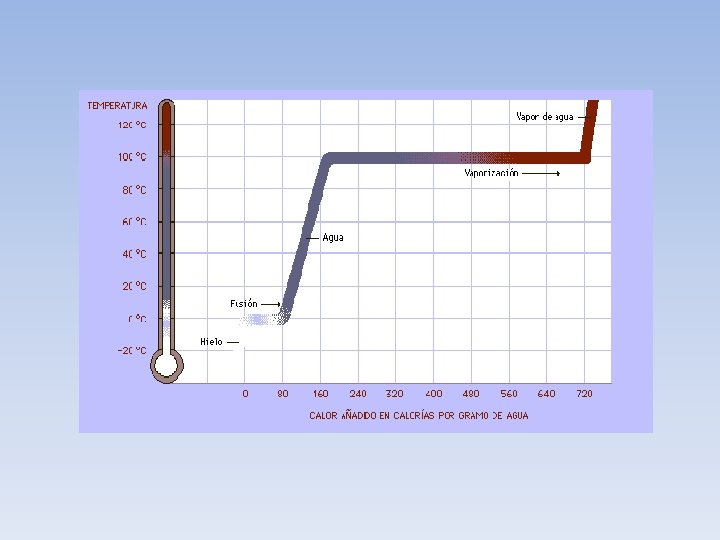
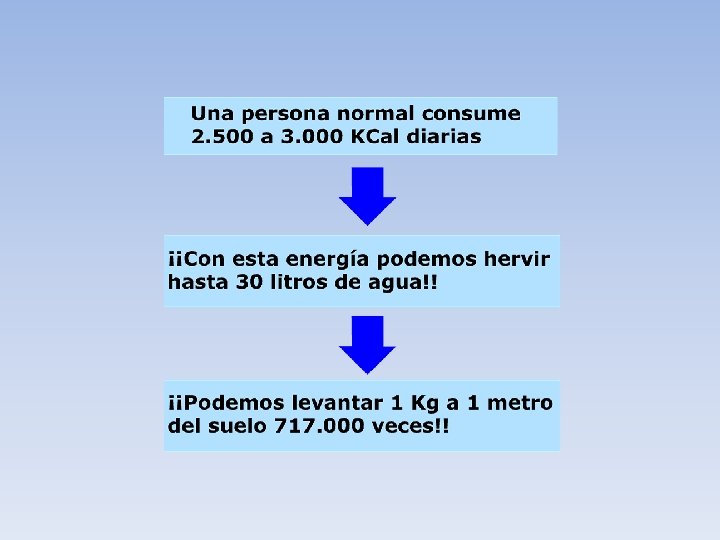
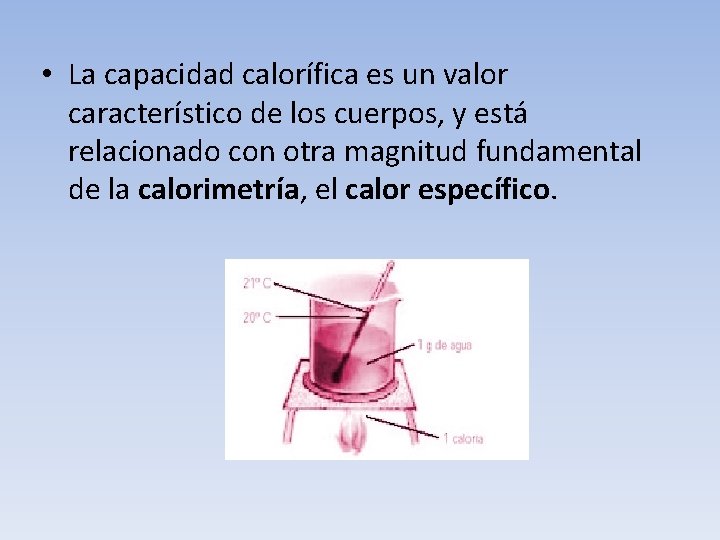
• QUE ES CALORÍA? • Es la cantidad necesaria de CALOR para subir la temperatura de 1 gramo de agua en 1ºC (de 14, 5º a 15, 5ºC, a presión atmosférica). La kilocaloría (símbolo Kcal) es igual a 1000 cal. Una caloría es equivalente a 4, 1868 J. • Una vez demostrado que el calor es una forma de energía se halló su equivalencia con otras unidades que surgieron del estudio de la energía mecánica.

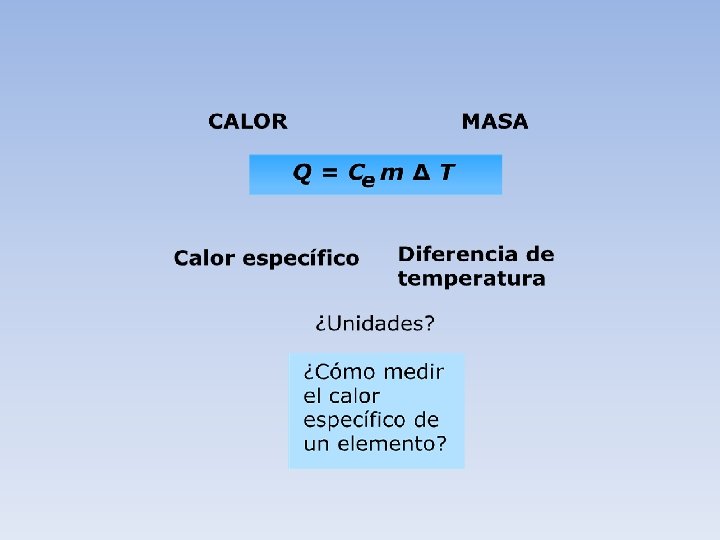
El calor específico de una sustancia o sistema termodinámico es una magnitud física que se define como la cantidad de calor que hay que suministrar a la unidad de masa del sistema considerado para elevar su temperatura en una unidad (kelvin o grado Celsius) a partir de una temperatura dada; en general, el valor del calor específico depende de dicha temperatura inicial. Se la representa con la letra (minúscula). • En forma análoga, se define la capacidad calorífica de una sustancia o sistema termodinámico como la cantidad de calor que hay que suministrarle para elevar su temperatura en una unidad kelvin o grado Celsius) a partir de una temperatura dada. Se la representa con la letra (mayúscula). • Obviamente, el calor específico es la capacidad calorífica específica, esto es c = C / m





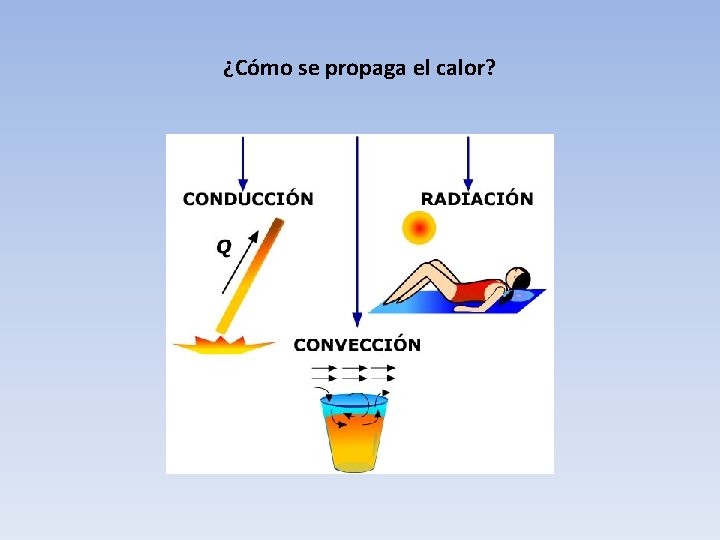
¿Cómo se propaga el calor?

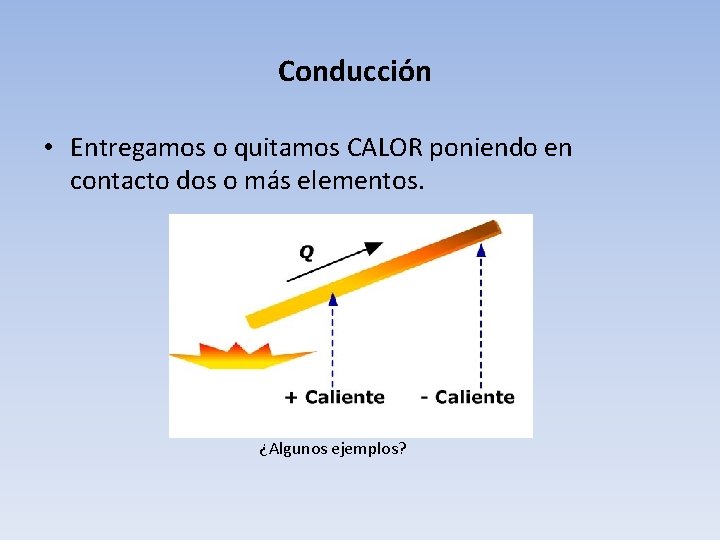
Conducción • Entregamos o quitamos CALOR poniendo en contacto dos o más elementos. ¿Algunos ejemplos?

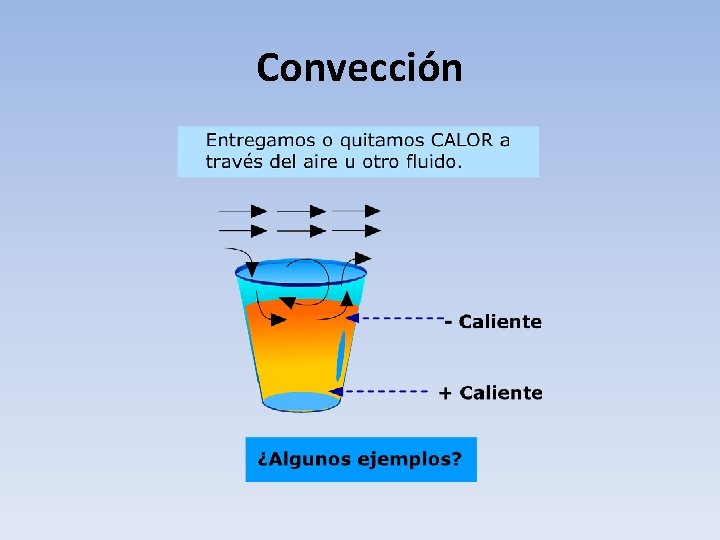
Convección

Radiación




¿Que es la Termodinámica? • La termodinámica es una parte de la física que estudia las relaciones existentes entre los fenómenos dinámicos y los caloríficos. • Trata de la transformación de la energía mecánica en calor y del calor en trabajo. También describe y relaciona las propiedades físicas de sistemas macroscópicos de materia y energía. • La termodinámica estudia los sistemas que se encuentran en equilibrio. Esto significa que las propiedades del sistema —típicamente la presión, la temperatura, el volumen y la masa— son constantes. • Un concepto esencial de la termodinámica es el de sistema macroscópico, que se define como un conjunto de materia que se puede aislar espacialmente y que coexiste con un entorno infinito e imperturbable. El estado de un sistema macroscópico en equilibrio puede describirse mediante propiedades medibles como la temperatura, la presión o el volumen, que se conocen como variables termodinámicas. Es posible identificar y relacionar entre sí muchas otras variables (como la densidad, el calor específico, la compresibilidad o el coeficiente de expansión térmica), con lo que se obtiene una descripción más completa de un sistema y de su relación con el entorno. • Cuando un sistema macroscópico pasa de un estado de equilibrio a otro, se dice que tiene lugar un proceso termodinámico.

Calorimetría. Capacidad calorífica y calor específico • En un sentido amplio, la calorimetría se desarrolló históricamente como una técnica destinada a fabricar aparatos y procedimientos que permitieran medir la cantidad de calor desprendida o absorbida en una reacción mecánica, eléctrica, química o de otra índole. Esta disciplina, encuadrada dentro de la termodinámica, se ha especializado sobre todo, con el paso del tiempo, en la determinación del calor específico de los cuerpos y los sistemas físicos.

CAPACIDAD CALORÍFICA La capacidad calorífica de un cuerpo es razón de la cantidad de energía calorífica transferida a un cuerpo en un proceso cualquiera por su cambio de temperatura correspondiente, es decir, es la energía necesaria para aumentar 1 K su temperatura, (usando el S. I. ). Indica la mayor o menor dificultad que presenta dicho cuerpo para experimentar cambios de temperatura bajo el suministro de calor.

• Para medirla bajo unas determinadas condiciones es necesario comparar el calor absorbido por una sustancia (o un sistema) con el incremento de temperatura resultante. La capacidad calorífica viene dada por:

Donde: • C es la capacidad calorífica, que en general será función de las variables de estado. • Q es el calor absorbido por el sistema • es la variación de la temperatura. Se mide en unidades del S. I. joules/K (o también el cal/°C)

Ejemplo • Rumford, taladrando tubos de metal para construir cañones, se dio cuenta de que cuanto más roma estaba la broca más calor se desprendía.

• La capacidad calorífica es un valor característico de los cuerpos, y está relacionado con otra magnitud fundamental de la calorimetría, el calor específico.

• Si el calor estuviera retenido en l cuerpo impregnándolo saldría más cuanto más se desmenuzara la materia en virutas… pero no era así, era justo al revés. (Benjamín Thomson – Conde Rumford). • ¡El calor se generaba al rozar la broca con el metal! ¡La energía cinética de la broca se transformaba en calor!

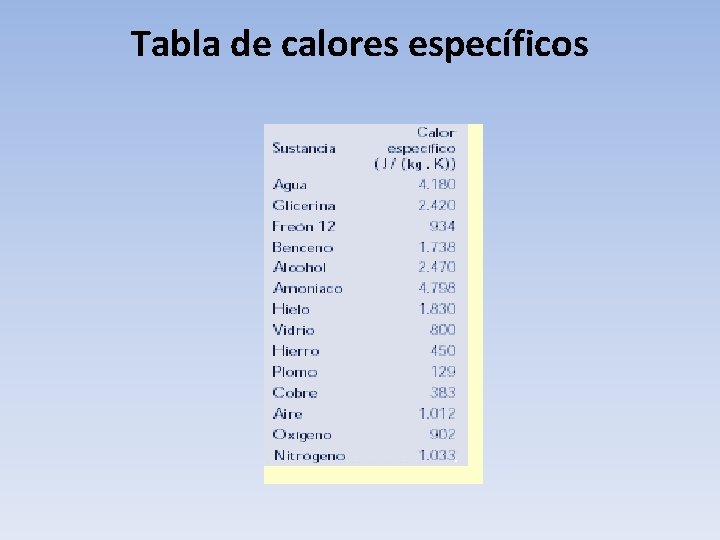
Calor Especifico • El valor de la capacidad calorífica por unidad de masa se conoce como calor específico. En términos matemáticos, esta relación se expresa como: • donde c es el calor específico del cuerpo, m su masa, C la capacidad calorífica, Q el calor aportado y DT el incremento de temperatura. El calor específico es característico para cada sustancia y, en el Sistema Internacional, se mide en julios por kilogramo y kelvin (J/(kg·K)). A título de ejemplo, el calor específico del agua es igual a: • Del estudio del calor específico del agua se obtuvo, históricamente, el valor del equivalente mecánico del calor, ya que:

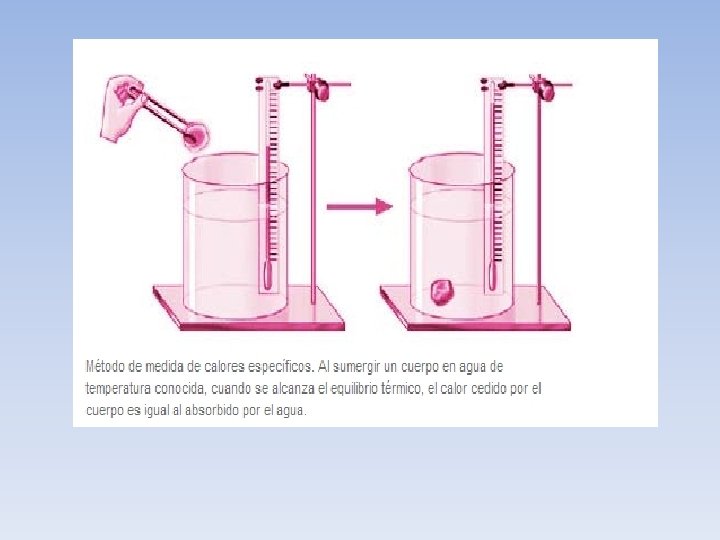
Calorimetrìa • La determinación del calor específico de los cuerpos constituye uno de los fines primordiales de la calorimetría. • El procedimiento más habitual para medir calores específicos consiste en sumergir una cantidad del cuerpo sometido a medición en un baño de agua de temperatura conocida. Suponiendo que el sistema está aislado, cuando se alcance el equilibrio térmico se cumplirá que el calor cedido por el cuerpo será igual al absorbido por el agua, o a la inversa.


• Como la energía calorífica cedida ha de ser igual a la absorbida, se cumple que: • siendo m la masa del cuerpo sumergido, c su calor específico, T la temperatura inicial del cuerpo, ma la masa de agua, ca el calor específico del agua, Ta la temperatura inicial del agua y Tf la temperatura final de equilibrio. Todos los valores de la anterior expresión son conocidos, excepto el calor específico del cuerpo, que puede por tanto deducirse y calcularse de la misma.

Calor específico de los gases • En el caso de los gases, ha de distinguirse entre calor específico a volumen constante (cv) y a presión constante (cp). Por el primer principio de la termodinámica, y dado que el calentamiento de un gas a volumen constante no produce trabajo, se tiene que:

• En el caso particular de gases diluidos, la vinculación entre el calor específico a presión y a volumen constante sigue la llamada relación de J. R. Mayer (1814 -1878): • siendo Nm el número de moles por unidad de masa y R la constante universal de los gases perfectos.

Tabla de calores específicos

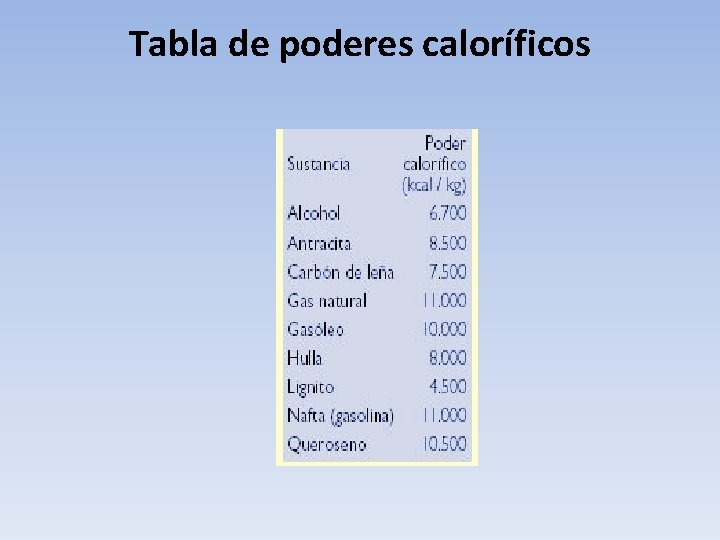
Poder calorífico • Se llama poder calorífico al calor que se libera en el proceso de combustión de un cuerpo, llamado combustible. El poder calorífico se mide como la cantidad de calorías o kilocalorías que se desprenden en la combustión de 1 kg de masa del material combustible.

Tabla de poderes caloríficos

• Como la energía calorífica cedida ha de ser igual a la absorbida, se cumple que: • siendo m la masa del cuerpo sumergido, c su calor específico, T la temperatura inicial del cuerpo, ma la masa de agua, ca el calor específico del agua, Ta la temperatura inicial del agua y Tf la temperatura final de equilibrio. Todos los valores de la anterior expresión son conocidos, excepto el calor específico del cuerpo, que puede por tanto deducirse y calcularse de la misma

• El calor es por lo tanto una forma de energía. Es la “energía calorífica”. Un inglés llamado J. P. Joule halló su equivalencia con las unidades de trabajo. La energía puede presentarse de muy diferentes formas y puede cambiar de una forma a otra.

APLICACIÓN EN PREVENCIÓN En esta oportunidad ejemplificaremos la utilidad de la capacidad calorífica en trabajadores que laboran en frigoríficos, ya que al estar expuestos a temperaturas bajo 0 °C deben usar trajes térmicos especialmente diseñados con la finalidad de guardar y mantener el calor, ya que de no tener estos implementos ciertamente estos trabajadores se verían expuestos a hipotermia.

Tema: Capacidad Calorífica

La capacidad calorífica de un cuerpo es razón de la cantidad de energía calorífica transferida a un cuerpo en un proceso cualquiera por su cambio de temperatura correspondiente. En una forma menos formal es la energía necesaria para aumentar 1 K su temperatura, (usando el SI). Indica la mayor o menor dificultad que presenta dicho cuerpo para experimentar cambios de temperatura bajo el suministro de calor.

Puede interpretarse como una medida de inercia térmica. Es una propiedad extensiva, ya que su magnitud depende de la cantidad de material en el objeto por ejemplo; La capacidad calorífica del agua de una piscina olímpica será mayor que la de una cucharadita. Al ser una propiedad extensiva, la capacidad calorífica es característica de un objeto en particular, y además depende de la temperatura y posiblemente de la presión.

La capacidad calorífica no debe ser confundida con la capacidad calorífica específica o calor específico; el cual es la propiedad intensiva que se refiere a la capacidad de un cuerpo para almacenar calor, y es la razón de la capacidad calorífica entre la masa del objeto. El calor específico es una propiedad característica de las sustancias y depende de las mismas variables que la capacidad calorífica.

Medida de la Capacidad Calorífica Para medir la capacidad calorífica bajo unas determinadas condiciones es necesario comparar el calor absorbido por una sustancia (o un sistema) con el incremento de temperatura resultante. La capacidad calorífica viene dada por: Donde: C es la capacidad calorífica, que en general será función de las variables de estado. Q es el calor absorbido por el sistema. ΔT la variación de temperatura. Se mide en unidades del SI joules/K (o también el cal/ºC).

La capacidad calorífica (C) de un sistema físico depende de la cantidad de sustancia o masa de dicho sistema. Para un sistema formado por una sola sustancia homogénea se define además el calor específico o capacidad calorífica específica c a partir de la relación: Donde: c es el calor específico o capacidad calorífica específica. m la masa de sustancia considerada.

Planteamiento formal de capacidad calorífica Sea Σ un sistema termodinámico en el estado B. Se define la capacidad calorífica Cc asociada a un proceso cuasi estático elemental c que parte de B y finaliza en el estado B' como el límite del cociente entre el calor Q absorbido por Σ y el incremento de temperatura ΔT cuando el estado B' tiente al inicial B. La capacidad calorífica es, de este modo, una variable termodinámica y está perfectamente definida en cada estado de equilibrio de Σ.

Cambio de estado de un sistema debido a Calor y Trabajo • Los cambios de estado en un sistema son producidos por interacciones con el entorno o medio a través del calor y del trabajo, que son dos distintos modos de la transferencia de energía.

Calor El calor es una forma de transferencia de energía debido a la diferencia de temperatura. El calor, al igual que el trabajo, se considera en termodinámica como energía en tránsito para separa a un sistema de su entorno. 1. La transferencia de calor puede alterar el estado del sistema; 2. Los cuerpos ``no contienen'' calor; el calor es energía en transito y se identifica mientras ésta pasa a través de los límites del sistema; 3. La cantidad de calor necesaria para ir de un estado a otro es dependiente de la trayectoria; 4. Los procesos adibáticos son aquellos en los que no se transfiere calor.

Leyes de la Termodinámica • Las leyes o principios de la termodinámica, descubiertos en el siglo XIX a través de meticulosos experimentos, que determinan la naturaleza y los límites de todos los procesos termodinámicos. • Los principios de la termodinámica tienen una importancia fundamental para todas las ramas de la ciencia y la ingeniería, y son:

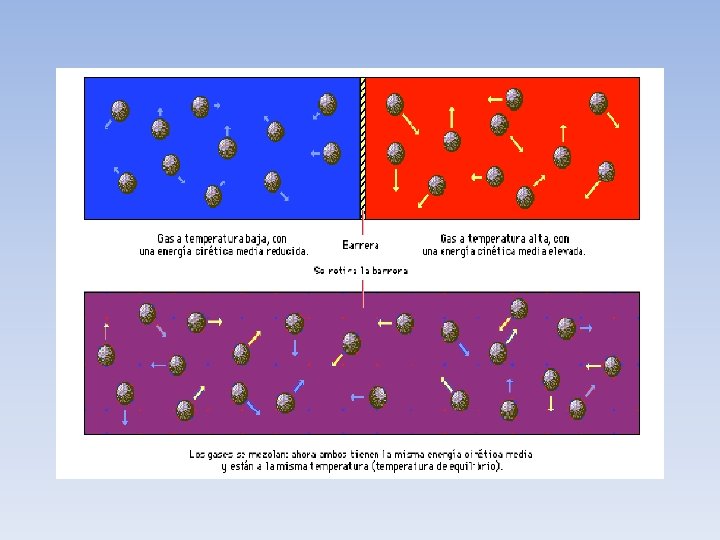
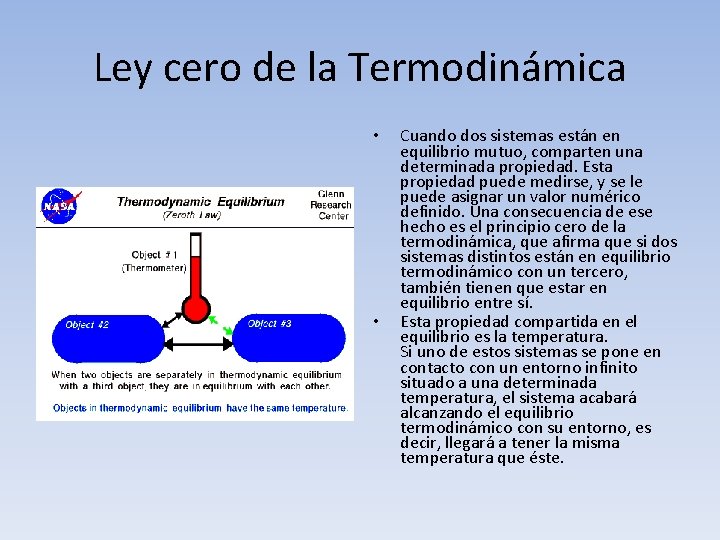
Ley cero de la Termodinámica • • Cuando dos sistemas están en equilibrio mutuo, comparten una determinada propiedad. Esta propiedad puede medirse, y se le puede asignar un valor numérico definido. Una consecuencia de ese hecho es el principio cero de la termodinámica, que afirma que si dos sistemas distintos están en equilibrio termodinámico con un tercero, también tienen que estar en equilibrio entre sí. Esta propiedad compartida en el equilibrio es la temperatura. Si uno de estos sistemas se pone en contacto con un entorno infinito situado a una determinada temperatura, el sistema acabará alcanzando el equilibrio termodinámico con su entorno, es decir, llegará a tener la misma temperatura que éste.

Primera Ley de la Termodinámica • También conocida como principio de la conservación de la energía, establece que si se realiza trabajo sobre un sistema, la energía interna del sistema variará. La diferencia entre la energía interna del sistema y la cantidad de energía es denominada calor. Fue propuesto por Antoine Lavoisier. • En otras palabras: La energía no se crea ni se destruye sólo se transforma. • La ecuación general de la conservación de la energía es la siguiente: E entra − Esale = ΔE sistema

Segunda Ley de la Termodinámica • La cantidad de entropía de cualquier sistema aislado térmicamente tiende a incrementarse con el tiempo. Más sencillamente, cuando una parte de un sistema cerrado interacciona con otra parte, la energía tiende a dividirse por igual, hasta que el sistema alcanza un equilibrio térmico. • El segundo principio impone una condición adicional a los procesos termodinámicos. No basta con que se conserve la energía y cumplan así el primer principio. Una máquina que realizara trabajo violando el segundo principio se denomina, “móvil perpetuo de segunda especie”, ya que podría obtenergía continuamente de un entorno frío para realizar trabajo en un entorno caliente sin costo alguno. A veces, el segundo principio se formula como una afirmación que descarta la existencia de un móvil perpetuo de segunda especie.

Tercera Ley de la Termodinámica • • • El tercer principio de la termodinámica afirma que el cero absoluto no puede alcanzarse por ningún procedimiento que consta de un número finito de pasos. Es posible acercarse indefinidamente al cero absoluto, pero nunca se puede llegar a él. Es importante recordar que los principios o leyes de la Termodinámica son sólo generalizaciones estadísticas, válidas siempre para los sistemas macroscópicos, pero inaplicables a nivel cuántico. Maxwell ejemplifica cómo puede concebirse un sistema cuántico que rompa las leyes de la Termodinámica. Asimismo, cabe destacar que el primer principio, el de conservación de la energía, es la más sólida y universal de las leyes de la naturaleza descubiertas hasta ahora por la ciencia.

Aplicaciones de la Termodinámica • En la construcción de edificaciones, en especial de las estructuras metálicas se tiene que tomar en cuenta sus propiedades al dilatarse o contraerse con los cambios de temperatura del ambiente. • En el estudio de los cambios de fase de las diferentes sustancias. • En la construcción de máquinas térmicas, por ejemplo: motores que funcionan combustible, refrigeradoras

Aplicación como medio de transporte para mejoras del medio ambiente a través de globo de aire. Todos sabemos que el aire caliente es más ligero que el aire frío y que este último es más pesado. Para hacernos una idea, decimos que un metro cúbico de aire pesa unos 28 gramos, si lo calentamos con un quemador a 100 grados Fahrenheit este aire pesará 7 gramos menos. Por esa razón cada pie cúbico de aire puede llevar 7 gramos. Esta cantidad no es mucho y por esa razón los globos tienen proporciones tan grandes ya que deben generar el volumen en pies necesarios para levantar el peso de la tripulación y pasajeros. Para levantar 1. 000 libras necesitaremos 65. 000 pies cúbicos de aire caliente. El globo se llena en primer lugar con aire frío y a continuación ese mismo aire se aumenta de temperatura con la ayuda de un quemador. Un globo de aire caliente utiliza la propiedad de que el aire caliente a la presión atmosférica es menos denso que el aire más frío a la misma presión. La fuerza de empuje es la diferencia entre el peso del aire caliente y el de un volumen igual al del aire más frío que lo rodea. Si el volumen del globo es 500 m 3 y el aire que lo rodea esta a 0 ºC, ¿cuál ha de ser la temperatura del aire en el globo para elevar una masa total de 200 Kg? . Maire = 28, 8 g/mol. (Rta: 396, 25 ºK)