Reaccin qumica y energa Energa interna Entalpa Capacidad












- Slides: 18

Reacción química y energía Energía interna Entalpía Capacidad calorífica

U 3 |Reacción química y energía Se denominan exotérmicas todas las reacciones químicas que tienen lugar con desprendimiento de energía en forma de calor. Se denominan endotérmicas todas las reacciones químicas que tienen lugar con absorción de energía en forma de calor. Se denominan fotoquímicas todas las reacciones que emiten o absorben energía luminosa, y en general, energía radiante.

U 3 |Energía interna Principio de conservación de la energía. Energía interna Variación de la energía interna de un sistema Trabajo de expansión o compresión a presión constante Reacciones a volumen constante. Ecuaciones termoquímicas

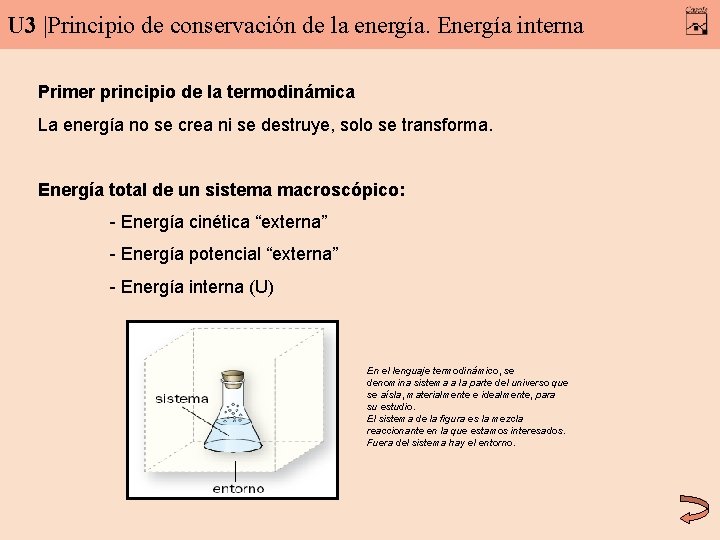
U 3 |Principio de conservación de la energía. Energía interna Primer principio de la termodinámica La energía no se crea ni se destruye, solo se transforma. Energía total de un sistema macroscópico: - Energía cinética “externa” - Energía potencial “externa” - Energía interna (U) En el lenguaje termodinámico, se denomina sistema a la parte del universo que se aísla, materialmente e idealmente, para su estudio. El sistema de la figura es la mezcla reaccionante en la que estamos interesados. Fuera del sistema hay el entorno.

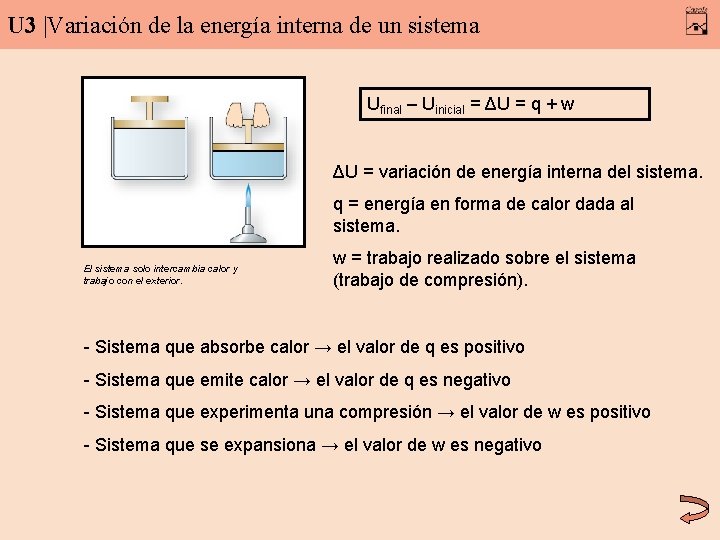
U 3 |Variación de la energía interna de un sistema Ufinal – Uinicial = ΔU = q + w ΔU = variación de energía interna del sistema. q = energía en forma de calor dada al sistema. El sistema solo intercambia calor y trabajo con el exterior. w = trabajo realizado sobre el sistema (trabajo de compresión). - Sistema que absorbe calor → el valor de q es positivo - Sistema que emite calor → el valor de q es negativo - Sistema que experimenta una compresión → el valor de w es positivo - Sistema que se expansiona → el valor de w es negativo

U 3 |Trabajo de expansión o compresión a presión constante Proceso realizado a presión constante. w = -pext. SΔx = -pextΔV Si la expansión (o la compresión) se realiza de forma que la presión exterior sea aproximadamente igual a la presión interior, p, del gas: w = -pΔV Esta transformación se denomina reversible. ΔU = q - pΔV

U 3 |Reacciones a volumen constante. Ecuaciones termoquímicas A volumen constante la energía en forma de calor ganada o perdida por el sistema reaccionante es igual a la variación de su energía interna. ΔU = qv Ecuaciones termoquímicas C(grafito) + O 2 (g) → CO 2 (g) ΔU = -393 k. J mol-1 El valor que se da a ΔU es el que corresponde a les cantidades de sustancias (número de moles) indicadas en la ecuación química. Siempre que se rompe un enlace entre dos átomos, se necesita energía y Viceversa. En la formación de un enlace, se desprende energía.

U 3 |Entalpía Reacción química efectuada a presión constante: Entalpía estándar de la reacción y de formación Ley de Hess y su aplicación Entalpías de enlace o energías de enlace Estudio energético de la formación de compuestos iónicos Los cambios de entalpía en los procesos físicos

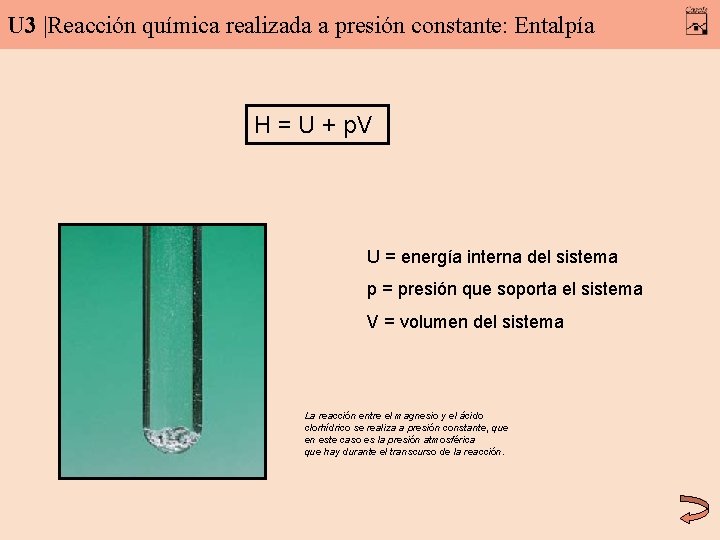
U 3 |Reacción química realizada a presión constante: Entalpía H = U + p. V U = energía interna del sistema p = presión que soporta el sistema V = volumen del sistema La reacción entre el magnesio y el ácido clorhídrico se realiza a presión constante, que en este caso es la presión atmosférica que hay durante el transcurso de la reacción.

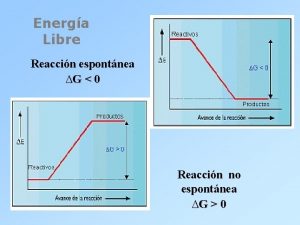
U 3 |Reacción química realizada a presión constante: Entalpía Sistema a presión constante Si una reacción se lleva a cabo a presión constante, la energía en forma de calor desprendida o absorbida, es igual a la variación de su entalpía. ΔH = qp Si ΔH es positiva, la reacción es endotérmica. Si ΔH es negativa, la reacción es exotérmica. La reacción de descomposición del óxido de mercurio (II) en mercurio y oxígeno es endotérmica. ΔH es positiva. El sistema gana energía. La reacción entre el hierro y el ácido sulfúrico es exotérmica. La variación de entalpía, ΔH, es negativa. El sistema pierde energía.

U 3 |Entalpía estándar de la reacción y de formación Entalpía estándar de la reacción Denominada también calor normal de reacción. Se representa por ΔH 0 r, y es la variación de entalpía de una reacción efectuada a presión constante cuando los reactivos se convierten en productos y en la que tanto unos como otros se encuentran en estado estándar. Entalpía estándar de formación Llamada también calor de formación. Se representa por ΔH 0 f, y es la variación de entalpía que acompaña a la formación de un mol de un compuesto a partir de sus elementos a presión constante, estando los elementos y compuestos en estado estándar.

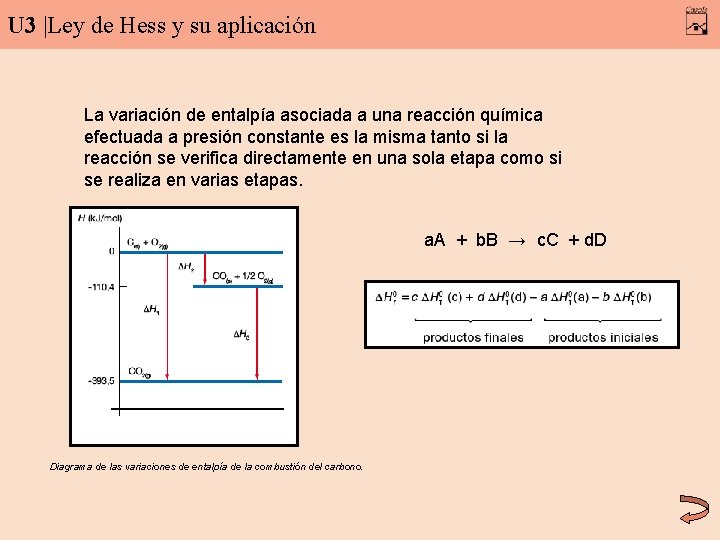
U 3 |Ley de Hess y su aplicación La variación de entalpía asociada a una reacción química efectuada a presión constante es la misma tanto si la reacción se verifica directamente en una sola etapa como si se realiza en varias etapas. a. A + b. B → c. C + d. D Diagrama de las variaciones de entalpía de la combustión del carbono.

U 3 |Entalpías de enlace o energías de enlace Se define como entalpía de enlace (llamada también correctamente energía de enlace) la variación de entalpía, en condiciones estándar y 25ºC, que acompaña a la reacción de formación de un mol de enlaces a partir de los átomos aislados en estado gaseoso. La entalpía de enlace es mayor cuanto más pequeña es la longitud de enlace.

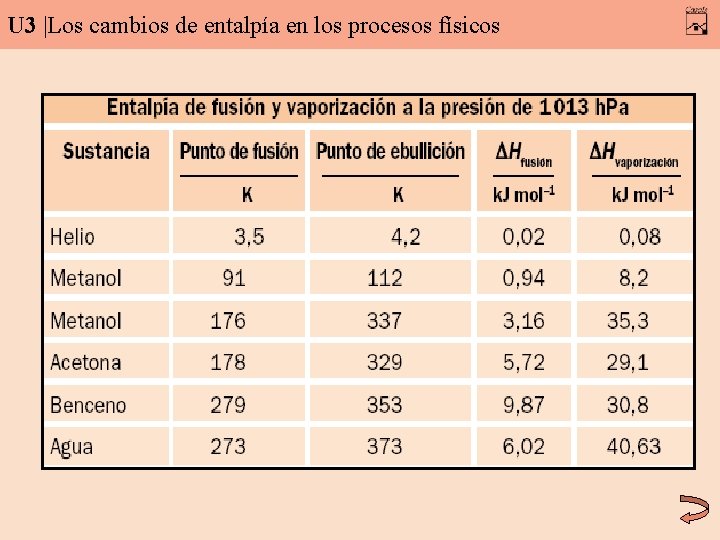
U 3 |Los cambios de entalpía en los procesos físicos Entalpía de vaporización: diferencia entre la entalpía de un mol de vapor y la de un mol de líquido a igual temperatura. ΔHvaporización = Hvapor – Hlíquido Entalpía de condensación: ΔHvaporización = - ΔHcondensación Entalpía de fusión: diferencia entre la entalpía de un mol de líquido y la de un mol de sólido. ΔHfusión = Hlíquido – Hsólido Entalpía de solidificación: ΔHfusión = - ΔHsolidificación

U 3 |Los cambios de entalpía en los procesos físicos

U 3 |Capacidad calorífica específica Capacidad calorífica molar

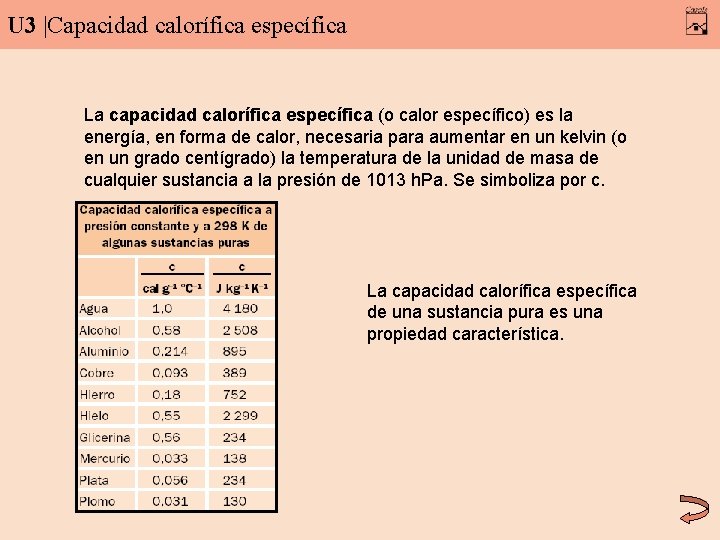
U 3 |Capacidad calorífica específica La capacidad calorífica específica (o calor específico) es la energía, en forma de calor, necesaria para aumentar en un kelvin (o en un grado centígrado) la temperatura de la unidad de masa de cualquier sustancia a la presión de 1013 h. Pa. Se simboliza por c. La capacidad calorífica específica de una sustancia pura es una propiedad característica.

U 3 |Capacidad calorífica molar La capacidad calorífica molar, que se simboliza por cm, es la energía, en forma de calor, necesaria para aumentar en un kelvin (o en un grado centígrado) la temperatura de un mol de cualquier sustancia a la presión normal. En el SI, se expresa en J mol-1 K-1. En general, la capacidad calorífica molar de una sustancia determinada varía ligeramente con la temperatura; pero si no se indica lo contrario, se puede suponer constante en intervalos limitados de temperatura.