SEMANA No 7 AGUA Y SOLUCIONES I Agua



























- Slides: 36

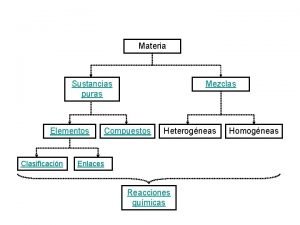
SEMANA No. 7 AGUA Y SOLUCIONES

I. Agua El agua es el compuesto químico más abundante en nuestro planeta.

El agua presenta los tres estados de agregación de la materia: líquido, sólido y gaseoso. Pura es inodora, incolora e insípida. Cualquier cambio en éstas propiedades se debe a las impurezas que están disueltas en ella.

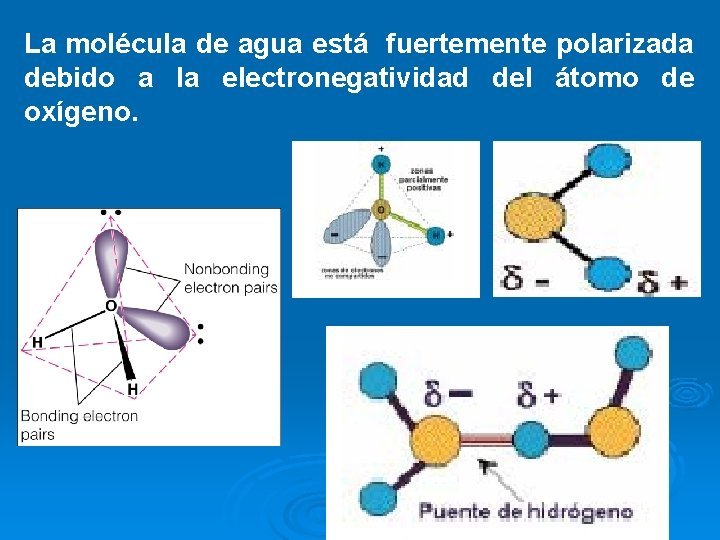
La molécula de agua está fuertemente polarizada debido a la electronegatividad del átomo de oxígeno.

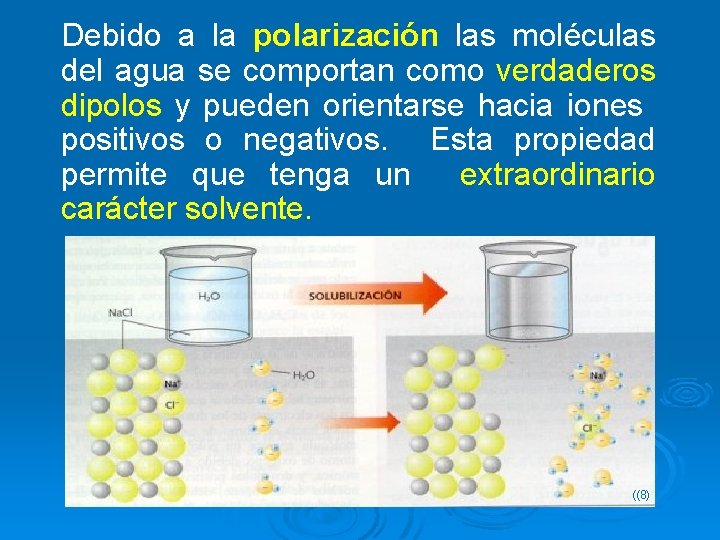
Debido a la polarización las moléculas del agua se comportan como verdaderos dipolos y pueden orientarse hacia iones positivos o negativos. Esta propiedad permite que tenga un extraordinario carácter solvente. ((8)

El agua es un constituyente importante de nuestro organismo y a la vez el medio en que viven muchos animales y plantas, la vida es imposible sin agua. La función principal del agua es servir como disolvente de las sustancias inorgánicas y orgánicas por lo tanto actúa como medio de transporte de célula a célula y dentro de las mismas.

El agua se considera solvente universal por: • Su abundancia en nuestro planeta. • Se encuentra disponible en todo ambiente y es barato. • Es compatible con los tejidos corporales por lo tanto es útil para administrar medicamentos.

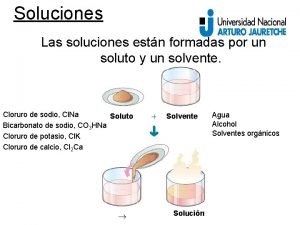
II. SOLUCIONES (6) Solución: mezcla homogénea de dos o más sustancias. Éstas sustancias pueden ser: átomos, moléculas, iones ó mixtas.

Características: • Forman una sola fase. • Cuando son líquidas o gaseosas, son transparentes dejando pasar la luz. • Las partículas disueltas miden de: 0. 1 -1 nm

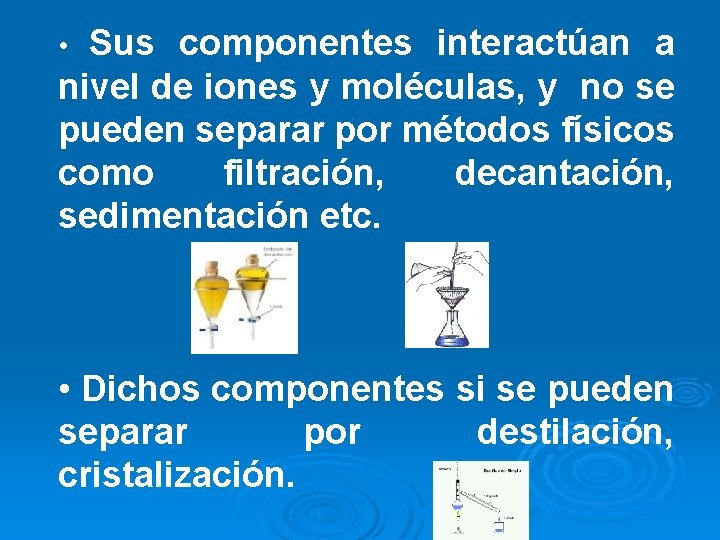
Sus componentes interactúan a nivel de iones y moléculas, y no se pueden separar por métodos físicos como filtración, decantación, sedimentación etc. • • Dichos componentes si se pueden separar por destilación, cristalización.

PARTES DE UNA SOLUCIÓN: SOLUTO Y SOLVENTE (9) SOLUTO: Es el menor componente de una solución, el cual se encuentra disuelto por el disolvente. DISOLVENTE O SOLVENTE: Es el mayor componente de una solución, el componente cuyo estado físico se conserva.


(Del latín disolutio) mezcla de una sustancia en otra. Disolución: Proceso de disolución: proceso mediante el cuál el soluto se distribuye en el solvente de forma homogénea

Solvatación: proceso por el cuál el solvente rodea a las partículas de soluto y las integra en la mezcla. Si el solvente es el agua, al proceso se le llama HIDRATACIÓN.

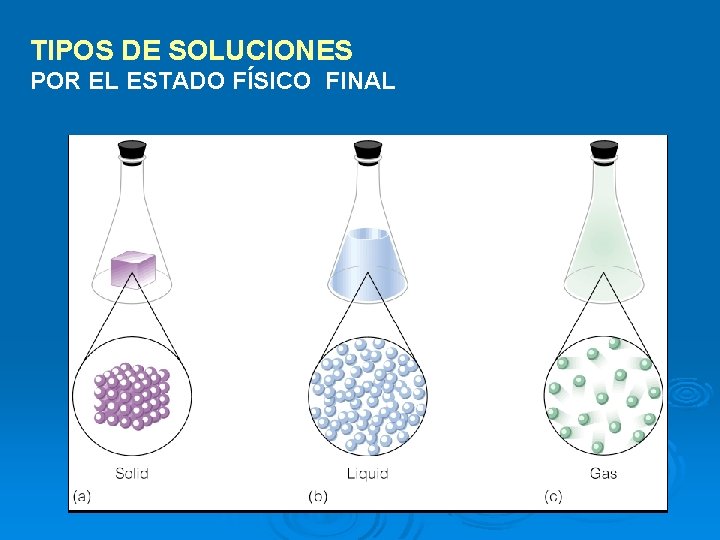
TIPOS DE SOLUCIONES POR EL ESTADO FÍSICO FINAL

a. Solución gaseosa gas-gas (aire) (7) b. Solución líquida gas-líquido (agua mineral)

líquido-líquido (alcohol 70%) sólido-líquido (solución fisiológica)

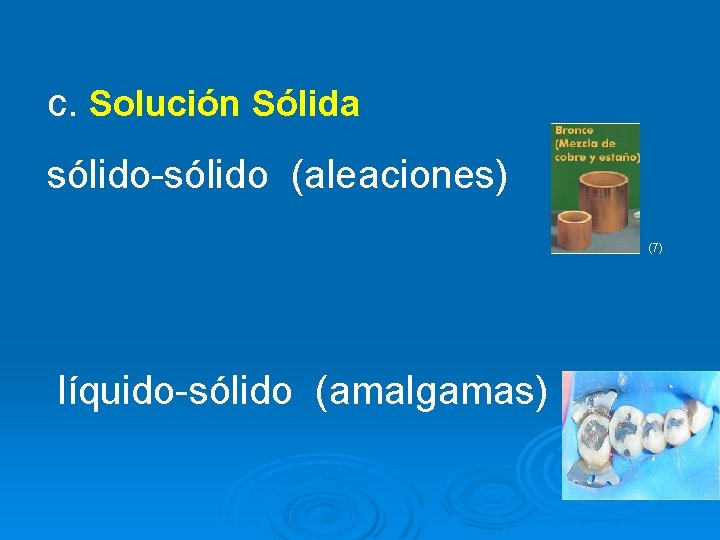
c. Solución Sólida sólido-sólido (aleaciones) (7) líquido-sólido (amalgamas)

Acero (Carbono en hierro)

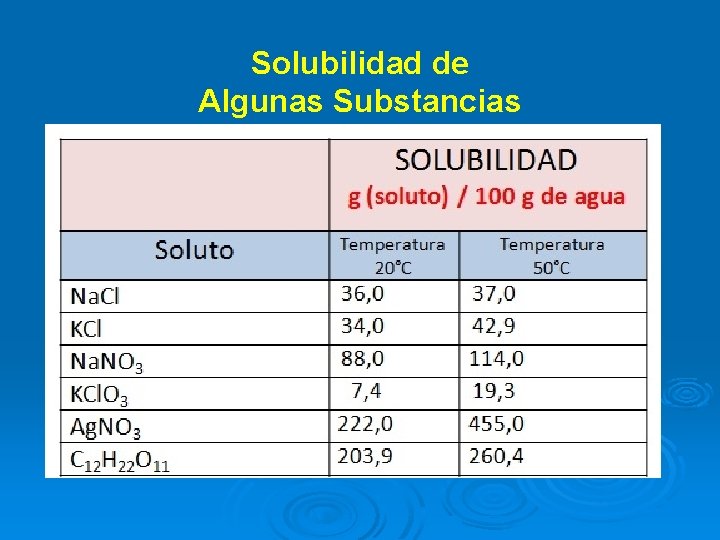
Solubilidad de una sustancia es una medida de cuánto soluto se disuelve en una cantidad determinada de disolvente a una temperatura específica.

Solubilidad de Algunas Substancias

Factores que afectan la solubilidad: 1 -Naturaleza de suscomponentes 2 -Presión 3 -Temperatura 4 -Área superficial (tamaño departícula)

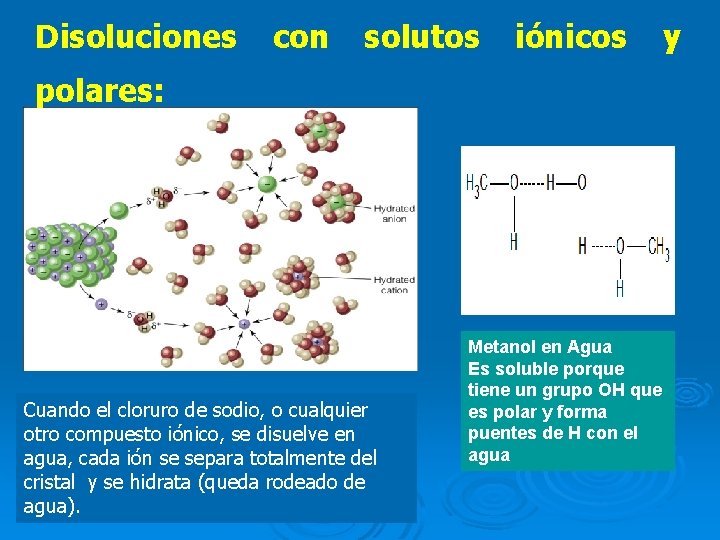
1 -Naturaleza de los componentes: “ Compuestos Iónicos o Covalentes. “ “Lo similar disuelve a lo similar. “ Los solutos no polares o muy poco polares se disuelven mejor en disolventes no polares, y los solutos muy polares se disuelven mejor en disolventes polares como el agua.

Disoluciones con solutos iónicos polares: Cuando el cloruro de sodio, o cualquier otro compuesto iónico, se disuelve en agua, cada ión se separa totalmente del cristal y se hidrata (queda rodeado de agua). Metanol en Agua Es soluble porque tiene un grupo OH que es polar y forma puentes de H con el agua y

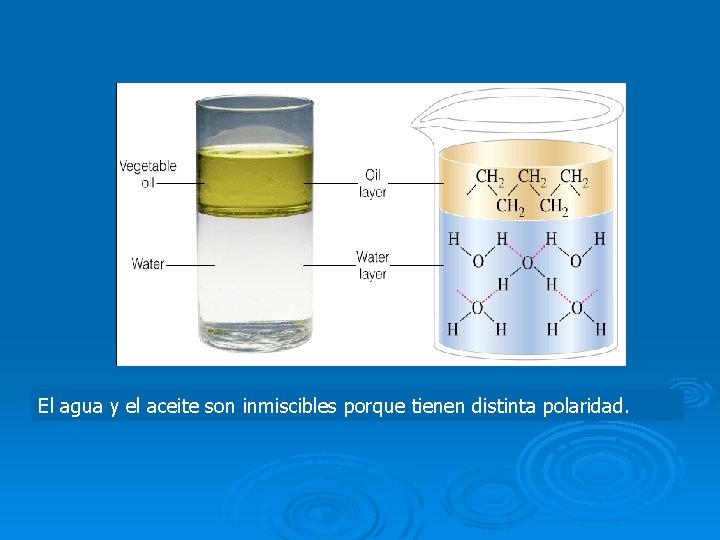
El agua y el aceite son inmiscibles porque tienen distinta polaridad.

2 -Presión: Se aplica solamente para los gases. A presiones mayores, se disuelve más gas en una cantidad de agua determinada. Ley de Henry: “La solubildad de un gas en un líquido es directamente proporcional a la presión del gas sobre el líquido” 3 -Temperatura: A medida que la temperatura aumenta, el movimiento de partículas también se intensifica, aumenta el número de partículas que se desprenden. La solubilidad de sólidos es mayor conforme la temperatura aumenta.

El soluto se disuelve porque el solvente rompe las uniones entre sus moléculas. Al aumentar la temperatura, se está ayudando al solvente en la ruptura de los enlaces. Por lo general a temperaturas altas las soluciones tendrán mas soluto disuelto y algunas muestran poco cambio en la solubilidad y otras son menos solubles.

La solubilidad de un gas en agua disminuye al aumentar la temperatura, debido a que las moléculas de gas tienen energía para escapar de la solución. 4. Área Superficial o tamaño de partícula: Cuanto mas pequeñas sean las partículas de soluto, mas contacto hay entre el soluto y el disolvente, por lo tanto: “entre mas pequeñas sean las partículas del soluto antes se disolverán”.

FORMAS DE EXPRESAR LA CONCENTRACION DE LAS SOLUCIONES: UNIDADES RELATIVAS: Insaturada o no saturada: Cuando una solución contiene menos soluto que el límite de solubilidad. Saturada: Cuando una solución a una temperatura determinada existe en equilibrio dinámico con el soluto sin disolver.

Sobresaturada: Cuando una solución posee exceso de soluto respecto a la cantidad que podría contener si estuviese en equilibrio. (9) (10) (12)

Concentrada: Una solución concentrada es aquella que contiene una cantidad relativamente grande de soluto.

Diluida: Una solución diluida contiene una cantidad relativamente pequeña de soluto.

IMPORTANCIA BIOLÓGICA DE LAS SOLUCIONES: Nuestro organismo es un entorno acuoso (líquido cefalorraquídeo) • Se nos administran soluciones como medicamentos: inyecciones intravenosas, parenterales masivas, jarabes…. . • Respiramos aire.

DENSIDAD Relación entre la masa de un objeto y el volumen del mismo. Densidad de sólidos y líquidos: D = m / v = g/cc (m. L) Densidad de gases: D= g/L Ejercicios.

Lectura del documento del Agua.

BIBLIOGRAFÍA 1. Timberlake, Karen C. Química. 10º- Ed. Pearson, España 2011. 2. Timberlake Karen C. QUIMICA GENERAL, ORGÁNICA Y BIOLÓGICA. ESTRUCTURAS DE LA VIDA. 4ª Edición, Editorial Pearson, México 2013. http: //www. slideshare. net/perdomomariela/presentacion-formulaciones-31276486 http: //cidta. usal. es/cursos/agua/modulos/conceptos/uni_02/u 1 c 2 s 4. htm#Anchor 3 1. http: //cidta. usal. es/cursos/agua/modulos/conceptos/uni_02/u 1 c 2 s 4. htm#Anchor 3 2. http: //www. prevor. com/ES/autres/fb/lecon_chimie/ESP_lecon_chimie 2. php 3. http: //maucarmarvir 452. blogspot. com/2013/02/ejemplos-de-soluto-y-solvente-en-una. html 4. http: //biblioteca 19 de 9. blogspot. com/2010/04/soluto-y-solvente-que-pareja. html 5. http: //ocw. uc 3 m. es/ciencia-e-oin/quimica-de-los-materiales/Material-de-clase/tema-5. -cinetica-quimica. termodinamica-y-equilibrio-iv 6. http: //www. sined. mx/sined/content/aprendiendo/81/ 7. http: //mariarmcience. wordpress. com/la-diversidad-de-la-materia/ 8. http: //www. um. es/molecula/sales 02. htm 9. vanchoander. blogspot. com 10. http: //www. educarchile. cl/ech/pro/app/detalle? id=216927 11. http: //corinto. pucp. edu. pe/quimicageneral/contenido/62 -tipos-de-soluciones-y-solubilidad 12. http: //mezclas-solucionesii. blogspot. com/2011/11/clases-de-soluciones. html 13. http: //dfbgquimica. webcindario. com/materia. html 12.
 Ejemplo de suspensiones
Ejemplo de suspensiones Ampolla tensa
Ampolla tensa Solucion polarizante
Solucion polarizante Proteina transportadora
Proteina transportadora Soluciones quimicas
Soluciones quimicas Solucion
Solucion Propiedades de las soluciones
Propiedades de las soluciones Mezclas y sustancias
Mezclas y sustancias Esencia del conocimiento objetivismo
Esencia del conocimiento objetivismo Concentración de una disolución fórmula
Concentración de una disolución fórmula Suspensiones
Suspensiones Formula concentracion final
Formula concentracion final Solucion
Solucion Soluciones iv
Soluciones iv Edo
Edo Propiedades de las soluciones amortiguadoras
Propiedades de las soluciones amortiguadoras Novarum soluciones
Novarum soluciones Formula de propiedades coligativas
Formula de propiedades coligativas No puedo darte soluciones para todos los problemas
No puedo darte soluciones para todos los problemas Propiedades coligativas de soluciones electroliticas
Propiedades coligativas de soluciones electroliticas Alquimia soluciones ambientales
Alquimia soluciones ambientales No puedo darte soluciones para todos los problemas
No puedo darte soluciones para todos los problemas Como hacer una dilucion
Como hacer una dilucion Actividades de oraciones impersonales
Actividades de oraciones impersonales Poemas de jorge luis borges
Poemas de jorge luis borges Soluciones gaseosas
Soluciones gaseosas 10 coloides
10 coloides Tabla de ácidos y bases fuertes y débiles
Tabla de ácidos y bases fuertes y débiles Molalidad
Molalidad Pares minimos ejercicios
Pares minimos ejercicios Soluciones sirh
Soluciones sirh Soluciones quimicas
Soluciones quimicas Soluciones de cable instalaciones frigorificas
Soluciones de cable instalaciones frigorificas Noradrenalina dosis infusion
Noradrenalina dosis infusion Soluciones hipertonicas
Soluciones hipertonicas Características de las soluciones químicas
Características de las soluciones químicas Peso equivalente
Peso equivalente