Soluciones Las soluciones estn formadas por un soluto













- Slides: 30

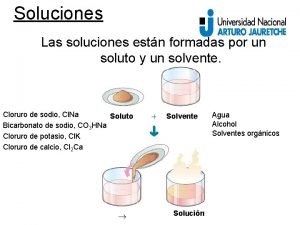
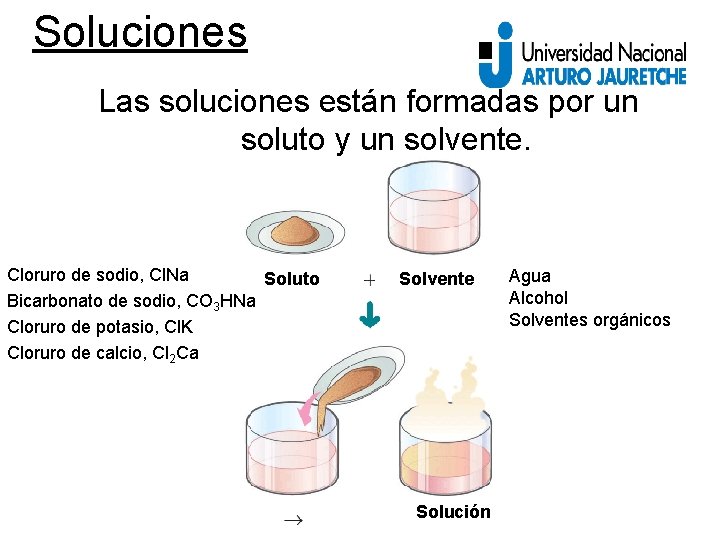
Soluciones Las soluciones están formadas por un soluto y un solvente. Cloruro de sodio, Cl. Na Soluto Bicarbonato de sodio, CO 3 HNa Cloruro de potasio, Cl. K Cloruro de calcio, Cl 2 Ca Solvente Solución Agua Alcohol Solventes orgánicos

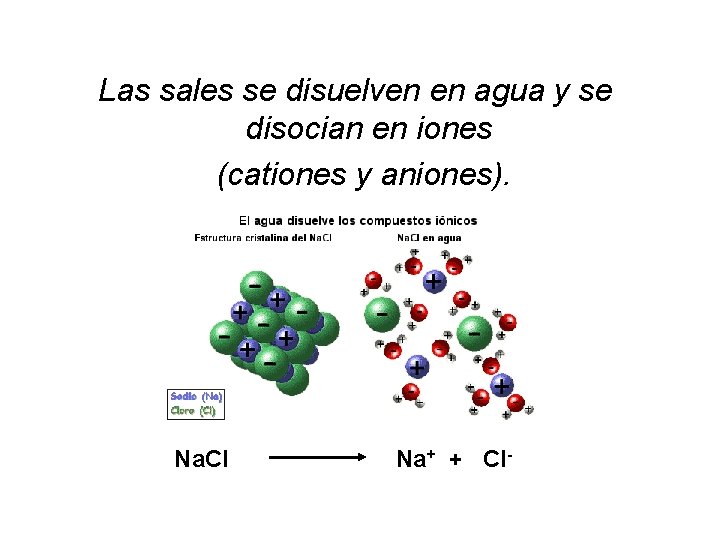
Las sales se disuelven en agua y se disocian en iones (cationes y aniones). Na. Cl Na+ + Cl-

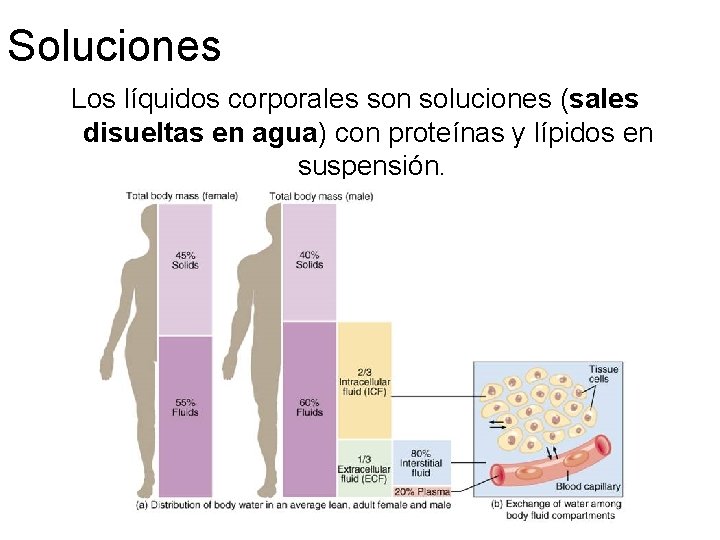
Soluciones Los líquidos corporales son soluciones (sales disueltas en agua) con proteínas y lípidos en suspensión.

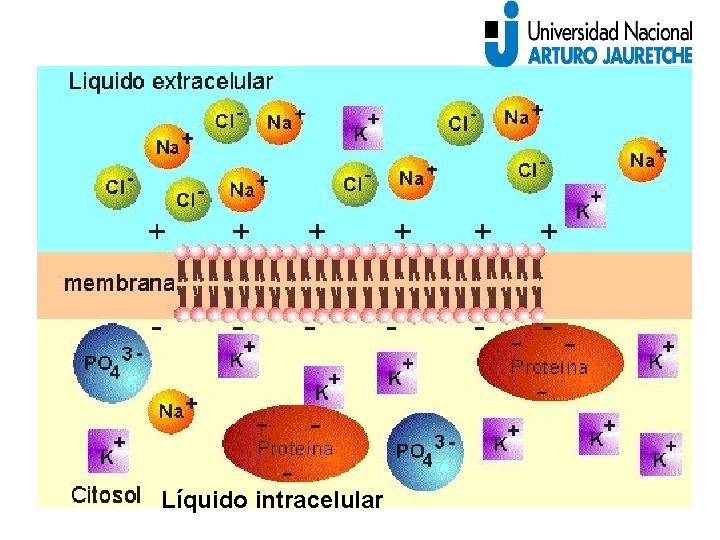
Líquido intracelular

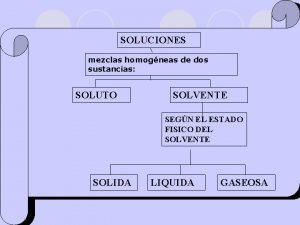
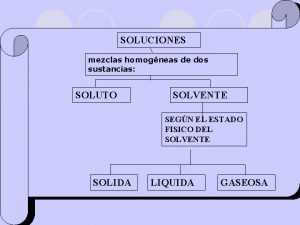
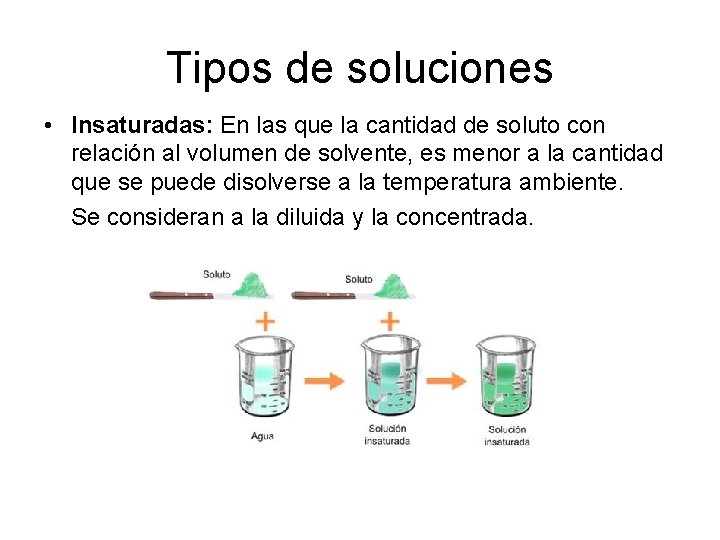
Tipos de soluciones • Insaturadas: En las que la cantidad de soluto con relación al volumen de solvente, es menor a la cantidad que se puede disolverse a la temperatura ambiente. Se consideran a la diluida y la concentrada.

Tipos de soluciones • Saturadas: Son las que el soluto ha logrado ocupar todos los espacios intermoleculares del solvente y no se puede diluir mas del mismo, o sea la cantidad máxima que se puede disolver a la temperatura ambiente.

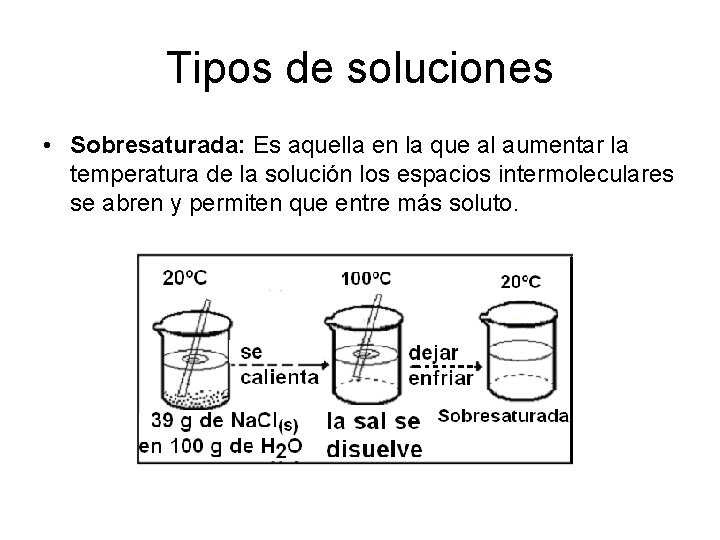
Tipos de soluciones • Sobresaturada: Es aquella en la que al aumentar la temperatura de la solución los espacios intermoleculares se abren y permiten que entre más soluto.

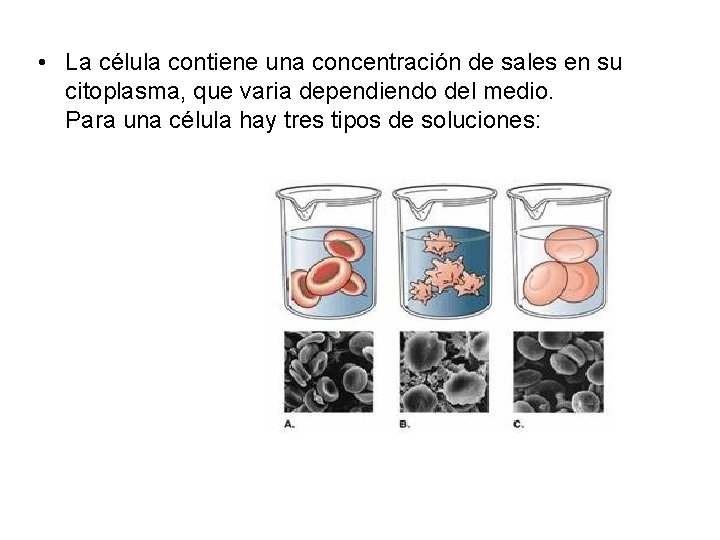
• La célula contiene una concentración de sales en su citoplasma, que varia dependiendo del medio. Para una célula hay tres tipos de soluciones:

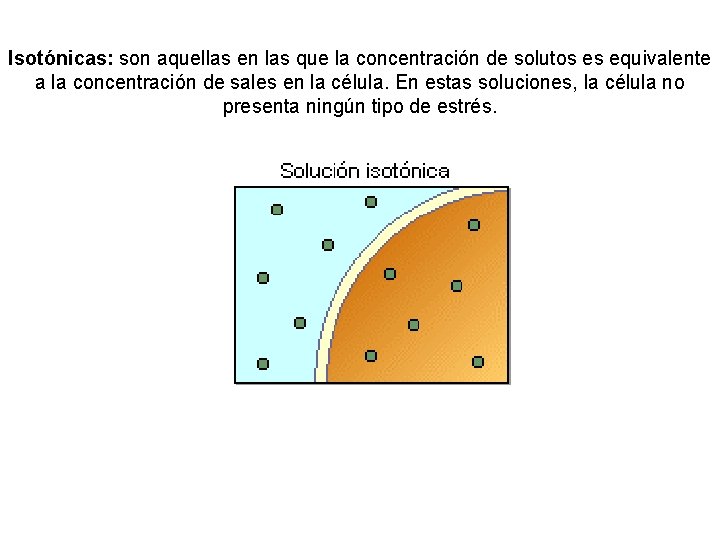
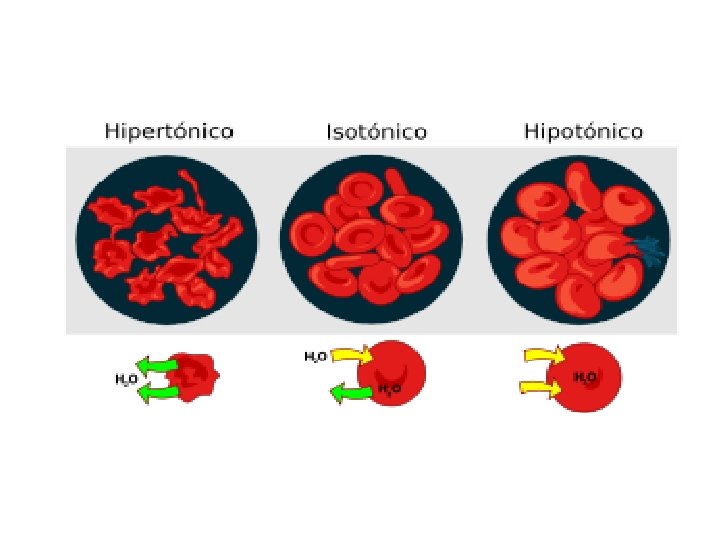
Isotónicas: son aquellas en las que la concentración de solutos es equivalente a la concentración de sales en la célula. En estas soluciones, la célula no presenta ningún tipo de estrés.

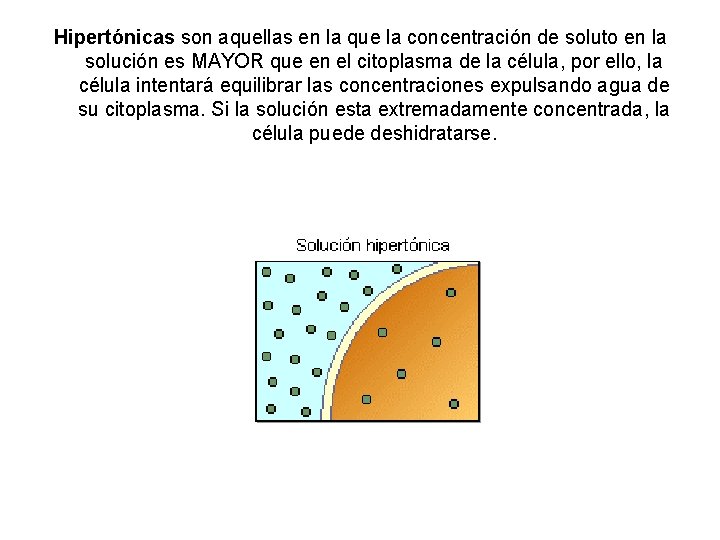
Hipertónicas son aquellas en la que la concentración de soluto en la solución es MAYOR que en el citoplasma de la célula, por ello, la célula intentará equilibrar las concentraciones expulsando agua de su citoplasma. Si la solución esta extremadamente concentrada, la célula puede deshidratarse.

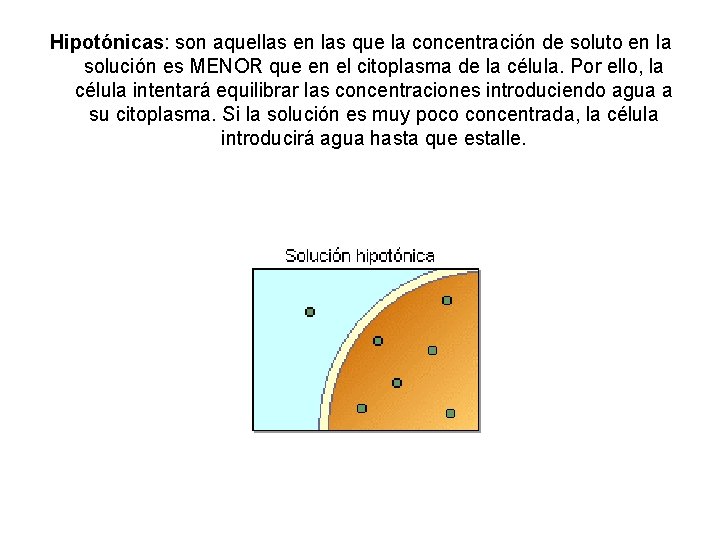
Hipotónicas: son aquellas en las que la concentración de soluto en la solución es MENOR que en el citoplasma de la célula. Por ello, la célula intentará equilibrar las concentraciones introduciendo agua a su citoplasma. Si la solución es muy poco concentrada, la célula introducirá agua hasta que estalle.


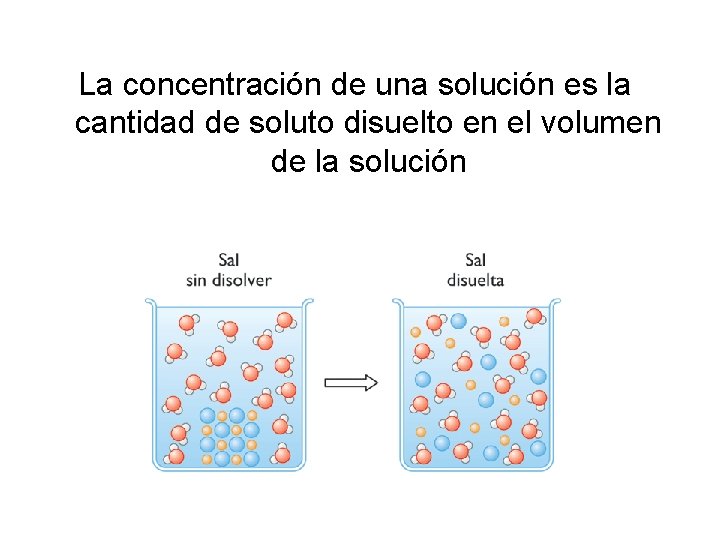
La concentración de una solución es la cantidad de soluto disuelto en el volumen de la solución

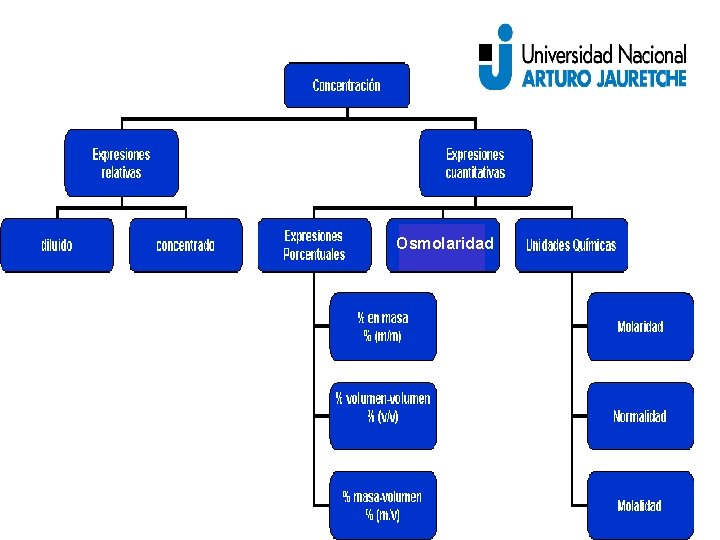
Osmolaridad

Expresiones relativas

Expresiones cuantitativas Expresiones Porcentuales % en masa % en volumen % masa/volumen


Expresiones cuantitativas Unidades químicas Molaridad Molalidad Normalidad

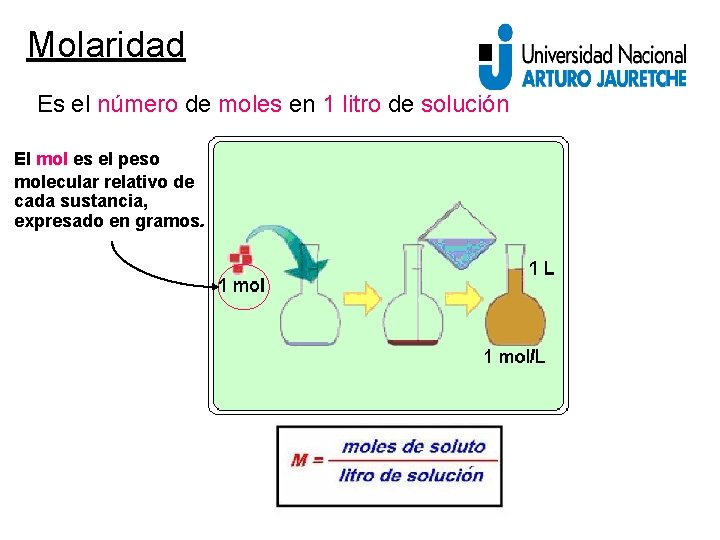
Molaridad Es el número de moles en 1 litro de solución El mol es el peso molecular relativo de cada sustancia, expresado en gramos.

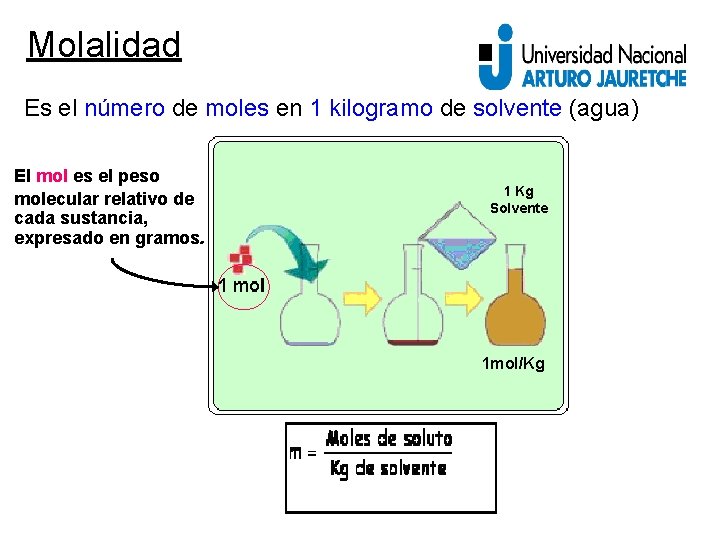
Molalidad Es el número de moles en 1 kilogramo de solvente (agua) El mol es el peso molecular relativo de cada sustancia, expresado en gramos. 1 Kg Solvente 1 mol/Kg

Molaridad - molalidad Ø 1 mol = 1000 mmoles Ø Las soluciones en fisiología suelen expresarse en mmoles /l y recibe el nombre de molaridad Ø Si se expresan en mmoles/kg de agua plasmática se habla entonces de molalidad molaridad 1 no es igual a molalidad 1

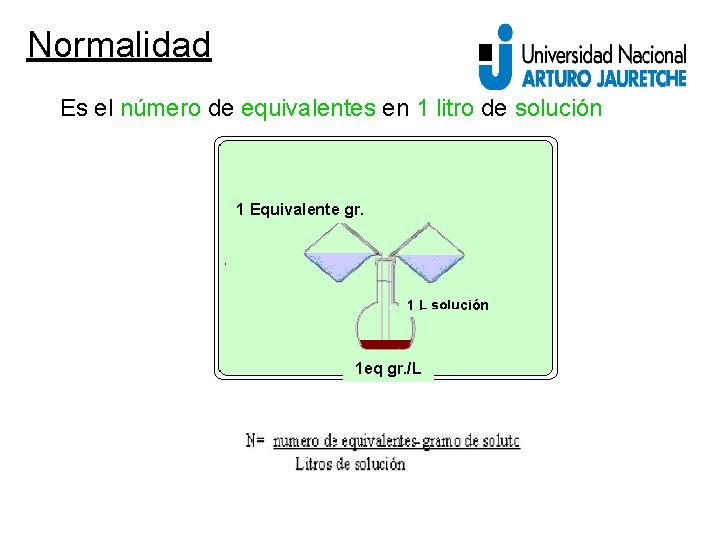
Normalidad Es el número de equivalentes en 1 litro de solución 1 Equivalente gr. 1 L solución 1 eq gr. /L

Normalidad El equivalente gramo será el peso molecular dividido por un número n que dependerá del tipo de reacción de que se trate: Ácido Base Sal

Composición de los compartimientos corporales expresados en meq/L 1 equivalente (Eq) = 1000 miliequivalentes (m. Eq).

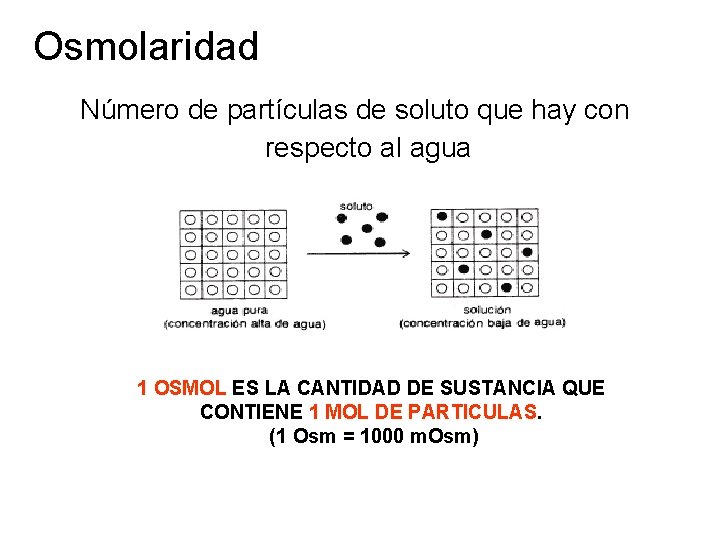
Osmolaridad Número de partículas de soluto que hay con respecto al agua 1 OSMOL ES LA CANTIDAD DE SUSTANCIA QUE CONTl. ENE 1 MOL DE PARTICULAS. (1 Osm = 1000 m. Osm)

Osmolaridad -Osmolalidad • Osmolaridad y osmolalidad son dos términos que se usan para expresar la concentración de solutos totales u OSMOLES de una solución. • En la OSMOLARIDAD, la concentración queda expresada como: Osmolaridad = osmoles por litro de solución Su unidad, en medicina: • miliosmoles por litro de solución (m. Osm/L) • En la OSMOLALIDAD, la concentración queda expresada como: Osmolalidad = osmoles por kilogramo de agua Su unidad, en medicina: • miliosmoles por kilogramo de agua (m. Osm/kg)



Lee con atención el prospecto ¿Qué significa 4%? Podrías expresar toda la “ fórmula” de manera porcentual? IBUPIRAC SUSPENSIÓN 4% Venta bajo receta Industria Argentina Fórmula Cada 100 ml de Suspensión contiene: IBUPROFENO 4, 00 g Ciclamato de sodio 1, 50 g Acido tartárico 1, 00 g Carboximetilcelulosa sódica 1, 25 g Povidona 3, 00 g Glicerina 20, 00 g Metilparabeno 180, 00 mg Propilparabeno 20, 00 mg Punzó 4 R 2, 00 mg Esencia de frutilla 600, 00 mg Agua desmineralizada c. s. p. 100, 00 ml Acción Terpéutica Agente antiinflamatorio no esteroide (AINE) con propiedades analgésicas y

Una persona ha bebido 400 ml de pisco, bebida cuya graduación alcohólica es de 30° (30 gr alcohol / 100 ml) de licor. Sabiendo que el 15% del alcohol ingerido pasa al torrente sanguíneo; que el volumen de sangre de un adulto es de 5 litros y que la concentración considerada tóxica es de 0, 003 gr de alcohol/ ml de sangre, indicar si dicha persona está intoxicada.
 Palabras unimembres
Palabras unimembres Seres humanos somos vertebrados
Seres humanos somos vertebrados Como estan formadas las proteinas simples u holoproteinas
Como estan formadas las proteinas simples u holoproteinas Estn.io
Estn.io Hola nios
Hola nios Hola
Hola Estnla
Estnla Proteinas como estan formadas
Proteinas como estan formadas Rochas formadas pelo resfriamento do magma
Rochas formadas pelo resfriamento do magma Intemperismo
Intemperismo Formulas bien formadas
Formulas bien formadas De que são formadas as rochas
De que são formadas as rochas Extensão semântica exercicios
Extensão semântica exercicios Sufijo ptero ejemplos
Sufijo ptero ejemplos Masa/ volumen
Masa/ volumen Amalgama dental soluto y disolvente
Amalgama dental soluto y disolvente Solucion
Solucion Karen diana bustamante
Karen diana bustamante Humo soluto y solvente
Humo soluto y solvente Ppm unidades
Ppm unidades Agua de vidrio
Agua de vidrio Sistemas materiales
Sistemas materiales Noradrenalina dosis infusion
Noradrenalina dosis infusion Las personas valen por lo que son y no por lo que tienen
Las personas valen por lo que son y no por lo que tienen Solucion
Solucion Propiedades coligativas
Propiedades coligativas Perdidas insensibles con ventilacion mecanica
Perdidas insensibles con ventilacion mecanica Soluciones amortiguadoras
Soluciones amortiguadoras Propiedades de las soluciones
Propiedades de las soluciones Propiedades coligativas objetivos
Propiedades coligativas objetivos Las ovejas blancas comen más que las ovejas negras
Las ovejas blancas comen más que las ovejas negras