SEMANA 8 CONCENTRACIN DE SOLUCIONES PARTE I QUMICA
























- Slides: 26

SEMANA 8 CONCENTRACIÓN DE SOLUCIONES PARTE I QUÍMICA 2017 1

Semana 8 CONCENTRACIÓN DE SOLUCIONES I • Concentración de Soluciones • Definición: Diluido y Concentrado, Insaturado, Saturado y Sobresaturado • Porcentaje m/m, v/v, m/v • Diluciones en %m/v y %v/v • Partes por millón (ppm) • • • Aplicación del %m/v en soluciones parenterales. Q. en la Salud “Gota y Cálculos Renales” Video de Género: Discriminación https: //www. youtube. com/watch? v=w. Kb. Vv. YHi 5 DM https: //www. youtube. com/watch? v=NR 7 b. Xg. XNuv. E Laboratorio: Preparación de soluciones.

CONCENTRACIÓN DE LAS SOLUCIONES (definición) • Se refiere a la cantidad de SOLUTO que se encuentra disuelto en una cantidad específica de SOLUCIÓN. • La SOLUCIÓN está formada por la suma del SOLUTO + SOLVENTE 3

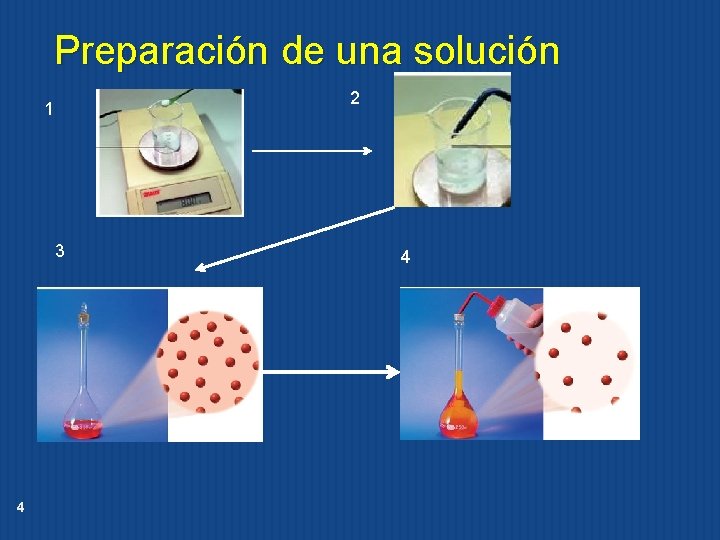
Preparación de una solución 2 1 3 4 4

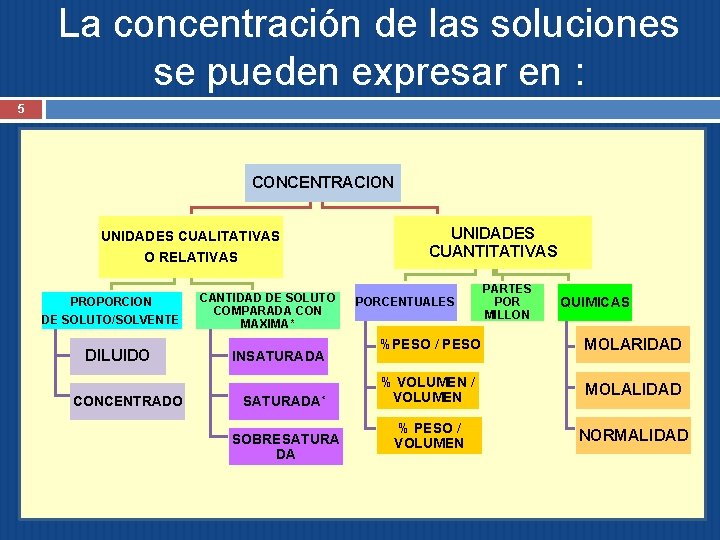
La concentración de las soluciones se pueden expresar en : 5 CONCENTRACION UNIDADES CUALITATIVAS O RELATIVAS PROPORCION DE SOLUTO/SOLVENTE DILUIDO CONCENTRADO CANTIDAD DE SOLUTO COMPARADA CON MAXIMA* INSATURADA* SOBRESATURA DA UNIDADES CUANTITATIVAS PORCENTUALES PARTES POR MILLON QUIMICAS %PESO / PESO MOLARIDAD % VOLUMEN / VOLUMEN MOLALIDAD % PESO / VOLUMEN NORMALIDAD

FORMULAS PARA CÁLCULOS DE CONCENTRACIÓN § % p/p = masa (gr)de soluto x 100 masa (gr) de solución § % v/v = m. L de soluto x 100 m. L de solución § % p/v = g de soluto x 100 m. L de solución § CINICIAL x VINICIAL = CFINAL x VFINAL 6

Cálculo de la Concentración de las soluciones en Porcentaje (%) % en peso ó masa = %p/p ó %m/m (si no se indica el tipo de %, se asume que es p/p) % p/p = masa (gr)de soluto x 100 masa (gr) de solución %p/p = masa (gr)de soluto x 100 (masa (gr) de soluto + masa (gr) de solvente)* * cuando nos dan por separado la cantidad de soluto y la de solvente, se deben de sumar para obtener la masa de la solución 7

Ejercicio de % en peso (o masa) 1. ¿Cuál es la concentración en % p/p (o m/m) de una solución que se preparó disolvientdo 8. 00 g de KCl (soluto) en 42. 00 g de agua (solvente)? % m/m © 2013 Pearson Education, Inc. Chapter 8 Section 3 8

2. Calcule el % p/p de una solución que contiene 65 g de glucosa disueltos en 185 gramos de agua: (como se da por separado el peso del soluto y solvente, deben sumarse para obtener el peso de la solución) R: 26. 0 % p/p ó 26. 0 % m/m 3. ¿Cuál es el % p/p de 15. 0 g de Na 2 CO 3 disueltos en 235 g de H 2 O? © 2013 Pearson Education, Inc. Chapter 8 Section 3 9

4. Calcule el % p/p de una solución que se preparó disolviendo 120 gr de cloruro de calcio (Ca. Cl 2) en agua hasta obtener 960 g de solución. (La solución ya incluye la masa del soluto y el solvente. No se necesita sumar). % p/p = 120 g x 100 = 12. 5 % p/p 960 g © 2013 Pearson Education, Inc. Chapter 8 Section 3 10

5. ¿Cuántos gramos de una solución 4. 2 % p/p de urea, contienen 55 gramos de urea ? % p/p = g soluto x 100 g solución = g soluto x 100= 1, 308. 53 g % p/p 11

% volumen/volumen (%v/v) Se utiliza para solutos y solventes líquidos. % v/v = m. L de soluto x 100 m. L de solución 1. Se preparó una solución disolviendo 750 m. L de alcohol isopropílico en agua hasta obtener 1350 m. L de solución. Calcule el % v/v = 750 m. L x 100 = 55. 55 % v/v 1350 m. L 12 © 2013 Pearson Education, Inc. Chapter 8 Section 3 12

2. Un enjuague bucal contiene 22. 5 % v/v de alcohol. ¿Cuántos m. L de alcohol hay en un frasco de 250 m. L de este enjuague? % v/v = m. L de soluto x 100 m. L de solución m. L de alcohol = 22. 5 m. L de alcohol x 250 m. Lde enjuague 100 m. L de enjuague = 56. 25 m. L de alcohol. © 2013 Pearson Education, Inc. Chapter 8 Section 3 13

3. ¿Cuántos m. L de una solución de aceite al 7. 8 % v/v se pueden prepararse con 50 m. L de aceite puro? % v/v = m. L de soluto x 100 m. L de solución despejar m. L de solución = m. L de soluto x 100 % v/v = 50 m. L de aceite x 100 = 641. 03 m. L 7. 8 % v/v 14 © 2013 Pearson Education, Inc. Chapter 8 Section 3 14

% en peso/volumen (% p/v) ó lo que es igual % masa/volumen (% m/v) Es la más común porque la mayoría de solutos son sólidos disueltos en agua. Por ejemplo las soluciones fisiológicas más comunes: Solución de dextrosa (glucosa) al 5 % p/v contiene: 5 g de glucosa en cada 100 m. L de solución. Solución salina ó suero fisiológico es una solución de Na. Cl (cloruro de sodio) al 0. 9 % p/v que contiene: 0. 9 g de Na. Cl en cada 100 m. L de solución. 15

% p/v = g de soluto x 100 m. L de solución Ejercicios: 1. Calcule el % p/v de una solución que contiene 8. 9 g de Ca. Cl 2, disueltos en 250 m. L de solución. % p/v = 8. 9 g de Ca. Cl 2 x 100 = 3. 56 % p/v 250 m. L 16

2. Calcule el % p/v de una solución que se preparó disolviendo 6. 4 g de urea en agua hasta obtener 500 m. L de solución. % p/v = 6. 4 g x 100 = 1. 28 % p/v. 500 m. L 2. 1. ¿Cuantos gramos de urea necesito para preparar 300 m. L de la solución anterior? (despejar g soluto de la fórmula) % p/v = g soluto x 100 m. L de solución g soluto = % p/v x m. L de solución = 100 = 1. 28 % p/v x 300 m. L = 3. 84 g de urea 100

3. ¿Cuantos m. L de una solución al 3. 9 % m/v de Cloruro de potasio ( KCl) pueden preparase con 15 g de KCl ? % p/v = g soluto x 100 m. L de solución despejar m. L de solución = g soluto x 100 = 15 g x 100 = 384. 62 m. L % p/v 3. 9 % 18

Preparación de Soluciones: en % masa/volumen Si se pesan 5. 0 g de KI y se le agrega agua hasta 250 m. L. El % masa/volumen de la solución de KI será de 2. 0% (m/v). © 2013 Pearson Education, Inc. Chapter 8 Section 3 19

DILUCIONES Se aplica solo a soluciones líquidas. Consiste en agregar más solvente a una solución para hacerla menos concentrada (diluírla) C 1 x V 1 = C 2 x V 2 C 1 y V 1 son la concentración y volumen inicial C 2 y V 2 son la concentración y volumen final diluída, después de agregarle más agua. 20

1. Se diluyen 70 m. L de una solución al 5. 4 % p/v hasta obtener 250 m. L de solución. ¿Cuál es la concentración % p/v de la solución final? C 1= 6. 2 % p/v ; V 1 = 70 m. L C 2 = ? V 2= 200 m. L C 1 x. V 1 = C 2 x. V 2 despejar C 2 = 6. 2% p/v x 70 m. L de solución = 2. 17 % p/v 200 m. L de solución • Al diluir una solución, la concentración final (C 2) siempre será más pequeña. pasó de 5. 4 % p/v 2. 17 % p/v 21

2. ¿Qué volumen de una solución de HCl al 3. 1 % p/v se puede preparar al diluír 50 ml de una solución de HCl al 5. 6 % p/v? V 1= 50 m. L C 1= 5. 6% p/v C 2= 3. 1% p/v V 2 =? C 1 x V 1 = C 2 x V 2 despejar V 2= C 1 x V 1 = 5. 6 % p/v x 50 m. L= 90. 32 m. L C 2 3. 1 % p/v • El volumen final es mayor que el inicial porque se le agregó solvente para que la concentración disminuyera. 22

Forma de expresar concentraciones muy pequeñas de soluto • PARTES POR MILLÓN (se usa para contaminantes) 1. ¿Cuántas partes por millón de Pb +2 hay en una muestra de agua, que contiene 7. 8 mg de Pb+2 en 8 OO m. L? ppm = 7. 8 mg = 9. 75 mg/L = 9. 75 ppm O. 8 L 23

2. Cuántos mg de F- hay en 5 Litros de una muestra de agua que contiene 3. 7 ppm de ión floruro ( F)? mg de F- = 3. 7 mg de F- x 5 Litros 1 litro = 18. 5 mg de F 3. En cuántos litros de una solución concentración de 1. 95 ppm de un insecticida a base de piretrina, estarán contenidos 30 mg de piretrina? (despejar litros) ppm = mg / L L = mg / ppm L = 30. 0 mg / 1. 95 mg/L = 15. 38 L 24

Ejercicios: 1. Calcule % p/p de una solución preparada con 25 g KCl y 125 g de H 20. 2. Calcule % p/p de una solución preparada disolviendo 8. 0 g Ca. Cl 2 en agua hasta obtener 180. 0 g de solución. 3. ¿Cuántos g de NH 4 Cl se necesitan para preparar 1, 250 m. L de una solución al 4 % p/v? 4. ¿Cuantos m. L de una solución de alcohol al 20 % v/v pueden prepararse con 50 m. L de alcohol? 25

5. ¿Cuál es el % p/v de una solución que contiene 65 g de H 2 SO 4 en 400 m. L de solución? 6. ¿Cuántas ppm tiene una muestra de agua que contiene 3. 8 mg de F en 450 m. L? 7. ¿A que volumen final debemos diluir 40 m. L de una solución al 6. 2 % p/v para obtener una solución al 2. 4 % p/v ? 8. ¿Cuantos litros de solución salina ( 0. 9 % p/v) se necesitan para obtener 3. 15 g de Na. Cl ? 9. Un paciente necesita 140 g de glucosa en las próximas 12 horas. ¿Cuántos litros de una solución de glucosa al 5 % p/v se le debe administrar ? 26
 Partes da missa
Partes da missa Te invitamos a ser parte
Te invitamos a ser parte Este parte aquele parte
Este parte aquele parte Como escribir numeros decimales
Como escribir numeros decimales Nomenclatura das bases
Nomenclatura das bases Hidrocarburos
Hidrocarburos Qumica
Qumica Qumica
Qumica Alquinos características
Alquinos características Setas curvas
Setas curvas Qumica
Qumica Reacciones de orden cero
Reacciones de orden cero Ley de lavoisier
Ley de lavoisier Mistura quimica
Mistura quimica Qumica
Qumica O que são açucares redutores
O que são açucares redutores Qumica
Qumica Qumica
Qumica Color 08062002
Color 08062002 Qumica
Qumica Etapas da gravimetria
Etapas da gravimetria Qumica
Qumica Entalpia
Entalpia Qumica
Qumica Truta
Truta Teoria cinetica de los gases
Teoria cinetica de los gases Ch3-ch-ch2-ch-ch3
Ch3-ch-ch2-ch-ch3


















































