SEMANA 9 CONCENTRACIN DE SOLUCIONES PARTE 2 QUMICA























- Slides: 26

SEMANA 9 CONCENTRACIÓN DE SOLUCIONES PARTE 2 QUÍMICA 2016 1

• • CONCENTRACIÓN DE SOLUCIONES II Molaridad Molalidad Equivalente y miliequivalente Normalidad Neutralización. Titulación ácido-base. Dilución (calculo en M y N) • Aplicaciones médicas de meq/L • Laboratorio: Soluciones y titulación ácido-base

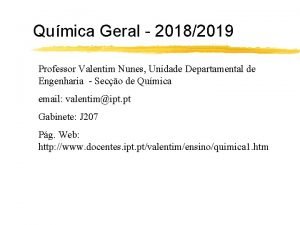
MOLARIDAD (M) Se utilizan las fórmulas del soluto y sus pesos moleculares • Si tenemos moles de soluto • Si tenemos gramos de soluto Para milimoles: M= mmoles de soluto mililitros de solución 3

Ejercicios 1. Calcule la Molaridad de una solución que contiene 0. 75 moles de soluto en 850 m. L de solución. 1 L = 1000 m. L, 850 m. L = 0. 850 L R: 0. 88 M ¿Qué significa 0. 88 Molar? 4

2. Calcule la M de una solución que se preparó disolviendo 60 g de Na. OH en agua hasta obtener 0. 250 L de solución. R: 5. 99 M 3. ¿Cuántos g de glucosa (C 6 H 12 O 6) se necesitan para preparar 1. 5 L de una solución 0. 25 M ? g de soluto = M x peso molecular x L R: 67. 55 g de glucosa 5

4. ¿Cuantos m. L de una solución 2. 3 M de KCl contienen 420 g de KCl? L = g / peso molecular M 2. 45 L = 2, 450 m. L 5. Cuántos milimoles de HCl hay en 100 m. L de solución 0. 01 M de HCl ? 1 6

Como se prepara una solución Molar en el laboratorio: Ej: Na. Cl 2 M

MOLALIDAD (m) Si tenemos moles de soluto: Si tenemos gramos de soluto: 8

1. Calcule la molalidad de una solución que se preparó disolviendo 700 g de glucosa en 750 g de agua. 1 Kg = 1000 g, 700 g = 0. 75 Kg R: 5. 18 m ¿Qué significa 5. 18 molal? 9

2. ¿En cuantos gramos de agua, se deben disolver 120 gramos de Urea CO (NH 2)2 para obtener una solución 0. 35 m? Kg solvente = g soluto / peso molecular m = 5, 71 Kg R: 5, 710 g de agua 10

NORMALIDAD (N) Si tenemos # de equivalentes de soluto: Si tenemos gramos de soluto: # Equivalentes = g de sustancia. Peso equivalente N = g de soluto / peso equivalente de soluto Litros de solución N = miliequivalentes de soluto (meq ) mililitros de solución ( m. L) 11

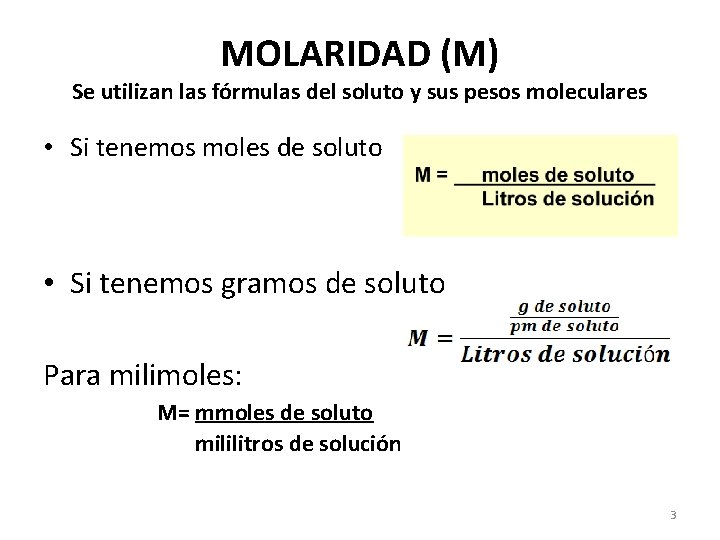
Peso Equivalente (Peq) ACIDOS Peq = Peso Fórmula en gramos # H+ sustituibles BASES Peq = Peso Fórmula en gramos # OH- sustituibles SALES Peq = Peso Fórmula en gramos # total de cargas del catión HCl Peq = 36. 5 g/1 = 36. 5 g H 2 SO 4 Peq = 98 g/2 = 49 g Na. OH Peq = 40 g / 1 = 40 g Ca(OH)2 Peq = 74 g/ 2 = 37 g Al. Cl 3 Peq= 133. 5 g / 3 = 44. 5 g Ca 3(PO 4)2 Peq= 310. 24 g/ 6=51. 71 g el metal de la sal 12

Ejercicios 1. Calcule la N de una solución preparada disolviendo 76 g de K 2 CO 3 en agua hasta obtener 500 m. L de solución. N = g de K 2 CO 3 / peso equiv del K 2 CO 3 Litros de solución Peso equiv del K 2 CO 3 = 138. 21 g/mol = 69. 105 g/eq 2 eq/mol N = 76 g de K 2 CO 3 / 69. 105 g/eq = 2. 20 eq/L = 2. 2 N 0. 5 L 13

2. Calcular la N de una solución que contiene 0. 8 eq de H 2 SO 4 disueltos en 600 m. L de solución. R: 1. 33 N ¿Qué significa 1. 33 N? 3. Calcule la N de una solución que contiene 45 meq de Ca(OH)2 disueltos en 150 m. L de solución. N= meq de soluto / m. L de solución = 45 meq Ca(OH)2 / 150 m. L = 0. 3 N (0. 3 Eq /L) 14

4. ¿Cuántos meq de H 3 PO 4 hay en 320 m. L de una solución 0. 08 N? N = meq de soluto / m. L de solución meq = N x m. L = 25. 6 meq 5. Calcular el número de gramos de H 2 SO 4 necesarios para preparar 325 ml de solución de H 2 SO 4 0. 25 N. 15




Conversión entre Molaridad y Normalidad # de N = (M)( # ) corresponde a ACIDO: H + BASE : OHSAL : Cargas (+) totales del metal 1. ¿Cuál es la N de una solución de H 2 SO 4 0. 5 M? 2. ¿Cuál es la M de una solución de Na(OH)0. 3 N? 3. Calcule la M y N de una solución de K 2 S al 65% p/v: 19

DILUCIONES DE M y N V 1 C 1 = V 2 C 1 y C 2 deben estar en la misma unidad de medida. V 1 y V 2 en la misma unidad de medida. 1. ¿Cuál será la Normalidad, de una solución de Ca. Cl 2 0. 27 N si 300 m. L de la solución se diluyen hasta 450 m. L ? R: 0. 18 N 2. ¿A cuantos m. L se deben diluir 200 m. L de una solución 0. 62 M para que su concentración sea 0. 13 M ? 20

Titulación ácido-base La titulación de un acido y/o base tiene como fundamento, la reacción de neutralización, vista anteriormente, que es: Acido + Base Sal + H 2 O HCl(ac) + KOH(ac) KCl(ac) + H 2 O Se puede calcular la concentración ó el volumen del ácido ó la base en el punto de equivalencia de una titulación con la fórmula: N V =N V N = normalidad ácido base V = volumen Punto de equivalencia se observa cuando el indicador cambia de color (viraje). 21

Ejercicios 1. ¿Qué volumen de una solución 0. 25 N de HNO 3 se necesita para neutralizar 35 ml de una solución de Ca(OH)2 0. 95 N? 2. ¿Cuál es la N de una solución de Na. OH si 25 ml de ésta se neutralizaron con 15 ml de una solución de H 2 SO 4 0. 45 N? 22

3. Una solución de Na. OH se tituló con H 2 SO 4 0. 15 N. Si se neutralizaron 18. 4 ml de Na. OH con 26 ml H 2 SO 4 ¿Cuál es la normalidad de la base? 23

TITULACIÓN N ACIDO X VACIDO = N BASE X V BASE Es la determinación del volumen necesario de una solución de concentración conocida llamada solución estándar, para que reaccione completamente con una cantidad dada de una solución de concentración desconocida (muestra). Conc. conocida Punto de equivalencia muestra 24

Procedimiento para titular en el laboratorio: Se coloca en un erlenmeyer un volumen conocido de ácido ó base (muestra) del que se quiere averiguar su concentración (N). Se le agregan unas gotas de indicador para ver el viraje ó cambio de color en el punto de equivalencia de la neutralización. En una bureta se coloca una solución estándar de la cual sí se conoce su concentración (N). Se deja caer gota a gota la solución estándar en el erlenmeyer agitando continuamente. La titulación termina cuando se igualan los equivalentes de la solución estandar con los equivalentes de la muestra, a este momento se le conoce como PUNTO DE EQUIVALENCIA. Al alcanzar el punto de equivalencia se observa un cambio de color del indicador (viraje), y este es el PUNTO FINAL. En este punto se lée en la bureta el volumen que se agregó y servirá para colocarlo en la fórmula y averiguar la N que falta.

Ej: Titulación de una solución acida Conc. conocida Punto de equivalencia muestra 26
 Te invitamos a ser parte
Te invitamos a ser parte Este parte aquele parte
Este parte aquele parte Como multiplicar decimales
Como multiplicar decimales Slides para missa
Slides para missa Truta
Truta Qumica
Qumica Reaccion de condensacion
Reaccion de condensacion Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Fqcolindres 2 eso
Fqcolindres 2 eso Química orgânica resumo
Química orgânica resumo Istopos
Istopos Qumica
Qumica Fórmula bastão
Fórmula bastão Qumica
Qumica Qué son las propiedades intensivas
Qué son las propiedades intensivas Ejemplos de epimeros
Ejemplos de epimeros Qumica
Qumica Qumica
Qumica Na
Na Entalpia
Entalpia Qumica
Qumica Número atomico
Número atomico N
N Qumica
Qumica