SEMANA 9 CONCENTRACIN DE SOLUCIONES PARTE 2 QUMICA
















- Slides: 21

SEMANA 9 CONCENTRACIÓN DE SOLUCIONES PARTE 2 QUÍMICA 2020 1

Semana 09 CONCENTRACIÓN DE SOLUCIONES II Molaridad Molalidad Equivalente y miliequivalentes Normalidad Dilución Aplicaciones médicas de meq/L Aplicación de los conceptos en la salud Lecturas en libro de texto - La Química en la Salud: “Electrolitos en los líquidos corporales” Laboratorio: Soluciones

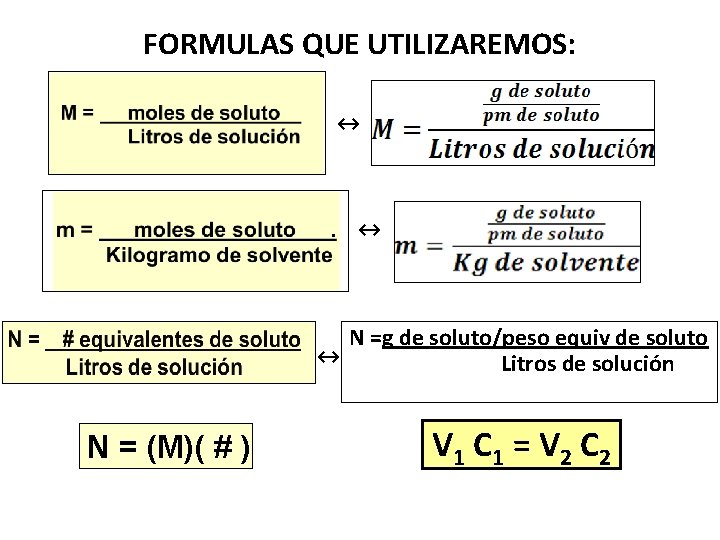
FORMULAS QUE UTILIZAREMOS: ↔ ↔ ↔ N = (M)( # ) N =g de soluto/peso equiv de soluto Litros de solución V 1 C 1 = V 2 C 2

MOLARIDAD (M) expresa los moles de soluto contenidos en cada litro de una solución es una concentraciones en unidades químicas porque se utilizan las fórmulas del soluto y sus pesos moleculares • Si tenemos moles o milimoles de soluto usaremos: ó M= mmoles de soluto mililitros de solución • Si tenemos gramos de soluto en vez de moles: 4

Ejercicios 1. Calcule la Molaridad de una solución que contiene 0. 75 moles de soluto en 850 m. L de solución. (se usan litros) 1 L = 1000 m. L 850 m. L = 0. 850 L M= 0. 75 /0. 850 = 0. 88 M ¿Qué significa 0. 88 Molar? • Que en cada litro de esta solución están contenidos o disueltos 0. 88 moles de soluto. 5

2. Calcule la M de una solución que se preparó disolviendo 60 g de Na. OH en agua hasta obtener 0. 250 L de solución. (PM Na. OH = 40 gramos) M=60/40/. 250 = 6 Molar 3. ¿Cuántos g de glucosa (C 6 H 12 O 6) se necesitan para preparar 1. 5 L de una solución 0. 25 M ? (recordar que todo lo que divide pasa a multiplicar del otro lado de la ecuación) despejando: g de soluto = M x peso molecular x L = 0. 25 x 180 x 1. 5 = 67. 5 g de glucosa 6

4. ¿Cuantos m. L de una solución 2. 3 M de KCl contienen 420 g de KCl? L = g / peso molecular = 420/74. 55/2. 3 =2. 45 L x 1000=2, 450 m. L M 5. Cuántos milimoles de HCl hay en 100 m. L de solución 0. 01 M de HCl ? M= mmoles de soluto mililitros de solución mmoles = M x m. L = 0. 01 x 100 = 1 mmol 7

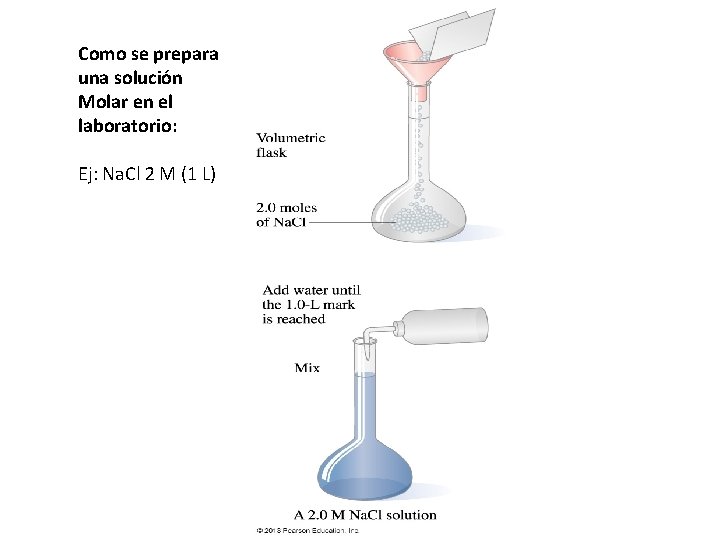
Como se prepara una solución Molar en el laboratorio: Ej: Na. Cl 2 M (1 L)

MOLALIDAD (m) expresa los moles de soluto contenidos en cada kilogramo de solvente (agua) es una concentraciones en unidades químicas porque se utilizan las fórmulas del soluto y sus pesos moleculares Si tenemos el soluto en moles usaremos: Si tenemos el soluto en gramos: 9

1. Calcule la molalidad de una solución que se preparó disolviendo 700 g de glucosa en 750 g de agua. 1 Kg agua=1000 g 700 g = 0. 75 Kg 1 mol de glucosa=180 g 700 g = 3. 89 mol m= 3. 89/0. 75 = 5. 19 molal ¿Qué significa 5. 18 molal? • Que en cada kilogramos (1000 gramos) de solvente o agua, están contenidos o disueltos 5. 18 moles de soluto. 10

2. ¿En cuantos gramos de agua, se deben disolver 120 gramos de Urea CO (NH 2)2 para obtener una solución 0. 35 m? PM urea = 60 g Kg= 120/60/0. 35 = 5. 17 kg 11

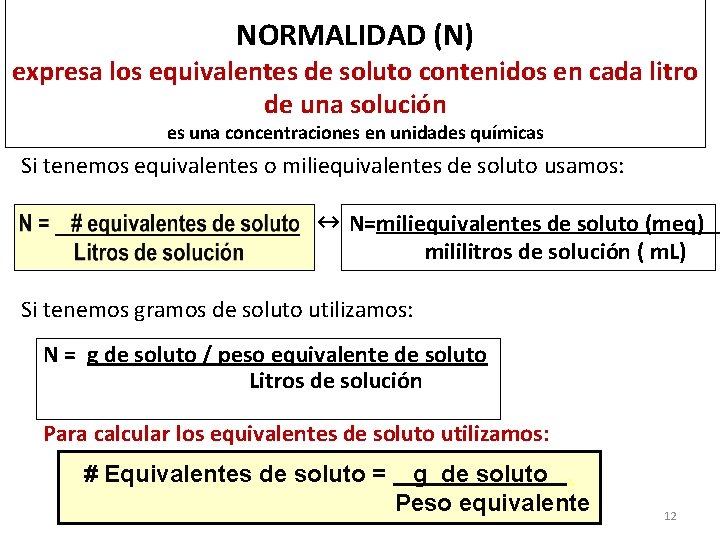
NORMALIDAD (N) expresa los equivalentes de soluto contenidos en cada litro de una solución es una concentraciones en unidades químicas Si tenemos equivalentes o miliequivalentes de soluto usamos: ↔ N=miliequivalentes de soluto (meq) mililitros de solución ( m. L) Si tenemos gramos de soluto utilizamos: N = g de soluto / peso equivalente de soluto Litros de solución Para calcular los equivalentes de soluto utilizamos: # Equivalentes de soluto = g de soluto. Peso equivalente 12

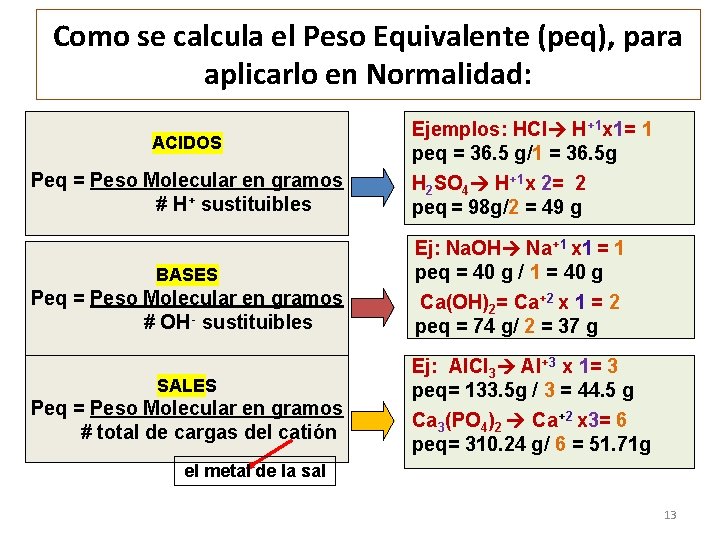
Como se calcula el Peso Equivalente (peq), para aplicarlo en Normalidad: ACIDOS Peq = Peso Molecular en gramos # H+ sustituibles Ejemplos: HCl H+1 x 1= 1 peq = 36. 5 g/1 = 36. 5 g H 2 SO 4 H+1 x 2= 2 peq = 98 g/2 = 49 g BASES Ej: Na. OH Na+1 x 1 = 1 peq = 40 g / 1 = 40 g Peq = Peso Molecular en gramos # OH- sustituibles Ca(OH)2= Ca+2 x 1 = 2 peq = 74 g/ 2 = 37 g SALES Peq = Peso Molecular en gramos # total de cargas del catión Ej: Al. Cl 3 Al+3 x 1= 3 peq= 133. 5 g / 3 = 44. 5 g Ca 3(PO 4)2 Ca+2 x 3= 6 peq= 310. 24 g/ 6 = 51. 71 g el metal de la sal 13

Ejercicios 1. Calcule la N de una solución preparada disolviendo 76 g de K 2 CO 3 en agua hasta obtener 500 m. L (0. 5 L) de solución. (para el peq. del K 2 CO 3 se divide entre 2 porque hay 2 K+1= 2 x+1= 2 cargas) N= 76/69. 1/0. 5 = 2. 2 N Qué significa 2. 2 Normal? Que en cada Litro de esta solución están contenidos o disueltos 2. 2 equivalentes de soluto, (que equivaldría a 152. 02 gramos porque 1 eq= 69. 1 g 2. 2 eq=152. 02 g 14

2. Calcular la N de una solución que contiene 0. 8 eq de H 2 SO 4 disueltos en 600 m. L de solución. (600 m. L= 0. 6 L) N= 0. 8/0. 6= 1. 33 Normal 3. Calcule la N de una solución que contiene 45 meq de Ca(OH)2 disueltos en 150 m. L de solución. N=miliequivalentes de soluto (meq) mililitros de solución ( m. L) N= 45 meq Ca(OH)2 / 150 m. L = 0. 3 N (0. 3 Eq /L) 15

4. ¿Cuántos meq de H 3 PO 4 hay en 320 m. L de una solución 0. 08 N? N=miliequivalentes de soluto (meq) mililitros de solución ( m. L) meq = N x m. L = 0. 08 x 320 = 25. 6 meq 5. Calcular el número de gramos de Al. PO 4 necesarios para preparar 325 ml de solución de Al. PO 4 0. 25 N. N = g de soluto / peso equivalente de soluto Litros de solución para el peq. del Al. PO 4 se divide su PM entre 3 porque la carga del Al es +3 y solo hay 1 Al+3 +3 x 1= 3 peso equiv. Al. PO 4 = 121. 95 g/3 = 40. 65 g g = Nx. Lxpeq = 0. 25 x 0. 325 x 40. 65 = 3. 30 g 16




Conversión entre Molaridad y Normalidad # si es: se utiliza el # de: N = (M)( # ) ACIDO: # de H + BASE: # de OHSAL: # de Cargas (+) totales del metal 1. ¿Cuál es la N de una solución de H 2 SO 4 0. 5 M? N=0. 5 x 2 (H)= 1 Normal 2. ¿Cuál es la M de una solución de Na. OH 0. 3 N? M=N/# = 0. 3/1 = 0. 3 Molar 3. Calcule la M y N de una solución de K 2 S al 65% p/v: 65%=65 g de K 2 S en 100 m. L (0. 1 L) de solución. Esto se puede aplicar a la fórmula de M o N. Peso equivalente de K 2 S= PM/2 porque tiene 2 K y cada uno tiene carga +1 2 x+1=2. Si averiguamos primero su M, después hacemos la conversión. M=65/110. 2/0. 1=5. 9 M N=Mx# N= 5. 9 x 2=11. 8 N 20

DILUCIONES DE M y N Cuando una solución mas concentrada se diluye (agrega agua), se prepara una menos concentrada C 1. V 1 = C 2. V 2 NXV=NXV ó MXV=MXV 1=Inicial (más conc. ) 2=Final (menos conc. ) C 1 y C 2 deben estar en la misma unidad de medida. Puede ser M o N V 1 y V 2 en la misma unidad de medida. Puede ser L o m. L 1. ¿Cuál será la nueva Normalidad de una solución de Ca. Cl 2 0. 27 N si 300 m. L de la solución se diluyen hasta 450 m. L ? Nx. V=Nx. V N=Nx. V/V N= 0. 27 x 300 / 450 = 0. 18 N 2. ¿A cuantos L se deben diluir 0. 2 L de una solución 0. 62 M para que su concentración sea 0. 13 M ? MXV=MXV V=MXV/M V= 0. 62 x 0. 2 / 0. 13 = 0. 95 L 21