CONCENTRACIN Concentracin formas de expresarla gramoslitro Tanto por













![Molaridad: [M] • Cantidad de moles de soluto que existen en un litro de Molaridad: [M] • Cantidad de moles de soluto que existen en un litro de](https://slidetodoc.com/presentation_image_h2/14b722476b10d25377ad46edee10577d/image-14.jpg)











- Slides: 27

CONCENTRACIÓN

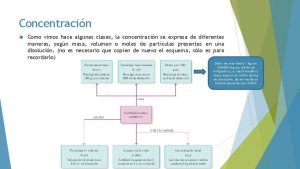
Concentración (formas de expresarla) • • gramos/litro Tanto por ciento en masa-volumen. Molaridad. Tanto por ciento en volumen. Fracción molar. Molalidad. 2

SOLUCIONES • Las soluciones indican la relación entre dos componentes. • El primer componente se llama soluto y el segundo componente, solvente. • El soluto será el que esté en menor proporción. El solvente será el que esté en mayor proporción y es el que disuelve al soluto. Soluto + Solvente = Solución

DENSIDAD • La densidad de una sustancia es la masa de la sustancia dividida por el volumen de esa sustancia. • Se mide en g/cm 3

Porcentaje en masa (%m/m) • Es la masa de soluto que está contenida en 100 g de solución.



Porcentaje en volumen (% V/ V) • Es el volumen de soluto que está contenido en 100 m. L de solución.


Porcentaje masa- volumen (% m/ V) • Es la masa de soluto que se encuentra en 100 m. L de solución.


* Una solución acuosa de vinagre (CH 3 COOH) 0, 4 % m/ V tiene: A) 0, 4 gramos de vinagre en 1000 m. L solución. B) 0, 4 gramos de vinagre en 1000 m. L solvente. C) 0, 4 moles de vinagre en 100 m. L solución. D) 0, 4 moles de vinagre en 100 m. L solvente. E) 0, 4 gramos de vinagre en 100 m. L solución. COMPRENSIÓN E de de de

* Calcule % m/V si se dispone de 250 m. L de una solución que contiene 15 g de HCN A) 6, 0 % m/V B) 0, 6 % m/V C) 60 % m/V D) 66 % m/V E) 0, 06 % m/V A APLICACIÓN
![Molaridad M Cantidad de moles de soluto que existen en un litro de Molaridad: [M] • Cantidad de moles de soluto que existen en un litro de](https://slidetodoc.com/presentation_image_h2/14b722476b10d25377ad46edee10577d/image-14.jpg)
Molaridad: [M] • Cantidad de moles de soluto que existen en un litro de solución.

* Determine la molaridad de 100 m. L de una solución acuosa que contiene 50 g de permanganato de potasio (KMn. O 4). A) B) C) D) E) 0, 318 M 3, 180 M 31, 80 M 3, 180 m 31, 80 m B APLICACIÓN

* Una solución acuosa 1, 5 M de ácido acético implica que hay B A) 1, 5 gramos de ácido acético en un litro solución. B) 1, 5 moles de ácido acético en un litro solución. C) 1, 5 gramos de ácido acético en un kg solvente. D) 1, 5 gramos de ácido acético en un litro solvente. E) 1, 5 moles de ácido acético en un litro solvente. COMPRENSIÓN de de de

Molalidad (m) • Es la cantidad de moles de soluto que están disueltos en 1 kg de solvente.

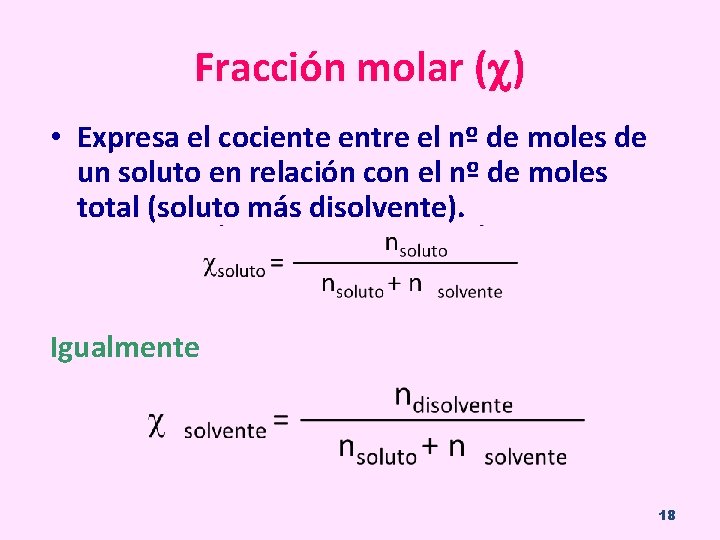
Fracción molar ( ) • Expresa el cociente entre el nº de moles de un soluto en relación con el nº de moles total (soluto más disolvente). Igualmente 18


Calcular la fracción molar de CH 4 y de C 2 H 6 en una mezcla de 4 g de CH 4 y 6 g de C 2 H 6 y comprobar que la suma de ambas es la unidad. 4 g 6 g n (CH 4) =———— = 0, 25 mol; n (C 2 H 6) =————= 0, 20 mol 16 g/mol 30 g/mol n (CH 4) 0, 25 mol (CH 4) = ————————— = 0, 56 n (CH 4) + n (C 2 H 6) 0, 25 mol + 0, 20 mol n (C 2 H 6) 0, 20 mol (C 2 H 6) = ————————— = 0, 44 n (CH 4) + n (C 2 H 6) 0, 25 mol + 0, 20 mol (CH 4) + (C 2 H 6) = 0, 56 + 0, 44 = 1 20

PARTES POR MILLÓN (ppm) • Esta unidad de concentración se usa para soluciones muy diluidas, como en el análisis de agua o preparaciones biológicas. • En estas soluciones muy diluidas, su densidad es muy cercana a la del agua y se supone que la densidad de la solución es de 1, 00 g/m. L (igual a la del agua). Por lo anterior, se puede hacer la simplificación de mg soluto/Litro de solución

PARTES POR MILLÓN (ppm) • Son los miligramos de soluto contenidos en un millón de miligramos de solución. • En soluciones diluidas: es aproximadamente mg de soluto en un litro de solución.

Partes por millón (ppm) ppm = m de soluto (en mg) m de solución (en mg) m de soluto (en mg) V de solución (en L)

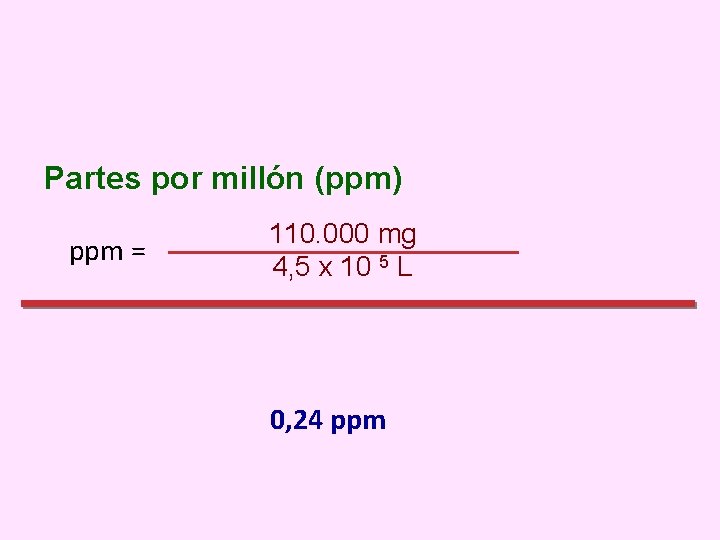
EJEMPLO • Mediante determinó contenían Determine ppm. un análisis experimental se que 4, 5 x 105 litros de agua 110 gramos de iones Na+. la concentración de iones Na+ en

Partes por millón (ppm) ppm = 110. 000 mg 4, 5 x 10 5 L 0, 24 ppm

EJEMPLO. • Una muestra de agua contiene 3. 5 mg de iones fluoruro (F-) en 825 m. L de solución. Calcule las partes por millón del ion fluoruro en la muestra

EJEMPLO • Calcule los mg de fluoruro (F-) que hay en una muestra de 1. 25 L de solución que tiene 4. 0 ppm de ion fluoruro
 Chi è questa che ven ch'ogn'om la mira
Chi è questa che ven ch'ogn'om la mira Invoco al dios altisimo al dios que hace tanto por mi
Invoco al dios altisimo al dios que hace tanto por mi Por tanto
Por tanto Concepto de porcentaje
Concepto de porcentaje Por lo tanto lo que dios ha unido
Por lo tanto lo que dios ha unido Por lo tanto id y haced discipulos
Por lo tanto id y haced discipulos La educacion es un acto de amor
La educacion es un acto de amor Formas compuestas del modo indicativo
Formas compuestas del modo indicativo Infinitivo gerundio y participio ejercicios
Infinitivo gerundio y participio ejercicios Nuestras almas se acercaron tanto asi
Nuestras almas se acercaron tanto asi Pero me duele no gritar tu nombre en toda libertad
Pero me duele no gritar tu nombre en toda libertad Poema gracias
Poema gracias Dio ha tanto amato il mondo
Dio ha tanto amato il mondo De tanto ver triunfar as nulidades
De tanto ver triunfar as nulidades Ele tanto amou tudo suportou
Ele tanto amou tudo suportou Figure retoriche onomatopea
Figure retoriche onomatopea No corras tanto
No corras tanto Dios hará justicia por mi
Dios hará justicia por mi è tanto bello essere amici giocare insieme sentirsi felici
è tanto bello essere amici giocare insieme sentirsi felici Pepeconfused
Pepeconfused No te justifiques tanto
No te justifiques tanto Tanto cuanto san ignacio
Tanto cuanto san ignacio La paz te doy a ti mi hermano
La paz te doy a ti mi hermano Antes de escrever pense
Antes de escrever pense Amor de madre que no guarda rencor
Amor de madre que no guarda rencor La pasion de cristo maria
La pasion de cristo maria Mientras tanto que voy ocupate de la lectura
Mientras tanto que voy ocupate de la lectura Tanto am
Tanto am