SEMANA 7 AGUA Y SOLUCIONES QUMICA 2016 1





















- Slides: 25

SEMANA 7 AGUA Y SOLUCIONES QUÍMICA 2016 1

Semana 7 AGUA Y SOLUCIONES Agua, Mezclas y Solubilidad Agua: • Características, propiedades (tensión superficial, capilaridad), funciones en el cuerpo humano, usos y tratamiento. Mezclas: • Homogénea y heterogénea. • Solubilidad Soluciones: Definición, partes que la forman. • Procesos de disolución: Hidratación (solvatación). • Clasificación de soluciones por el estado físico: Sólidas, líquidas y gaseosas. • Factores que afectan la solubilidad y la velocidad de solubilidad: • Presión, Temperatura, Área superficial (tamaño de la partícula), naturaleza de sus componentes. Densidad de soluciones: definición y aplicación. • Aplicación de los conceptos en la salud y el ambiente. Laboratorio: Agua y solubilidad de sustancias químicas. 2

EL AGUA Cubre ± 71 % de la superficie del planeta. Constituye ± el 60 % del peso del adulto y 75% del peso del niño. Características: • Incolora, insabora, inodora • Densidad 1 g/cm 3 • Polar (sus moléculas son polares) • Solvente universal para preparar soluciones: es un solvente polar que disuelve sustancias iónicas y covalentes polares. 3

Algunas propiedades del Agua Tensión superficial • Fuerza que aumenta la atracción entre las moléculas vecinas en la superficie del agua. • Provoca que la superficie del líquido se contraiga y forme una gota esférica • y que la superficie actúe como si fuera una membrana o piel delgada, invisible elástica donde pueden caminar los insectos muy livianos. 4

Capilaridad Se debe a la atracción que • Movimiento del agua a través de los capilares ejercen las paredes de presentes en tejidos tubos capilares hacia las vivos. moléculas polares del agua, provocando su • Movimiento de agua ascenso. Por ejemplo: desde las raíces hacia las hojas y tallos en árboles. 5

Funciones del AGUA en el cuerpo humano • Transporte de nutrientes : absorción • Transporte de desechos: a través de riñones por la orina, o bien por tracto digestivo y sudor. • Termoregulador corporal: a través de sudoración. • Medio acuosa para reacciones enzimáticas: disolvente polar • Lubricante y amortiguadora: evita fricción entre estructuras • Activadora metabólica 6

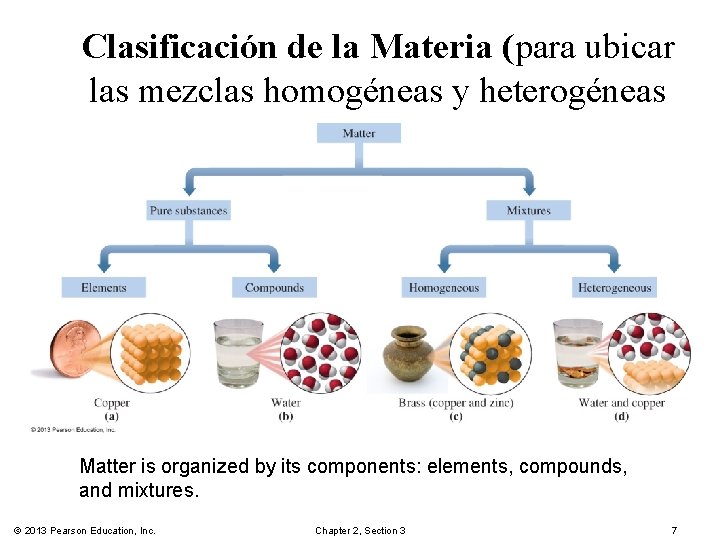
Clasificación de la Materia (para ubicar las mezclas homogéneas y heterogéneas Matter is organized by its components: elements, compounds, and mixtures. © 2013 Pearson Education, Inc. Chapter 2, Section 3 7

Types of Mixtures are § classified by their composition. § called homogeneous when they are uniform. § called heterogeneous when they are not uniform. Mixtures Homogeneous = Soluciones Mixture – Uniform (Una fase) Heterogeneous Mixture – Not uniform(2 o más fases) © 2013 Pearson Education, Inc. Chapter 2, Section 3 8

Mezclas Homogéneas = soluciones In a homogeneous mixture, the § composition is uniform throughout, and § different parts of the mixture are not visible. © 2013 Pearson Education, Inc. Chapter 2, Section 3 9

Mezclas Heterogéneas In a heterogeneous mixture, the § composition is not uniform; it varies from one part of the mixture to another, and § different parts of the mixture are visible. © 2013 Pearson Education, Inc. Chapter 2, Section 3 10

SOLUCIÓN, definición (También llamada disolución) • Es una MEZCLA HOMOGÉNEA de dos o más sustancias. Forman UNA FASE, por lo que no se distinguen sus componentes. • Está formada por una sustancia llamada SOLUTO (está en menor cantidad) la cual se disuelve ó dispersa en la otra sustancia llamada SOLVENTE (está en mayor cantidad). 11

SOLUBILIDAD: Máxima cantidad de soluto que puede disolverse en 100 g de solvente, a una temperatura dada. ¿Cuáles de estas son soluciones? 12

Water is the most common solvent in nature. § is a polar molecule. § forms hydrogen bonds between the partially positive hydrogen atom in one molecule and the partially negatively charged oxygen atom in a different water molecule. © 2013 Pearson Education, Inc. Chapter 8, Section 1 13

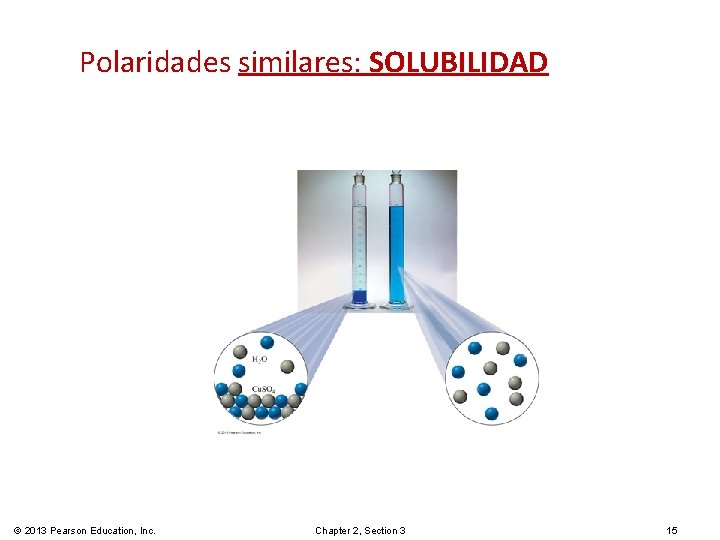
Para que se pueda formar una Solución: Soluto y solvente deben tener polaridades similares Polaridades no similares: INSOLUBILIDAD 14

Polaridades similares: SOLUBILIDAD © 2013 Pearson Education, Inc. Chapter 2, Section 3 15

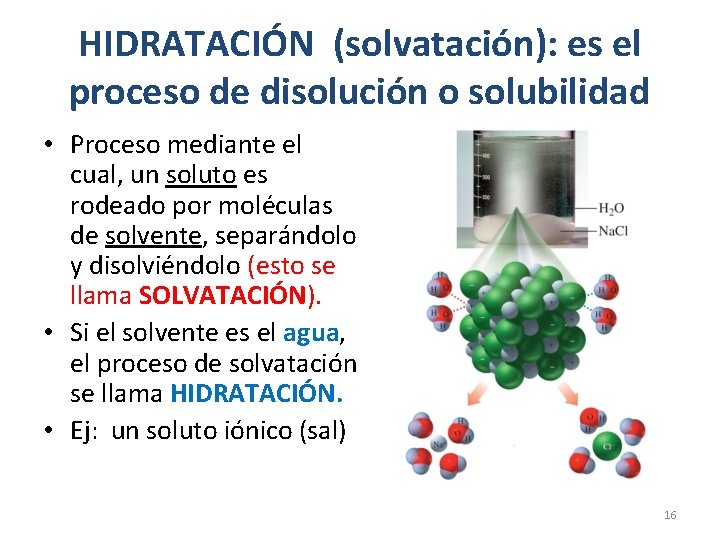
HIDRATACIÓN (solvatación): es el proceso de disolución o solubilidad • Proceso mediante el cual, un soluto es rodeado por moléculas de solvente, separándolo y disolviéndolo (esto se llama SOLVATACIÓN). • Si el solvente es el agua, el proceso de solvatación se llama HIDRATACIÓN. • Ej: un soluto iónico (sal) 16

• Ej: un soluto covalente polar (azucar) • La región parcialmente negativa del agua rodea la porción positiva del soluto y la región parcialmente positiva del agua rodea la porción negativa del soluto, lo separa y lo disuelve. 17

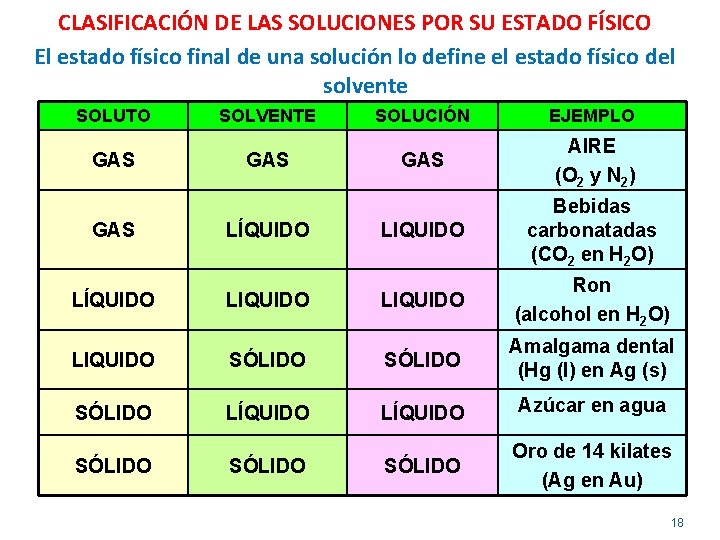
CLASIFICACIÓN DE LAS SOLUCIONES POR SU ESTADO FÍSICO El estado físico final de una solución lo define el estado físico del solvente SOLUTO SOLVENTE SOLUCIÓN EJEMPLO GAS GAS AIRE (O 2 y N 2) GAS LÍQUIDO LIQUIDO Bebidas carbonatadas (CO 2 en H 2 O) LÍQUIDO LIQUIDO Ron (alcohol en H 2 O) LIQUIDO SÓLIDO Amalgama dental (Hg (l) en Ag (s) SÓLIDO LÍQUIDO Azúcar en agua SÓLIDO Oro de 14 kilates (Ag en Au) SÓLIDO 18

FACTORES QUE AFECTAN LA SOLUBILIDAD TEMPERATURA • Solutos sólidos: A mayor temperatura, mayor solubilidad. Ej: azúcar en liquido caliente ó frío • Solutos gaseosos: A mayor temperatura, menor solubilidad. PRESIÓN • Solutos gaseosos: A mayor presión, mayor solubilidad. 19

20

AREA SUPERFICIAL (tamaño del soluto) • A menor tamaño de la partícula de soluto, mayor área superficial y mayor velocidad de solubilidad. Ej: azúcar gruesa o refinada. NATURALEZA DE SUS COMPONENTES • Se refiere a la polaridad ó apolaridad del soluto y el solvente. Lo similar disuelva a los similar. 21

Ejercicio • El agua es solvente polar. Disuelve solutos polares como por ej: No disuelve solutos apolares como por ej: • La gasolina es solvente apolar. Disuelve solutos apolares como por ej: No disuelve solutos polares como por ej: • El Na. Cl es un soluto polar: Lo disuelve el solvente polar: y No lo disuelve: • El aceite es un soluto apolar: Lo disuelve el solvente apolar: y No lo disuelve: 22

Densidad de las soluciones DENSIDAD = MASA. VOLUMEN Las dimensionales de la densidad de soluciones sólidas: g/ cc ó g/ cm 3 líquidas: g/ m. L y gaseosas: g / L Densidad del agua: 1 g/m. L Densidad de la orina: 1. 003 -1. 030 g/m. L Densidad del plasma: 1. 03 g/m. L Lea: Densidad ósea en la Química en la salud, pág: 37. 23


Problemas de densidad 1. Calcule la densidad de un aceite si 280 m. L de éste pesan 244. 5 g. d = m/v d= 244. 5 g / 280 m. L d= 0. 8732 g/m. L 2. ¿Que volumen ocuparan 850 g de una solución que tiene una densidad de 1. 34 g /cm 3 ? d = m / v, despejar v v = m/ d v= 850 g / 1. 34 g /cm 3 = 634. 33 cm 3 3. La orina de un enfermo renal tiene una densidad de 1. 045 g /m. L. Se recolectaron 2, 200 gramos de orina ¿A qué volumen corresponde? 4. ¿Que volumen de ácido sulfúrico (d= 1. 84 g/ml) se necesitan para realizar un experimento que requiere 85 g del ácido? 25

















































