SEMANA 7 AGUA Y SOLUCIONES CAPTULO 8 El

















- Slides: 28

SEMANA 7 AGUA Y SOLUCIONES CAPÍTULO 8

El agua es el compuesto químico más abundante en nuestro planeta. Propiedades y características: leer el documento de apoyo y libro de texto

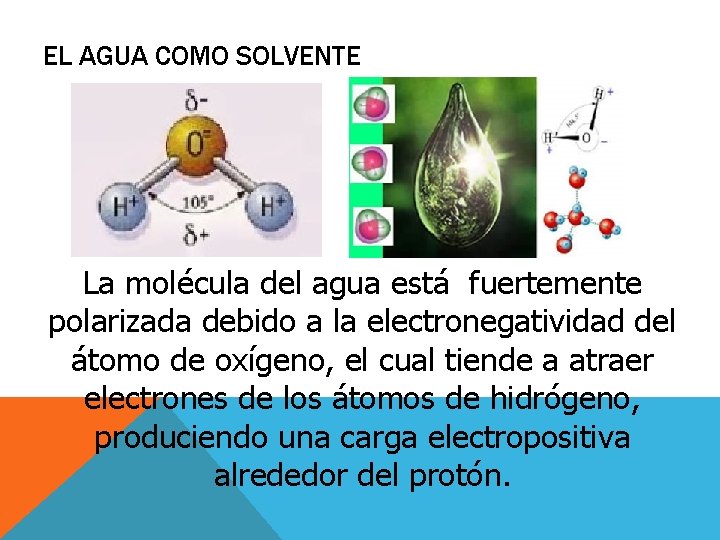
EL AGUA COMO SOLVENTE La molécula del agua está fuertemente polarizada debido a la electronegatividad del átomo de oxígeno, el cual tiende a atraer electrones de los átomos de hidrógeno, produciendo una carga electropositiva alrededor del protón.

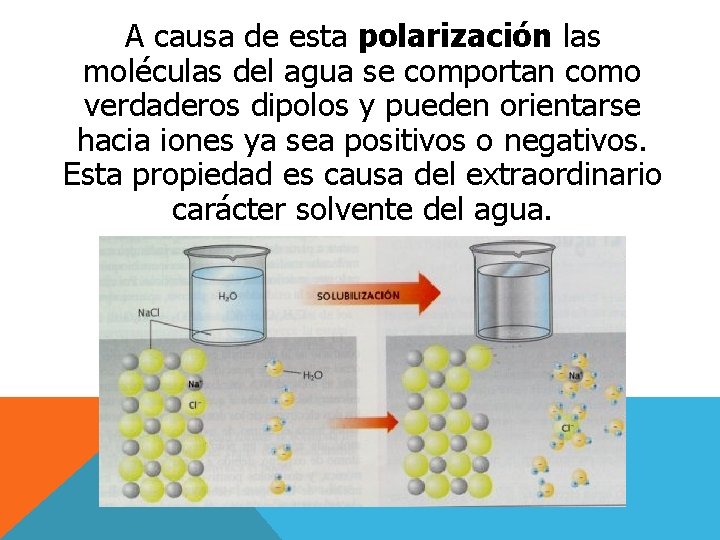
A causa de esta polarización las moléculas del agua se comportan como verdaderos dipolos y pueden orientarse hacia iones ya sea positivos o negativos. Esta propiedad es causa del extraordinario carácter solvente del agua.

SOLUCION Una solución se define como una mezcla íntima y homogénea de dos o más sustancias. Es una fase homogénea que puede ser gaseosa, líquida o sólida y puede contener más de una sustancia sin que cambie su composición.

PARTES QUE LA FORMAN SOLUTO Es el menor componente de una solución, el cual se halla disuelto por el SOLVENTE Es el mayor disolvente. componente de una solución, en el cual se halla disuelto el soluto ó el componente cuyo estado físico se conserva.

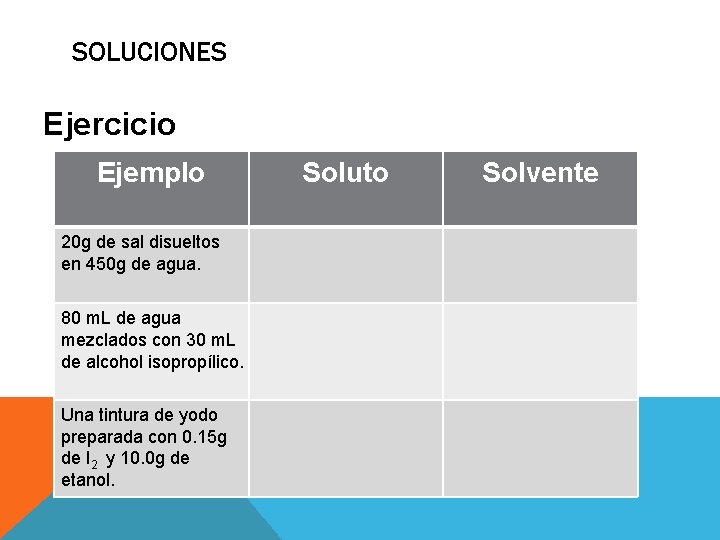
SOLUCIONES Ejercicio Ejemplo 20 g de sal disueltos en 450 g de agua. 80 m. L de agua mezclados con 30 m. L de alcohol isopropílico. Una tintura de yodo preparada con 0. 15 g de I 2 y 10. 0 g de etanol. Soluto Solvente

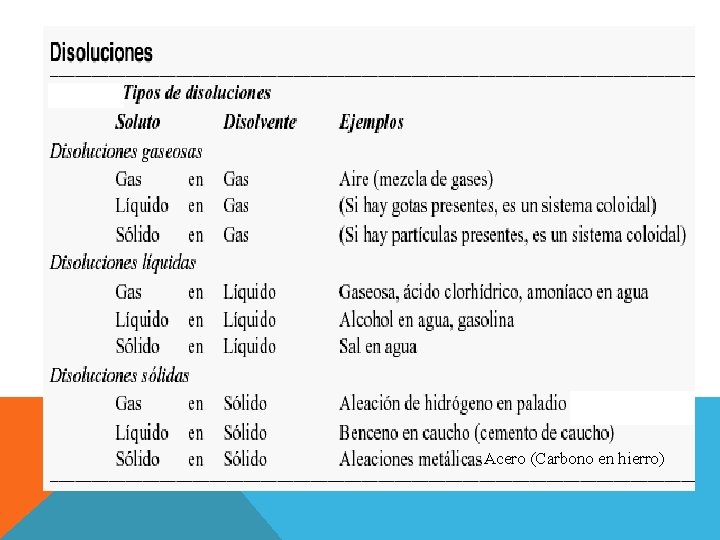
CLASIFICACION POR EL TIPO DE SOLUTO: Los solutos pueden hallarse en forma de: vÁtomos v. Iones v. Moléculas

vÁtomos: Como el cobre y el zinc que forman el latón v. Iones: Como el cloruro de sodio cuando se disuelve en agua, hay iones individuales entre las moléculas de agua o disolvente. v. Moléculas: Como el azúcar de mesa disuelta en agua. Las moléculas se encuentran distribuidas al azar entre las moléculas del disolvente.

POR EL ESTADO FISICO FINAL:

Acero (Carbono en hierro)

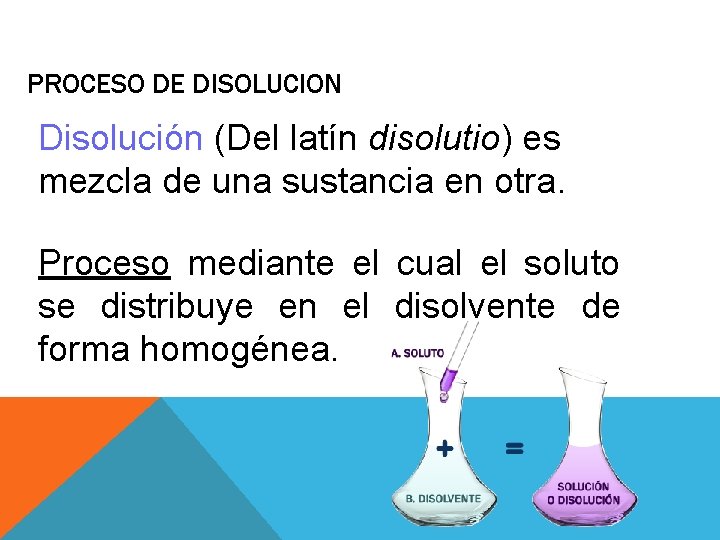
PROCESO DE DISOLUCION Disolución (Del latín disolutio) es mezcla de una sustancia en otra. Proceso mediante el cual el soluto se distribuye en el disolvente de forma homogénea.

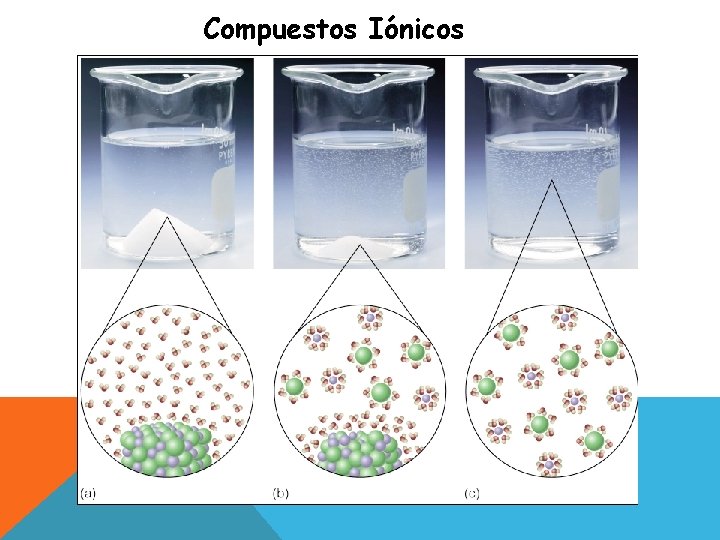
COMPUESTOS IÓNICOS: La solubilidad de un soluto iónico dependerá de : 1. Las fuerzas que mantiene unidos a los iones de la sal, las que se deben vencer. 2. Las fuerzas de atracción que se deben vencer entre al menos algunas de las moléculas de agua. 3. Las moléculas de soluto y de solvente deben atraerse mutuamente e interactuar.

Compuestos Iónicos

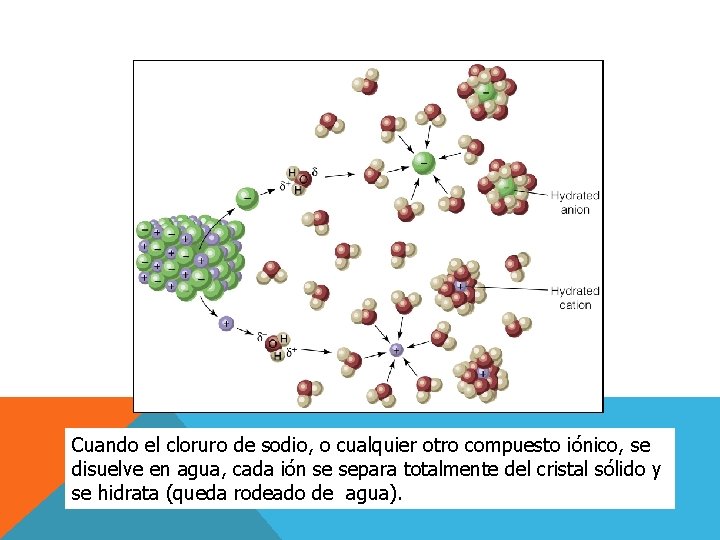
Cuando el cloruro de sodio, o cualquier otro compuesto iónico, se disuelve en agua, cada ión se separa totalmente del cristal sólido y se hidrata (queda rodeado de agua).

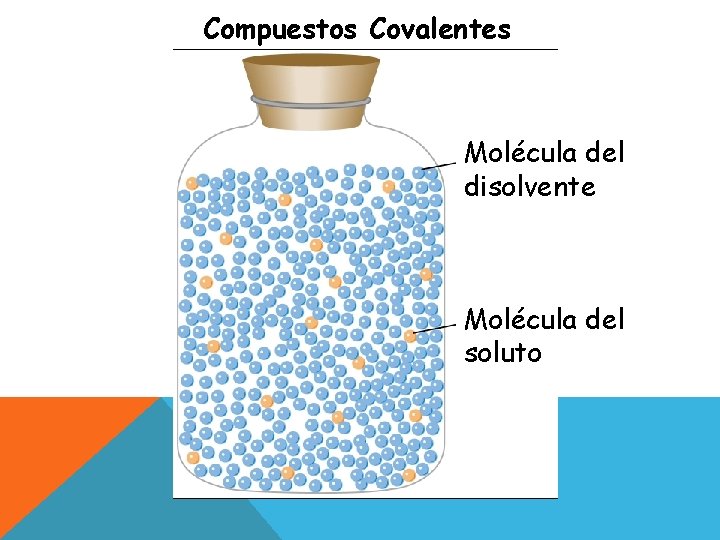
COMPUESTOS COVALENTES “LO SIMILAR DISUELVE A LO SIMILAR” Esto significa que los solutos no polares se disuelven mejor en disolventes no polares. (Tetracloruro de carbono, éter, cloroformo) Y que los solutos muy polares se disuelven mejor en disolventes polares como el agua.

Compuestos Covalentes Molécula del disolvente Molécula del soluto

DISOLUCIONES Ejercicio: En qué solvente es más probable que se sean solubles los siguientes solutos. SOLUTO Na. NO 3 (iónico) Sacarosa (azúcar de mesa) I 2 (no polar) Li. Cl Benceno Aceite vegetal AGUA (polar) Hexano (apolar)

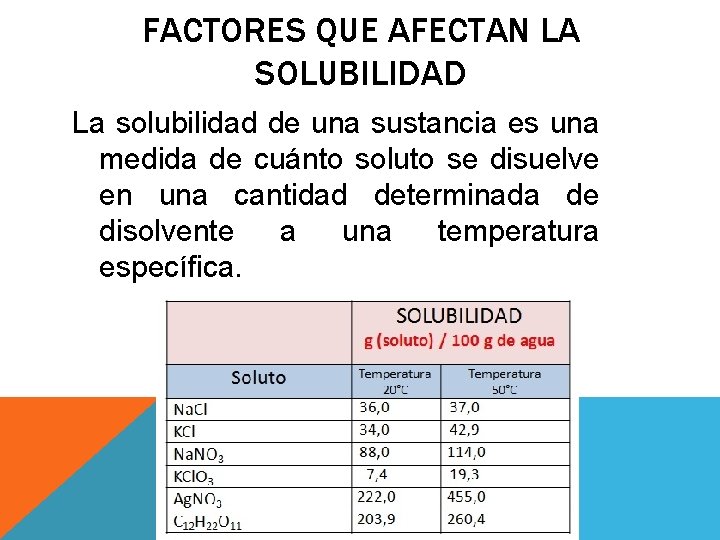
FACTORES QUE AFECTAN LA SOLUBILIDAD La solubilidad de una sustancia es una medida de cuánto soluto se disuelve en una cantidad determinada de disolvente a una temperatura específica.

LOS FACTORES QUE AFECTAN LA SOLUBILIDAD SON: v. Naturaleza de sus componentes v. Presión v. Temperatura vÁrea superficial (tamaño de partícula)

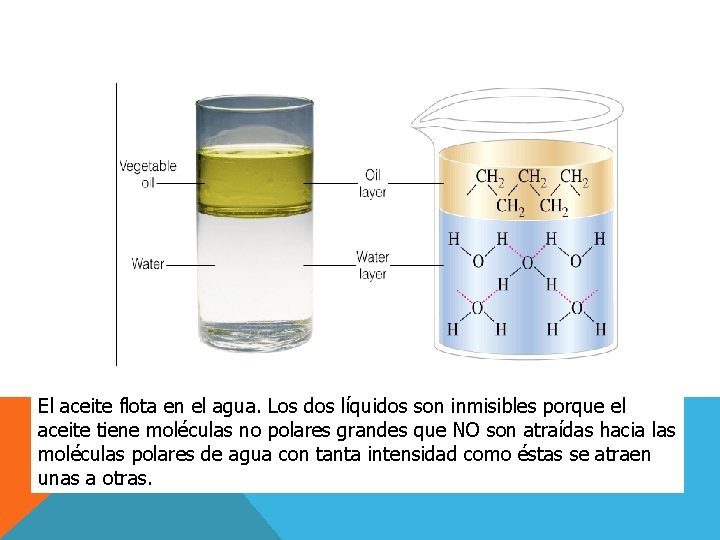
1. NATURALEZA DE LOS COMPONENTES Lo similar disuelve a lo similar. §Los solutos no polares se disuelven en disolventes no polares. §Los solutos muy polares se disuelven en disolventes polares como el agua, por la formación de puentes de hidrógeno.

El aceite flota en el agua. Los dos líquidos son inmisibles porque el aceite tiene moléculas no polares grandes que NO son atraídas hacia las moléculas polares de agua con tanta intensidad como éstas se atraen unas a otras.

2. PRESIÓN Las soluciones que contienen solamente líquidos y sólidos no son afectados por los cambios de presión. Las soluciones de un gas en un líquido si sufren un efecto apreciable: a presiones mayores, se disuelve más gas en una cantidad de agua determinada (Ley de Henry).

3. TEMPERATURA Para soluciones de un gas en un líquido la solubilidad disminuye con la temperatura. Para sólidos disueltos en líquidos a medida que la temperatura aumenta, el movimiento de partículas también se intensifica, por lo que se aumenta el número de partículas que se desprenden y así aumenta la solubilidad.

4. ÁREA SUPERFICIAL Cuanto más pequeñas sean las partículas del soluto más contacto hay entre el soluto y el disolvente con lo que se logra que el disolvente actué más rápido.

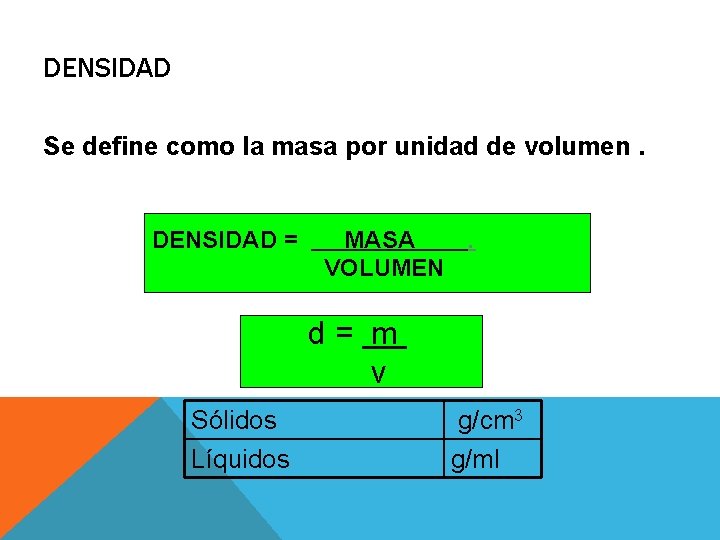
DENSIDAD Se define como la masa por unidad de volumen. DENSIDAD = MASA . VOLUMEN d= m v Sólidos Líquidos g/cm 3 g/ml

EJERCICIOS 1) Cuál es la densidad de una aleación metálica si 680 g tienen un volumen de 128 ml? 2) Un bloque de madera mide 20 cm x 3. 5 cm x 0. 52 cm y su masa es de 1. 53 g. ¿Cuál es la densidad de la madera? 3) La plata tiene una densidad de 10. 5 g/ml. ¿Cuál es la masa de 200 ml de plata? 4) ¿Que volumen de ácido sulfúrico (d= 1. 84 g/ml) se necesitan para un procedimiento que requiere 54 g del ácido. ?
