Semana Nmero 7 2015 El Agua y Soluciones





























- Slides: 33

Semana Número 7 2015 El Agua y Soluciones Diapositivas con imágenes e ilustraciones cortesía de Licda: Lilian Guzmán.

El agua • Principal componente de nuestro planeta cubre casi 71 % de su superficie. • Componente mayoritario en peso de los organismos vivos, entre un 50 %- 90 % 60 % en el adulto, 75 % en el cuerpo del niño, 90 % de las algas, 96 % en los pepinos, 31 % en pan francés.

Características importantes del agua • El agua químicamente pura es un líquido incoloro, insaboro e inodoro ( cualquier color, sabor ú olor que presente, se debe a la presencia de impurezas). • Por su polaridad, es buen solvente para sustancias iónicas y covalentes polares. • Existe en la naturaleza como : sólido ( iceberg, témpanos) líquido ( lagos, rios, mares) gaseoso( geiser, nubes)

Propiedades físicas del agua • • • Estado físico: Sólido, líquido, gaseoso. Características organolépticas: Incolora, insabora, inodora. Densidad : 1 g/cm 3 (1 g/cc ; 1 g/m. L)a 4 0 C Punto de congelación : 00 C Punto de ebullición: 1000 C

Tensión superficial y capilaridad • Tensión superficial: Fuerza de atracción que induce a la superficie de un líquido a contraerse y formar una “gota esférica”. • Capilaridad. Movimiento del agua a través de finos capilares presentes en tejidos vivos. Ej: movimiento de agua desde las raíces a hojas y tallos en árboles.

Funciones en el cuerpo humano • Movilización de nutrientes : absorción, transporte. • Movilización de desechos: a través de riñones por la orina, o bien por tracto digestivo y sudor. • Control de la temperatura corporal: a través de sudoración. • Medio acuosa para reacciones enzimáticas dentro de los organismos.

El agua como solvente • Debido a su polaridad: Disuelve solutos iónicos y covalentes polares. • Por su capacidad de formar puentes de hidrogeno: dispersa moléculas con N, O, H. Ej: proteínas, ácidos nucleícos, aún cuando sean macromoléculas de alto peso molecular.

El agua el “solvente universal” • Debido a su gran abundancia y su compatibilidad con todos los tejidos vivos y su gran capacidad de disolver sustancias, el agua es considerada “El solvente Universal “.

Hidrofilico é Hidrofóbico • Hidrofilico: sustancia que se disuelve en agua ó tiene afinidad por ella, ej: sustancias iónicas (Sal Na. Cl), covalentes polares y sustancias que forman puentes de hidrogeno con el agua( azúcar, proteínas). • Hidrofóbico : Sustancia que no se disuelve ni dispersa en agua : Moléculas covalentes NO polares( aceite, petróleo, ceras)

Mezcla Porción de materia, formada por dos ó más sustancias combinadas en proporciones variables, que no se combinan químicamente entre si ( es decir conservan sus identidades, no hay reacción química entre ellas). Ejemplo: Agua salada, agua azucarada, granito, mármol. Aire, saliva, orina, etc. “Es una combinación física de dos o más sustancias en las que no cambian sus identidades. ” Las mezclas pueden ser: Homogéneas y Heterogéneas.

Mezcla Homogénea “Mezcla de dos o más sustancias que se distribuyen uniformemente” Forma una sola fase( no se identifican a simple vista sus componentes) • Fase: porción de materia que tienen la misma composición y propiedades en todas sus partes. Las mezclas homogéneas se llaman disoluciones ó soluciones, Ejemplo: Aire, Agua de mar, Aleaciones, agua azucarada, sueros masivos parenterales usados en hospitales.

Mezclas Heterogéneas • “Mezcla de dos ó más sustancias que no se distribuyen uniformemente. ” Forman 2 ó más fases, distinguibles entre ellas. • Se da cuando las sustancias tiene polaridades diferentes , no se disuelven ó dispersan entre ellas. También pueden darse en caso de tener pesos moleculares muy grandes o constituyen agregados moleculares de gran tamaño. • Suspensiones: Mezcla de dos o más componentes, en las que las partículas son tan grandes y pesadas que se sedimentan, y pueden quedar retenidas en los filtros y membranas semipermeables; por eso no se distribuyen homogéneamente.

Cont. suspensiones • Las partículas de las suspensiones son tan grandes, que pueden verse a simple vista , no atraviesan filtros ni membranas semipermeables ( Ej: membranas biológicas). • Debido a su gran tamaño, tienen gran peso y sedimentan al dejarse en reposo. • Ejemplo: Horchata, suspensiones antiácidas ( Maalox, Mylanta), antibióticos para niños, lociónes para la piel (calamina). Por eso hay indicación de “agitese antes de usarse”

SOLUBILIDAD • Máxima cantidad de soluto que puede disolverse en 100 g de solvente, a una temperatura dada. • El solvente generalmente es el agua y la temperatura a la que se determinada, es a 20 0 C. Cada sustancia, tiene una solubilidad determinada en el agua. Ej: Na. Cl, 36 g en 100 g de H 2 O, a 20°C.

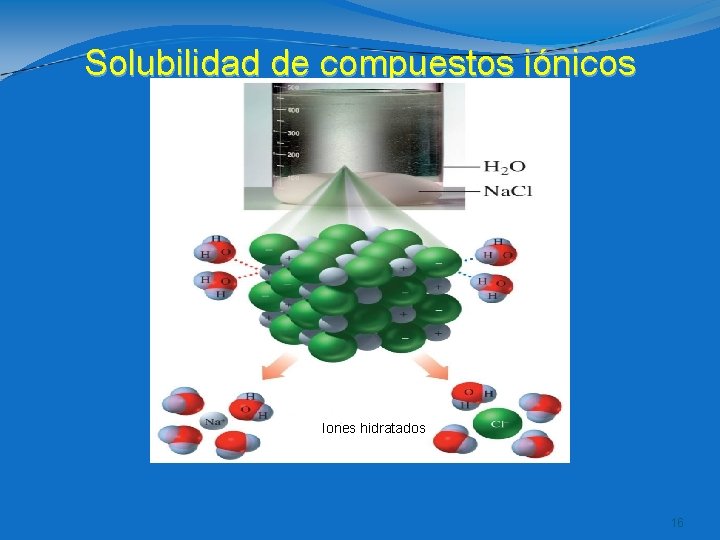
SOLVATACION • Proceso mediante el cual, un soluto es rodeado por moléculas de solvente y lo disuelve( lo integra a la mezcla, de forma homogenea). • Si el solvente es el agua, el proceso recibe el nombre de “Hidratación”. • La región parcialmente negativa del agua rodea la porción positiva del soluto y la región parcialmente positiva del agua rodea la porción negativa del soluto.

Solubilidad de compuestos iónicos Iones hidratados 16

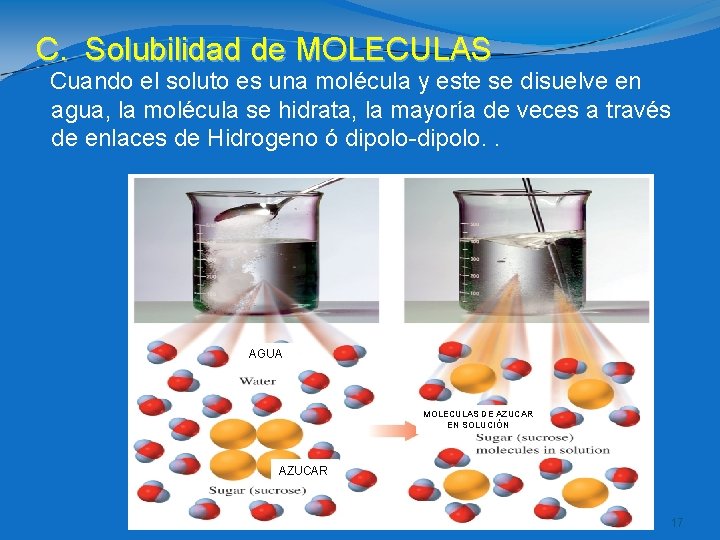
C. Solubilidad de MOLECULAS Cuando el soluto es una molécula y este se disuelve en agua, la molécula se hidrata, la mayoría de veces a través de enlaces de Hidrogeno ó dipolo-dipolo. . AGUA MOLECULAS DE AZUCAR EN SOLUCIÓN AZUCAR 17

Factores que afectan la solubilidad TEMPERATURA: A- Solutos sólidos : En la mayoría al aumentar la temperatura, aumenta la solubilidad. «A mayor temperatura, mayor la solubilidad» B- Solutos gases : Al aumentar la temperatura, disminuye la solubilidad de los gases disueltos.

Solubilidad (gsoluto/100 g de H 2 O) Efecto de la Temperatura en la solubilidad de algunas sustancias Temperatura (∧C) 19

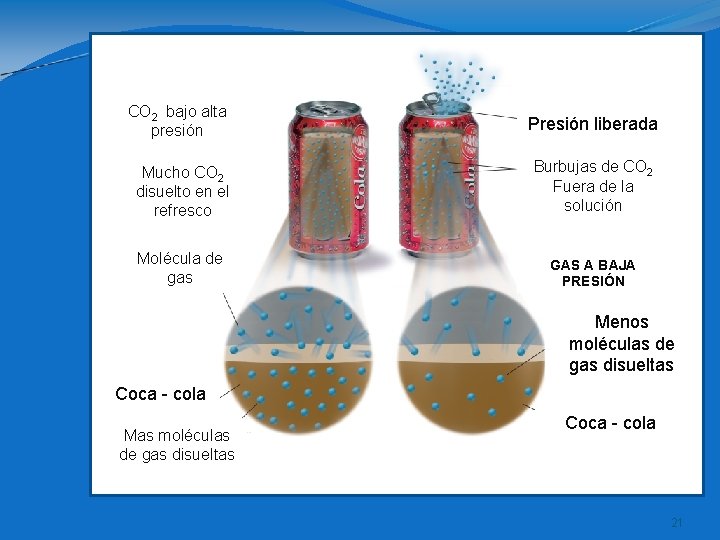
Factores que afectan la solubilidad 2 -PRESION Aplicable a solutos gaseosos. El comportamiento de éstos lo explica la ley de Henry : ” La solubilidad de un gas en un líquido se relaciona directamente, a la presión de dicho gas sobre el líquido”. A mayor presión, mayor solubilidad.

CO 2 bajo alta presión Presión liberada Mucho CO 2 disuelto en el refresco Burbujas de CO 2 Fuera de la solución Molécula de gas GAS A BAJA PRESIÓN Menos moléculas de gas disueltas Coca - cola Mas moléculas de gas disueltas Coca - cola 21

Factores que afectan solubilidad……. 3 - Naturaleza del soluto y el solvente. “igual disuelve igual” Solutos polares, se disuelven en solventes polares. Ejemplos. Azúcar en agua, Sal en agua Solutos no polares, se disuelven en solventes no polares. Ejemplos Aceite en gasolina, pinturas de aceite en thiner ó en aguarrás.

Factores que afectan la solubilidad 4 -Area Superficial : Afecta especialmente la velocidad de solubilidad. ( tamaño de la partícula). A mayor área superficial ( menor tamaño de la partícula), se disuelve más rápido. Ejemplo: Un terrón de azúcar se disuelve más lentamente que el azúcar granular.

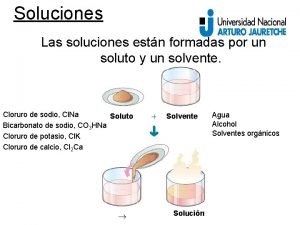
Soluciones • Mezclas homogéneas de dos ó más componentes. • Se hallan formados por: A-SOLUTO : se halla en menor cantidad. B-SOLVENTE: se halla en mayor cantidad, y es el que «solvata» , o sea rodea ó integra al soluto, formando la mezcla homogénea.

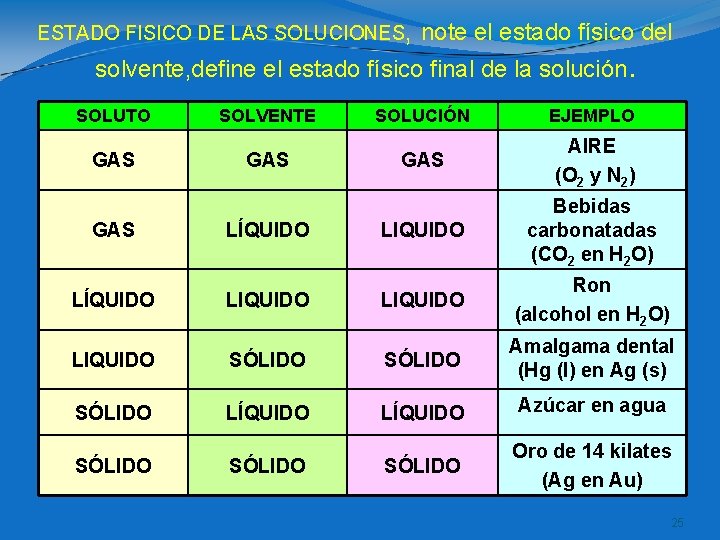
ESTADO FISICO DE LAS SOLUCIONES, note el estado físico del solvente, define el estado físico final de la solución. SOLUTO SOLVENTE SOLUCIÓN EJEMPLO GAS GAS AIRE (O 2 y N 2) GAS LÍQUIDO LIQUIDO Bebidas carbonatadas (CO 2 en H 2 O) LÍQUIDO LIQUIDO Ron (alcohol en H 2 O) LIQUIDO SÓLIDO Amalgama dental (Hg (l) en Ag (s) SÓLIDO LÍQUIDO Azúcar en agua SÓLIDO Oro de 14 kilates (Ag en Au) SÓLIDO 25

Densidad de soluciones Densidad de una solución = masa / volumen. La densidad de soluciones sólidas y líquidas, se expresan en : g/ cc ; g/ cm 3 ; g/ m. L La densidad de soluciones gaseosas : g / L Densidad de la orina : 1. 003 -1. 030 g/m. L Densidad del plasma : 1. 03 g/m. L Lea y comente la nota sobre densidad ósea, de la sección la Química en la salud, pág: 37.

Ejemplo, problemas de densidad 1 -Calcule la densidad de un aceite si 280 m. L de éste pesan 244. 5 g. d = m/v d= 244. 5 g / 280 m. L d= 0. 8732 g/m. L 2 - Que volumen ocuparan 850 g de una solución que posee una densidad 1. 34 g /cm 3. ? d = m / v, despejar v v = m/ d v= 850 g / 1. 34 g /cm 3 = 634. 33 cm 3 3 -Resuelva el sig. Problema : La orina de un enfermo renal tiene un valor de 1. 045 g /m. L. Se colectó 2, 200 g de orina a que volumen corresponde. ?

Definición de soluciones en base a la cantidad de soluto disuelto En relación a la definición de solubilidad de cada sustancia: A- Saturada b-Sobresaturada c- Insaturada En forma relativa por la cantidad estimada de soluto disuelto: A- Diluido B- Concentrado

Solución saturada Solución que contiene la máxima cantidad de soluto que se puede disolver a una temperatura dada ( 20 0 C). Ej : Una solución que contenga 36 g de Na. Cl en 100 g de H 2 O, debido a que ese valor corresponde a la solubilidad del Na. Cl.

Solución Insaturada y sobresaturada. Insaturada ó subsaturada: Contiene menos soluto que una solución saturada. Ej : menos de 36 g de Na. Cl en 100 g de agua Sobresaturada: posee más soluto disuelto a cierta temperatura que una solución saturada. Ej: más de 36 g de Na. Cl en 100 g de agua

Solución diluida y concentrada. • Diluida: Solución que contiene comparativamente una cantidad pequeña de solvente. • Concentrada: solución que contiene comparativamente una cantidad relativamente grande de soluto.

Equivalencia m. L, cm 3, cc Nota: preferencia a sólidos. En la práctica , medica cuando se administran medicamentos que son mezclas cuyo solvente o medio dispersante es el agua, se usa indistintamente cc = cm 3 = m. L. Aunque en concepto existan diferencias.

Ejercicios del libro Prob. 1. 63 inciso a pág. 39 (Respuesta Prob. 1. 65 inciso a ( pag 39 y resp pág 46 ) pag 46 )
 Como calcular pi
Como calcular pi Detesto a la gente que devuelve los libros subrayados
Detesto a la gente que devuelve los libros subrayados Soluciones quimicas
Soluciones quimicas Spray para el cabello coloide suspension o solucion
Spray para el cabello coloide suspension o solucion Sirh nuevo ingreso
Sirh nuevo ingreso Soluciones de cable instalaciones frigorificas
Soluciones de cable instalaciones frigorificas Hipokalemia clasificacion
Hipokalemia clasificacion Soluciones hipertonicas
Soluciones hipertonicas Soluciones
Soluciones Formula molaridad
Formula molaridad Ejemplos de reparación adaptación y mejora
Ejemplos de reparación adaptación y mejora Soluciones teologicas
Soluciones teologicas Problemas de software y soluciones
Problemas de software y soluciones Solucion
Solucion Solubilit
Solubilit Osmolaridad
Osmolaridad Propiedades constitutivas
Propiedades constitutivas Unidades de medida de longitud pequeñas
Unidades de medida de longitud pequeñas Soluciones para la pobreza
Soluciones para la pobreza Propiedades coligativas formula
Propiedades coligativas formula Soluciones
Soluciones Tipos de mezclas quimicas
Tipos de mezclas quimicas Propiedades coligativas de soluciones electroliticas
Propiedades coligativas de soluciones electroliticas Ejercicios de m/m
Ejercicios de m/m Solucion solida sustitucional y intersticial
Solucion solida sustitucional y intersticial Soluciones personalizadas de crm
Soluciones personalizadas de crm Agua de vidrio
Agua de vidrio Soluciones gaseosas
Soluciones gaseosas Gmv soluciones globales internet
Gmv soluciones globales internet Soluciones acidas
Soluciones acidas Generar y elegir soluciones
Generar y elegir soluciones Soluciones carvac
Soluciones carvac Ionolyte vs plasmalyte
Ionolyte vs plasmalyte Ampolla tensa
Ampolla tensa