SEMANA No 7 AGUA Y SOLUCIONES El agua




























- Slides: 34

SEMANA No. 7 AGUA Y SOLUCIONES

El agua es el compuesto químico más abundante en nuestro planeta.

El agua presenta los tres estados de agregación de la materia: líquido, sólido y gaseoso. Pura es inodora, incolora e insípida. Cualquier cambio en éstas propiedades se debe a las impurezas que están disueltas en ella.

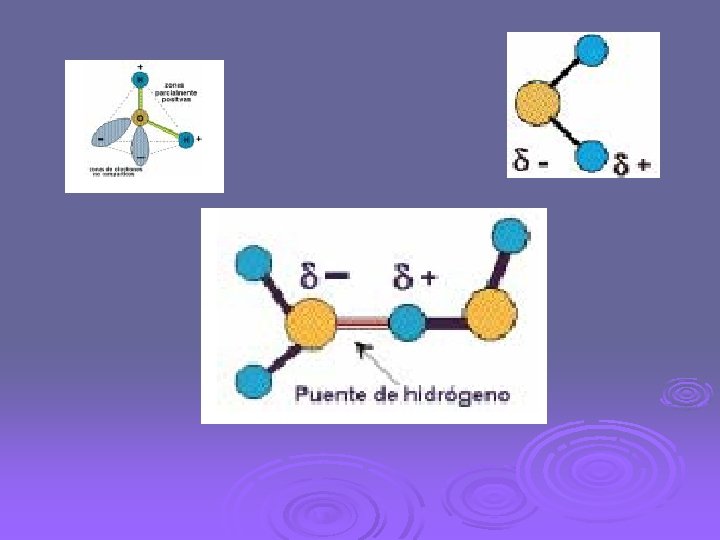
La molécula del agua está fuertemente polarizada debido a la electronegatividad del átomo de oxígeno, el cual tiende a atraer electrones de los átomos de hidrógeno, produciendo una carga electropositiva alrededor del protón.



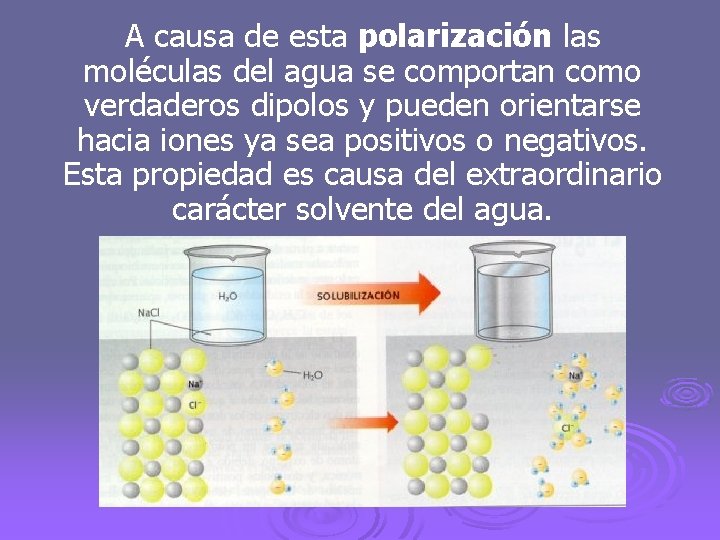
A causa de esta polarización las moléculas del agua se comportan como verdaderos dipolos y pueden orientarse hacia iones ya sea positivos o negativos. Esta propiedad es causa del extraordinario carácter solvente del agua.

EL agua se considera el solvente unirversal por: • Su abundancia en nuestro planeta. • Se encuentra disponible en todo ambiente y es barato. • Es compatible con los tejidos corporales por lo tanto es útil para administrar medicamentos.

SOLUCIONES Solución: mezcla homogénea de dos o más sustancias. Éstas sustancias pueden ser: átomos, moléculas, iones ó mixtas.

Características: • Forman una sola fase. • Cuando son líquidas o gaseosas, son transparentes dejando pasar la luz. • Las partículas disueltas tienen los siguientes tamaños: 0. 1 -1 nm

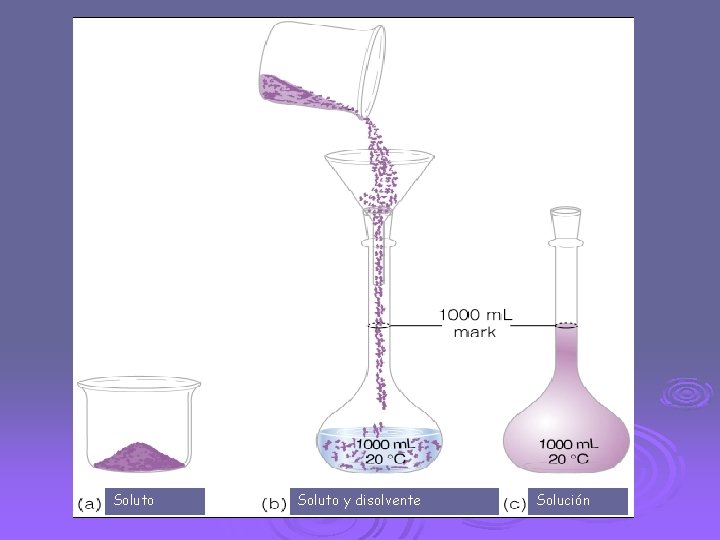
PARTES DE UNA SOLUCIÓN SOLUTO Y SOLVENTE. SOLUTO: Es el menor componente de una solución, el cual se encuentra disuelto por el disolvente. DISOLVENTE O SOLVENTE: Es el mayor componente de una solución, el componente cuyo estado físico se conserva.

Soluto y disolvente Solución

Disolución: (Del latín disolutio) mezcla de una sustancia en otra. Proceso de disolución: proceso mediante el cuál el soluto se distribuye en el solvente de forma homogénea

Solvatación: proceso por el cuál el solvente rodea a las partículas de soluto y las integra en la mezcla. Si el solvente es el agua, al proceso se le llama HIDRATACIÓN.

TIPOS DE SOLUCIONES: 1. Por la naturaleza de los componentes: a. Atomica: (aleaciones o amalgamas) Como el cobre y el zinc que forman el latón.

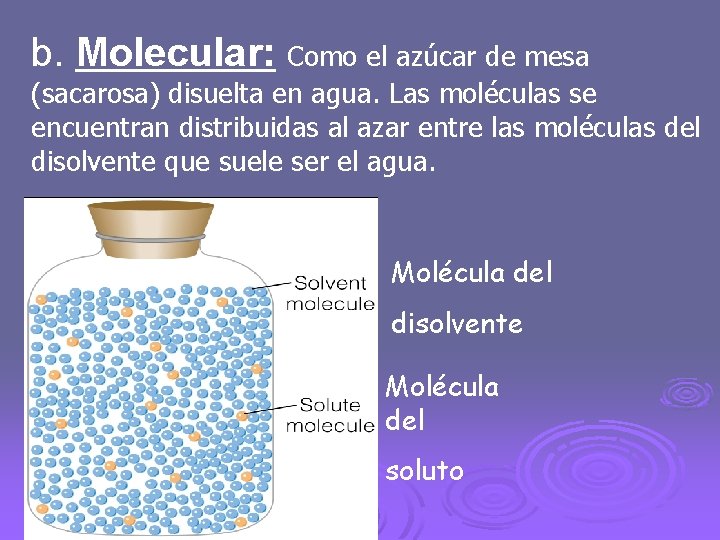
b. Molecular: Como el azúcar de mesa (sacarosa) disuelta en agua. Las moléculas se encuentran distribuidas al azar entre las moléculas del disolvente que suele ser el agua. Molécula del disolvente Molécula del soluto

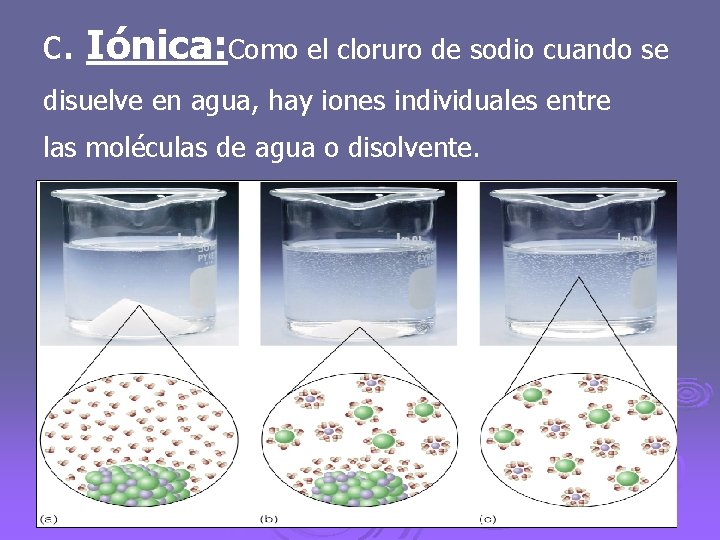
c. Iónica: Como el cloruro de sodio cuando se disuelve en agua, hay iones individuales entre las moléculas de agua o disolvente.

2. Por el estado físico final a. gaseosa: gas-gas (aire) b. líquida gas-líquido (agua mineral) líquido-líquido (alcohol 70%) sólido-líquido (agua salada)

c. Sólida: sólido-sólido (aleaciones) líquido-sólido (amalgamas)

POR ESTADO FÍSICO HAY DIFERENTES TIPOS DE DISOLUCIONES

Acero (Carbono en hierro)

FACTORES QUE AFECTAN LA SOLUBILIDAD La solubilidad de una sustancia es una medida de cuánto soluto se disuelve en una cantidad determinada de disolvente a una temperatura específica. Los factores que afectan la solubilidad son: v. Naturaleza de sus componentes v. Presión v. Temperatura vÁrea superficial (tamaño de partícula)

v. Naturaleza de sus componentes: v Compuestos Iónicos o Covalentes. Lo similar disuelve a lo similar. Los solutos no polares o muy poco polares se disuelven mejor en disolventes no polares, y los solutos muy polares se disuelven mejor en disolventes polares como el agua. Sin embargo para solutos moleculares polares la formación de puentes de hidrógeno es más importante que la polaridad para determinar su solubilidad en agua.

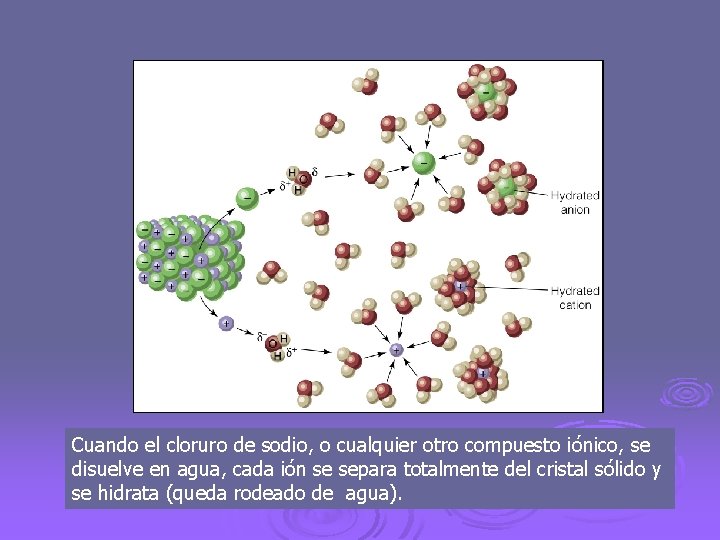
Cuando el cloruro de sodio, o cualquier otro compuesto iónico, se disuelve en agua, cada ión se separa totalmente del cristal sólido y se hidrata (queda rodeado de agua).

El aceite flota en el agua. Los dos líquidos son inmisibles porque el aceite tiene moléculas no polares grandes que NO son atraídas hacia las moléculas polares de agua con tanta intensidad como éstas se atraen unas a otras.

v. Presión: Se aplica solamente para los gases. A presiones mayores, se disuelve más gas en una cantidad de agua determinada. v. Temperatura: A medida que la temperatura aumenta, el movimiento de partículas también se intensifica, aumenta el número de partículas que se desprenden. El soluto se disuelve porque el solvente rompe las uniones entre sus moléculas. Al aumentar la temperatura, se está ayudando al solvente en la ruptura de los enlaces.

Area Superficial o tamaño de partícula: Cuanto mas pequeñas sean las partículas de soluto, mas contacto hay entre el soluto y el disolvente, por lo tanto: entre mas pequeñas sean las partículas del soluto antes se disolverán.

FORMAS DE EXPRESAR LA CONCENTRACION DE LAS SOLUCIONES: UNIDADES RELATIVAS: Insaturada o no saturada: Cuando un solución contiene menos soluto que el límite de solubilidad. Saturada: Cuando una solución a una temperatura determinada existe en equilibrio dinámico con el soluto sin disolver.

Sobresaturada: Cuando una solución posee exceso de soluto respecto a la cantidad que podría contener si estuviese en equilibrio. Concentrada: Una solución concentrada es aquella que contiene una cantidad relativamente grande de soluto. Diluida: Una solución diluida contiene una cantidad relativamente pequeña de soluto.

IMPORTANCIA BIOLÓGICA DE LAS SOLUCIONES: • Nuestro organismo es un entorno acuoso (líquido cefaloraquídeo) • Se nos administran soluciones como medicamentos: inyecciones intravenosas, parenterales masivas, jarabes. • Respiramos aire.

El agua es uno de los más importantes constituyentes del organismo y a la vez el medio en que viven muchos animales y plantas. Efectivamente, la vida es imposible sin agua. La función principal del agua es servir como disolvente de las sustancias inorgánicas y actuar, por tanto, como medio de transporte de célula a célula y dentro de las células.

En muchos organismos la cantidad de agua presente supera a la de cualquier otro constituyente, pues llega a ser frecuentemente el 70 ó el 80% del peso total.

DENSIDAD Relación entre la masa de un objeto y el volumen del mismo. Densidad de sólidos y líquidos: D = m / v = g/cc (ml) Densidad de gases: D= g/L

 Osmolaridad
Osmolaridad انواع المحاليل
انواع المحاليل Propiedades coligativas
Propiedades coligativas Ejercicios áreas y perímetros 6 primaria con soluciones
Ejercicios áreas y perímetros 6 primaria con soluciones Soluciones para la pobreza
Soluciones para la pobreza Formula de las propiedades coligativas
Formula de las propiedades coligativas Concentracion soluciones
Concentracion soluciones Mezclas homogeneas soluciones
Mezclas homogeneas soluciones Propiedades coligativas de soluciones electroliticas
Propiedades coligativas de soluciones electroliticas Solucion solida sustitucional y intersticial
Solucion solida sustitucional y intersticial Soluciones personalizadas de crm
Soluciones personalizadas de crm Escribe 4 ejemplos de soluciones líquidas
Escribe 4 ejemplos de soluciones líquidas Soluciones gaseosas
Soluciones gaseosas Gmv soluciones globales internet
Gmv soluciones globales internet Tabla de ácidos y bases fuertes y débiles
Tabla de ácidos y bases fuertes y débiles Generar y elegir soluciones
Generar y elegir soluciones Soluciones carvac
Soluciones carvac Cristaloides y coloides diferencias
Cristaloides y coloides diferencias Polanol
Polanol Objetivo del transporte celular
Objetivo del transporte celular Solucion
Solucion Noradrenalina dosis infusion
Noradrenalina dosis infusion Soluciones quimicas
Soluciones quimicas Propiedades de las soluciones
Propiedades de las soluciones L
L Dot solucion
Dot solucion Cuadro comparativo de mezcla y compuesto
Cuadro comparativo de mezcla y compuesto Definición de solución diluida
Definición de solución diluida Suspensión ejemplos
Suspensión ejemplos Formula molecular
Formula molecular Terramicina presentaciones
Terramicina presentaciones Edo
Edo Tabla comparativa de disoluciones coloides y suspensiones
Tabla comparativa de disoluciones coloides y suspensiones Propiedades de las soluciones amortiguadoras
Propiedades de las soluciones amortiguadoras Rerum novarum resumen
Rerum novarum resumen