Pojem prvku alchymie Paracelsus 16 st alchymie teorie

























- Slides: 46


Pojem prvku alchymie Paracelsus (16. st)

alchymie …. teorie flogistonu 17. -18. st při hoření látky ztrácí těkavou součást - flogiston. látky = flogiston + popel (. . . nesouhlasila hmotnost) chemie kvantitativní záznamy postupů pojem čistá látka ‘přesné’ vážení Lavoisier: (1743– 1794) … zdokonalení střelného prachu … hmota (určená hmotností) zůstává zachována v průběhu reakcí. proces hoření, dýchání … 33 ‘prvků’, mj. caloric (teplo) voda = HO

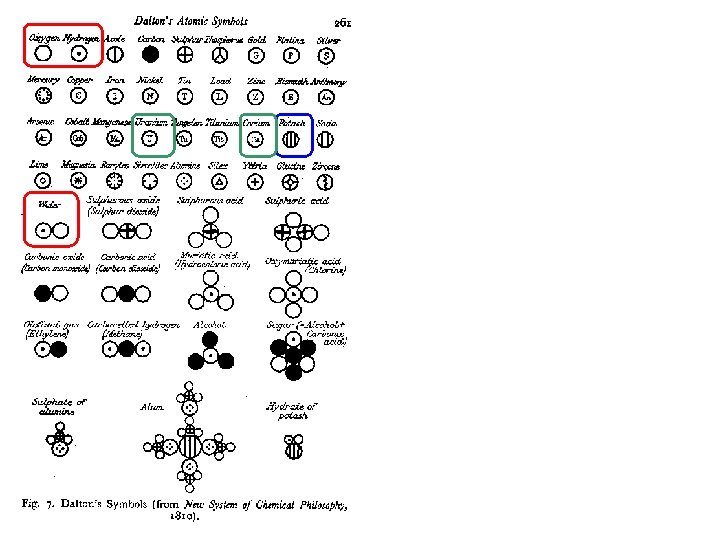
John Dalton (1766 -1844) … meteorologie … chemie: pojem prvku a sloučeniny: prvek - nedá se již rozložit na jiné prvky, sloučenina - rozložitelné C a O 2 sloučeniny, MO : MC = (1. 33: 1 nebo 2. 66: 1) CO, CO 2 zákony o stálých a množných poměrech slučovacích Atomová teorie: všechny prvky sestávají z malých částeček - atomů, ty jsou nedělitelné a neměnné všechny atomy daného prvku jsou stejné (stejná hmotnost) různé atomy různé hmotnosti (atomová váha) konečnýsoubor prvků (char. hmotnost) sloučenina = kombinace atomů více prvků (pevné poměry, případně násobné) chem. reakce = přeskupení kombinací atomů


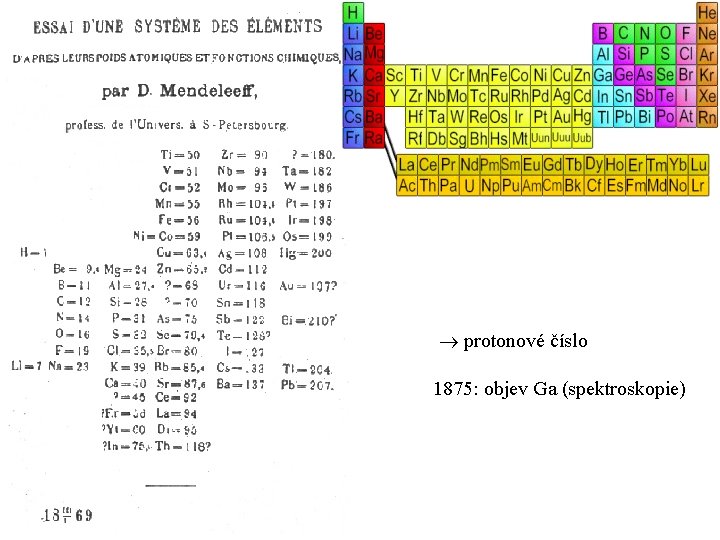
pojem prvku a optická spektroskopie vlastnosti prvků: - vážení (. . . Lavoisier, Dalton, . . . ) atomová váha (rel. at. hmotnost) - chemické chování tvorba sloučenin, oxidů, hydridů ~ 1860. . . molekula vs prvek, kvantitativní popis 1869: Mendeleev - periodická tabulka

protonové číslo 1875: objev Ga (spektroskopie)

kahan. . zbarvení plynu. . . atomová spektroskopie 1852 - Heidelberg objev Cs, Rb (1860)


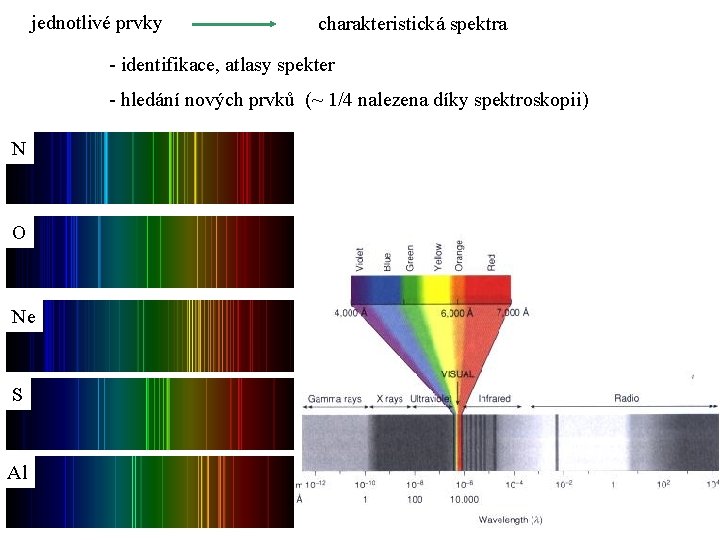
jednotlivé prvky charakteristická spektra - identifikace, atlasy spekter - hledání nových prvků (~ 1/4 nalezena díky spektroskopii) N O Ne S Al

sluneční spektrum

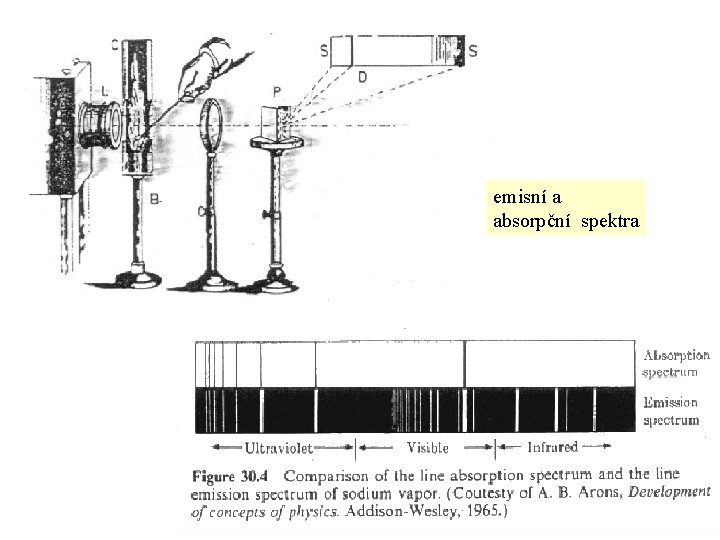
emisní a absorpční spektra

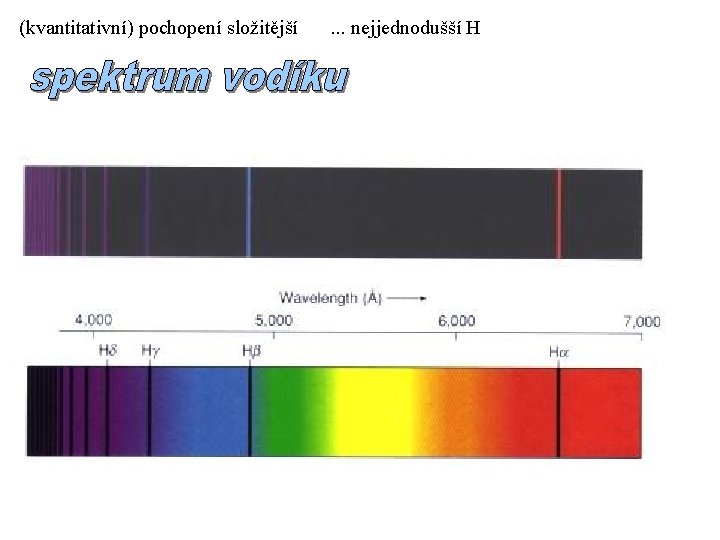
(kvantitativní) pochopení složitější . . . nejjednodušší H

empirický popis vodíkového spektra: viditelný obor: 4 čáry H H H H n = 3, 4, 5, 6, . . . 1885: Balmerova série: objeveny další série 1906: Lymanova série: n = 2, 3, 4, . . . Ritz-Rydberg kombinačí princip: (1878 -1909) term: 1908: Paschenova série: . . . a další m = 4, 5, 6, . . . (IČ oblast)


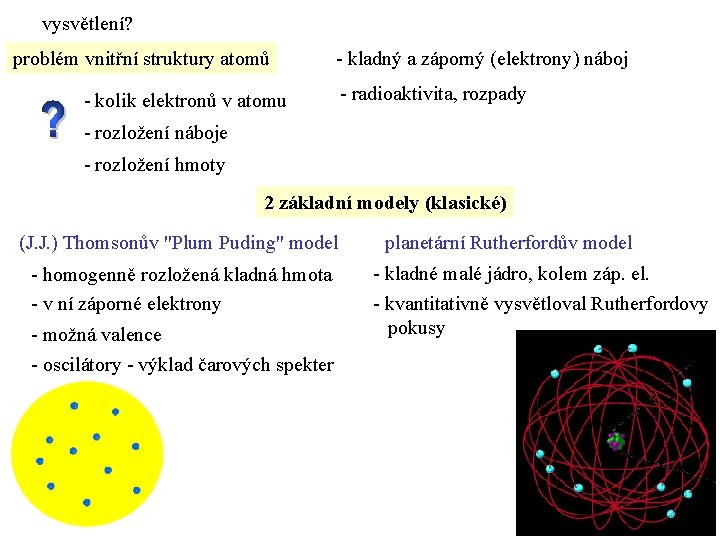
vysvětlení? problém vnitřní struktury atomů - kladný a záporný (elektrony) náboj - kolik elektronů v atomu - radioaktivita, rozpady - rozložení náboje - rozložení hmoty 2 základní modely (klasické) (J. J. ) Thomsonův "Plum Puding" model - homogenně rozložená kladná hmota - v ní záporné elektrony - možná valence - oscilátory - výklad čarových spekter planetární Rutherfordův model - kladné malé jádro, kolem záp. el. - kvantitativně vysvětloval Rutherfordovy pokusy

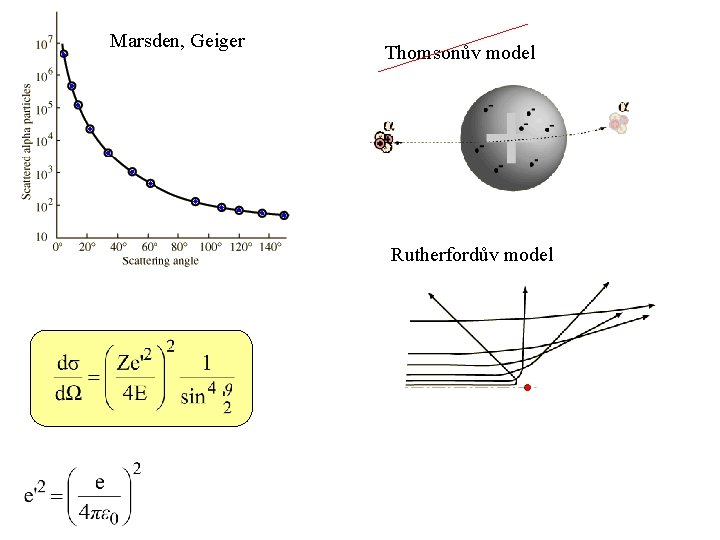
N. c. za chemii 1908 (Geiger, Marsden, 1910 -1911) Ernest Rutherford (1871 -1937) stínění Au -zářič (m = 4 u, Q=2 e) E ~ 7. 7 Me. V fluorescence

Marsden, Geiger Thomsonův model Rutherfordův model

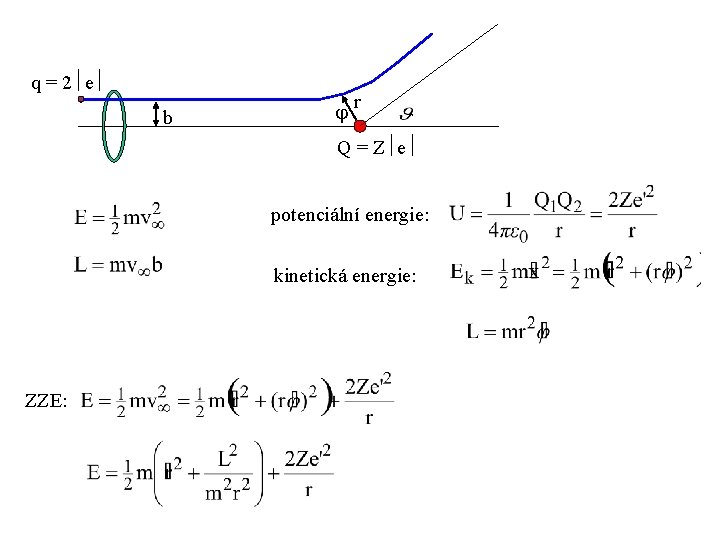
q = 2 e b r Q = Z e potenciální energie: kinetická energie: ZZE:

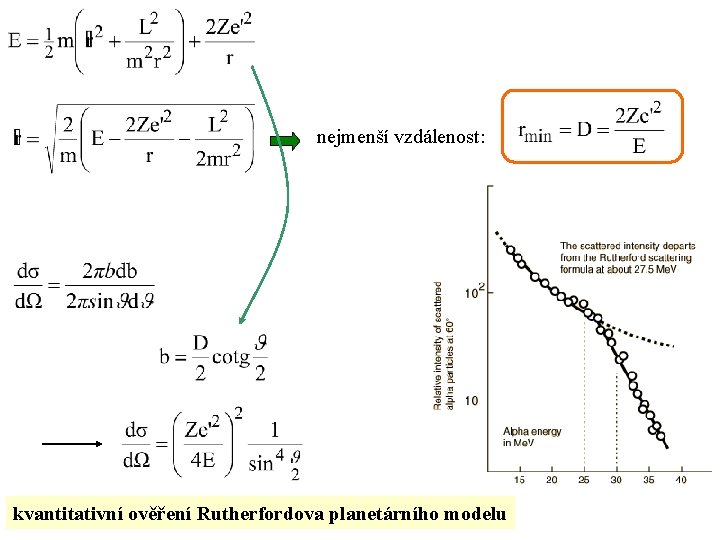
nejmenší vzdálenost: kvantitativní ověření Rutherfordova planetárního modelu

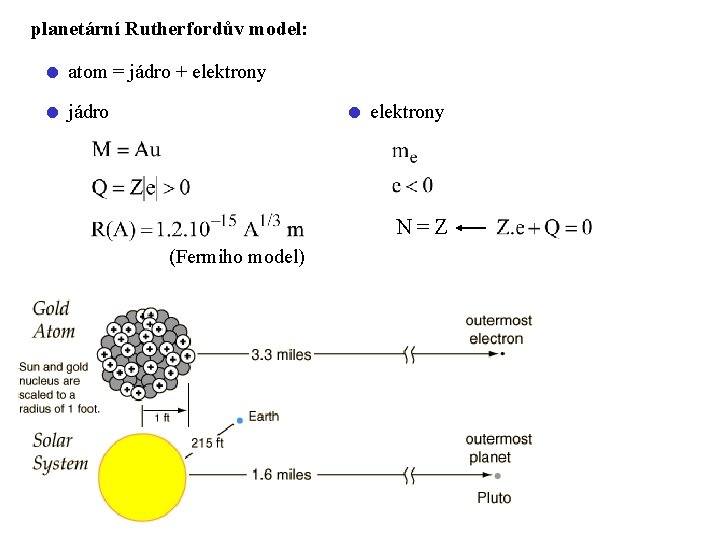
planetární Rutherfordův model: atom = jádro + elektrony jádro elektrony N=Z (Fermiho model)

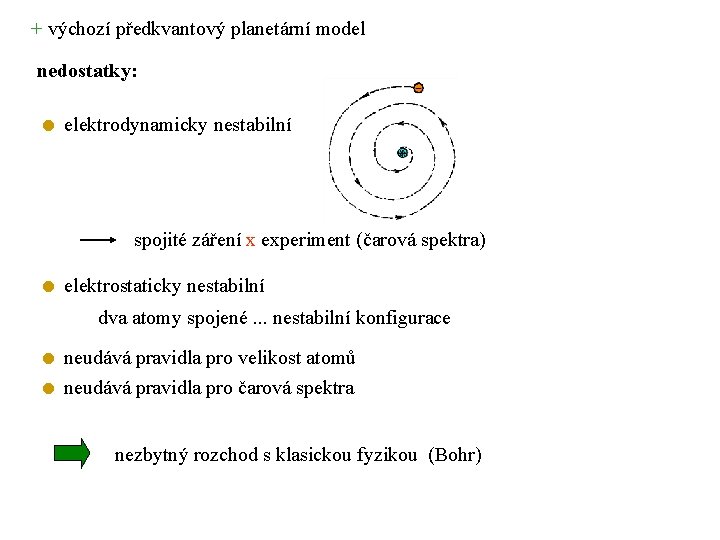
+ výchozí předkvantový planetární model nedostatky: elektrodynamicky nestabilní spojité záření x experiment (čarová spektra) elektrostaticky nestabilní dva atomy spojené. . . nestabilní konfigurace neudává pravidla pro velikost atomů neudává pravidla pro čarová spektra nezbytný rozchod s klasickou fyzikou (Bohr)

1) Elektrony krouží kolem jader po kruhových drahách. 2) Přípustné jsou jen vybrané stacionární orbity - na nich elektron obíhá a nezáří. 3) Stacionární orbity vybereme kvantováním momentu hybnosti: 4) Elektrony mohou přeskakovat mezi jednotlivými orbity; přeskoky jsou spojeny s vyzářením nebo pohlcením fotonu. Niels Bohr (1885 -1962) Aage Niels Bohr (*1922)

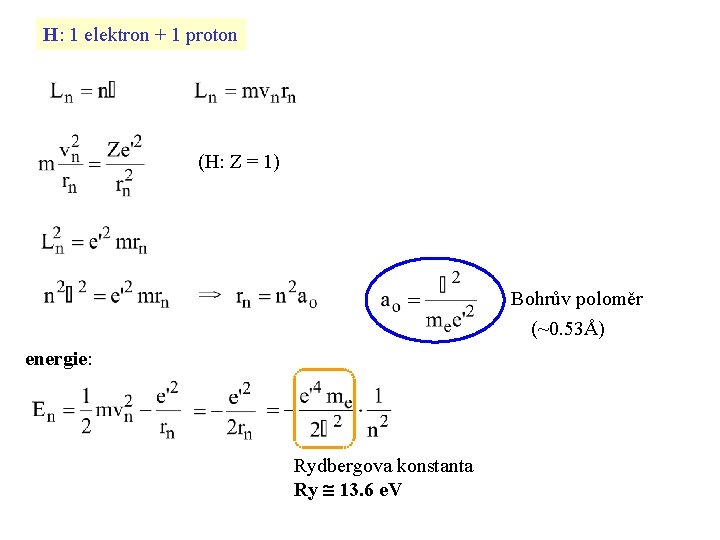
H: 1 elektron + 1 proton (H: Z = 1) Bohrův poloměr (~0. 53Å) energie: Rydbergova konstanta Ry 13. 6 e. V

rychlost: H: = ~ 1/137 (konstanta jemné struktury) přeskoky: limita série H H H série čar: od do (Å) H

K L M N O

(H: ~ Ry/1. 0005) Harold Clayton Urey (1893 - 1981) 1934: N. c. za chemii

komentář k Bohrovu modelu: - kvaziklasické přiblížení - přenesl ħ na hmotné soustavy (předtím pro popis fotonů) - inspirace pro Heisenberga a kvantový popis atomů (kvantový popis H: stejný výsledek jako Bohr) - neudává pravděpodobnosti přechodů – proč nějaká spektrální čára silnější než jiná? - elektron jako malá planeta s danou polohou a hybností x relace neurčitosti - nepodařilo se zobecnění na víceelektronové atomy (problém e-e interakce) nutný úplný kvantový popis

Bohr Schrödinger klasické orbity stacionární orbity kvantování L přeskoky centrálně sym. problém mohu separovat proměnné Zlaté pravidlo poruchového počtu

kvantové řešení úlohy vodíku (shrnutí):

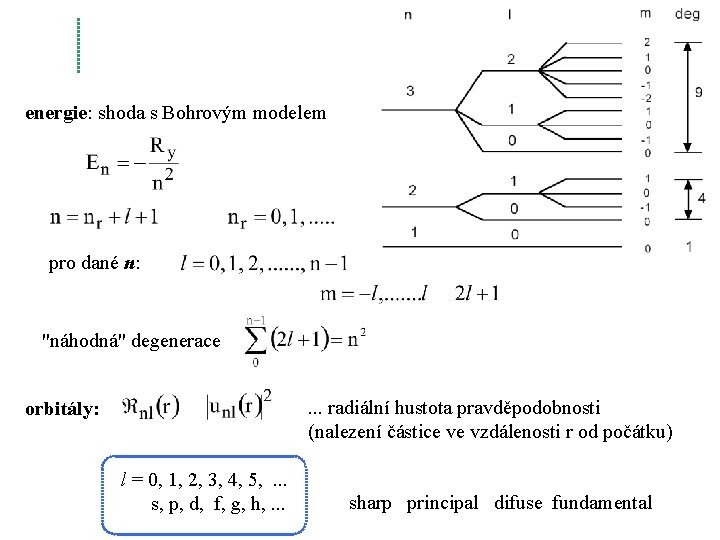
energie: shoda s Bohrovým modelem pro dané n: "náhodná" degenerace. . . radiální hustota pravděpodobnosti (nalezení částice ve vzdálenosti r od počátku) orbitály: l = 0, 1, 2, 3, 4, 5, . . . s, p, d, f, g, h, . . . sharp principal difuse fundamental


zachycení elektronu (electron capture, K-záchyt)

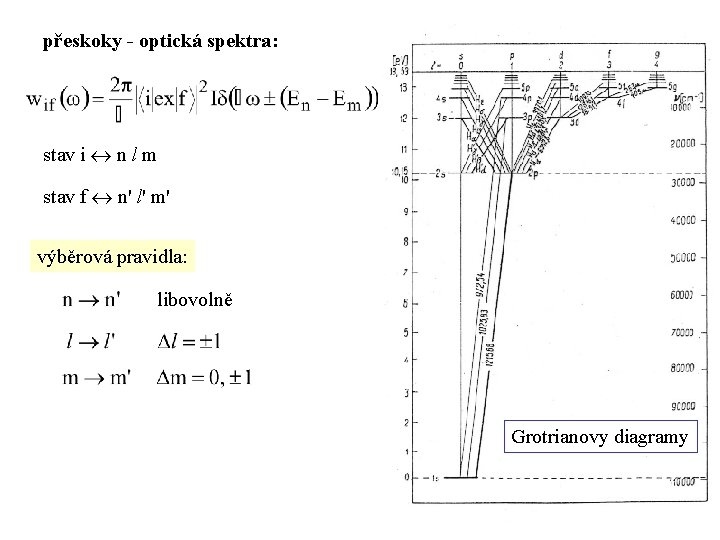
přeskoky - optická spektra: stav i n l m stav f n' l' m' výběrová pravidla: libovolně Grotrianovy diagramy

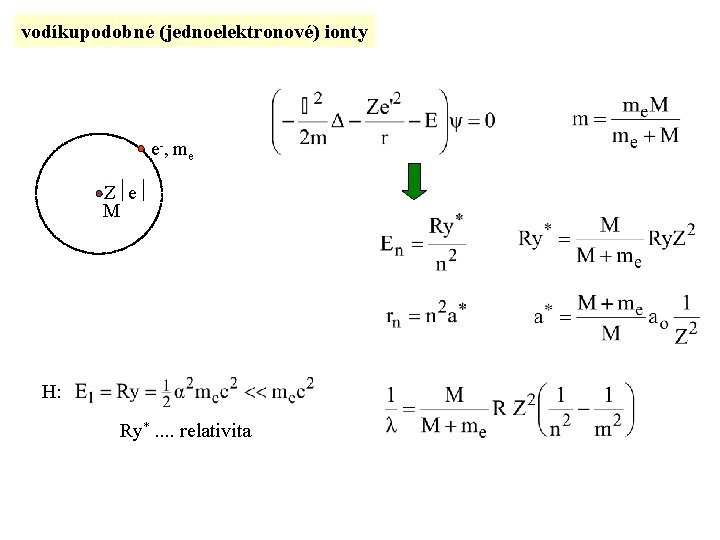
vodíkupodobné (jednoelektronové) ionty e-, me Z e M H: Ry*. . relativita

Henry Moseley (1887 -1915) měření vlnové délky rtg záření pro různé prvky K M L K L úměra atomovému číslu Z (uspořádání v periodické tabulce) cislo = 1 (K-čáry) = 7. 5 (L-čáry) předpoěď prvků pro Z = 43(Tc), 61(Pm), 75(Re) K

1 elektron. . . možné hladiny energie i. . . n, l, m více elektronů. . . obsazení jednotlivých hladin elektron má spin n, l, m, = 1 degenerace: n 2 2 n 2 Pauliho princip: žádný jednočásticový stav nemůže být obsazen více než 1 elektronem. v jednom atomu nemohou mít dva elektrony všechna 4 kv. č. stejná.

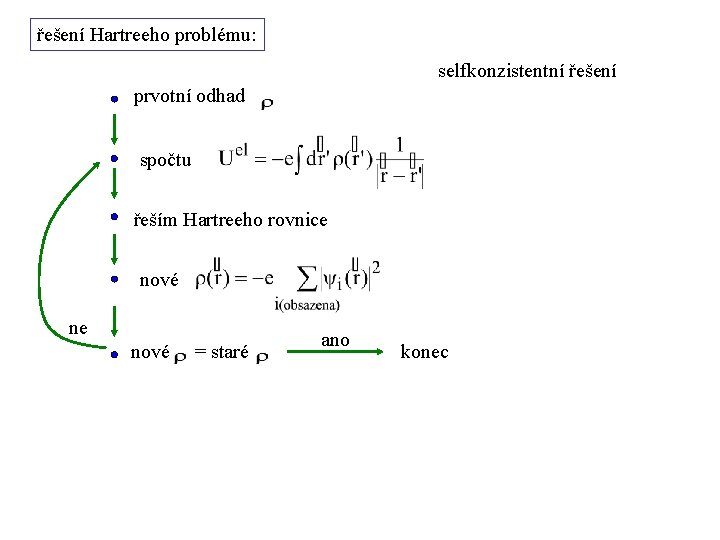
obecněji. . . N elektronů zjednodušení: 1 -elektronová aproximace elektron se pohybuje pod vlivem ostatních elektronů, ve středním poli které je v důsledku působení ostatních elektronů ("mean field") nábojová hustota Hartreeho rovnice hustota elektronů jako částic v r

řešení Hartreeho problému: selfkonzistentní řešení prvotní odhad spočtu řeším Hartreeho rovnice nové ne nové = staré ano konec

Hartreeho přiblížení - nesplňuje podmínku antisymetrie zobecnění (splňuje AS) - Hartree-Fockova aproximace: H-F rovnice: Hartree + výměnný člen

zaplňování jednotlivých kvantových stavů: základní stav nejnižší energie při splnění Pauliho principu 6 d 5 f 7 s . . 26 6 p 5 d 4 f 6 s 32 5 p 4 d 5 s 18 4 p 3 d 4 s 18 3 p 3 s 8 2 p 2 s 8 1 s 2 l = 0, 1, 2, 3, 4, 5, . . . s, p, d, f, g, h, . . .

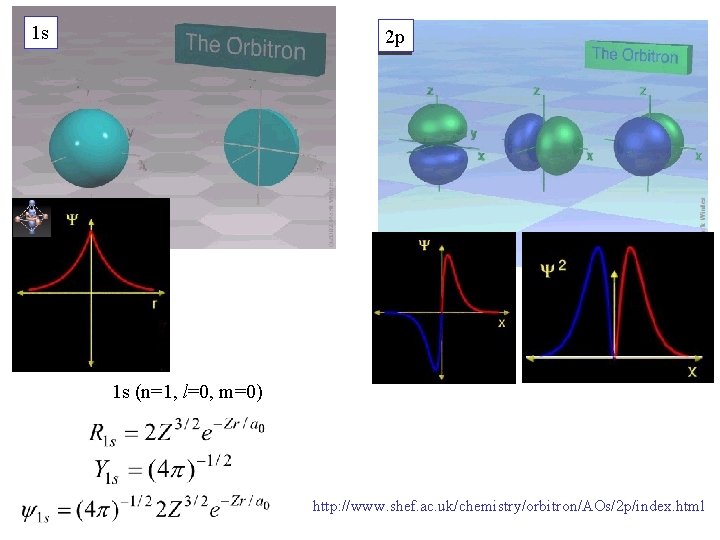
1 s 2 p 1 s (n=1, l=0, m=0) http: //www. shef. ac. uk/chemistry/orbitron/AOs/2 p/index. html

4 d 4 f

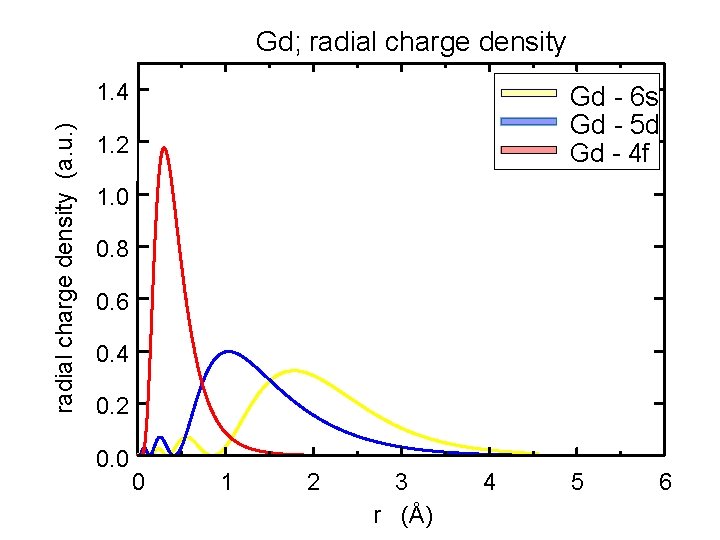
Gd; radial charge density (a. u. ) 1. 4 Gd - 6 s Gd - 5 d Gd - 4 f 1. 2 1. 0 0. 8 0. 6 0. 4 0. 2 0. 0 0 1 2 3 r (Å) 4 5 6

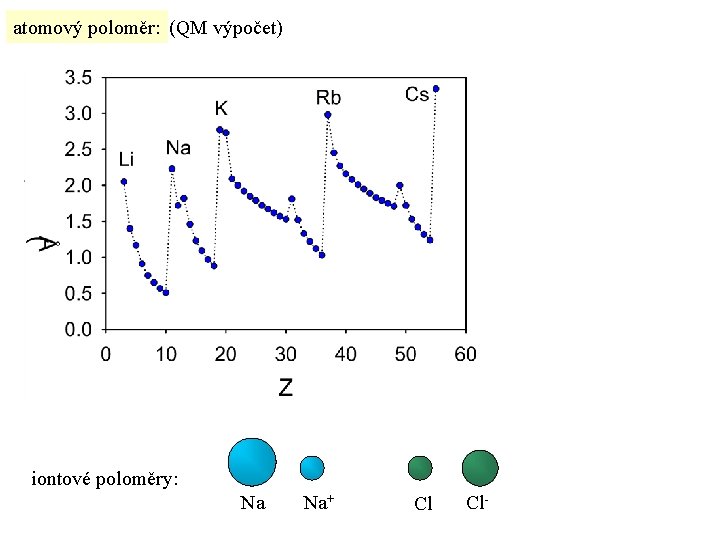
atomový poloměr: (QM výpočet) iontové poloměry: Na Na+ Cl Cl-

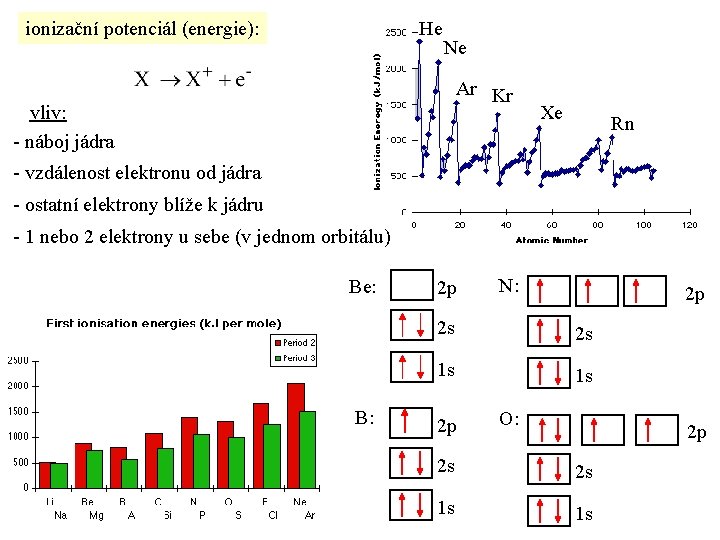
ionizační potenciál (energie): He Ne Ar Kr vliv: - náboj jádra Xe Rn - vzdálenost elektronu od jádra - ostatní elektrony blíže k jádru - 1 nebo 2 elektrony u sebe (v jednom orbitálu) Be: B: 2 p N: 2 p 2 s 2 s 1 s 1 s 2 p O: 2 p 2 s 2 s 1 s 1 s
 Csattanó maszlag termése
Csattanó maszlag termése Paracelsus
Paracelsus Kronik maruziyet merkürializm
Kronik maruziyet merkürializm Pojem internet
Pojem internet Pojem rekvalifikace
Pojem rekvalifikace Slide todoc
Slide todoc Pojem marketing
Pojem marketing Kultura pojem
Kultura pojem Stres anglicky
Stres anglicky Znak ktorým označujeme abstraktný pojem
Znak ktorým označujeme abstraktný pojem Antika časově vymezení
Antika časově vymezení Chalkogeny
Chalkogeny Jak sladká vzdechnutí
Jak sladká vzdechnutí Periodická soustava prvků prezentace
Periodická soustava prvků prezentace Periodick
Periodick Vi a skupina
Vi a skupina Diagonalni podobnost
Diagonalni podobnost Diagonální podobnost
Diagonální podobnost Teoria human relations
Teoria human relations čtyři teorie tisku
čtyři teorie tisku Paidagógos význam
Paidagógos význam Grounded theory
Grounded theory Gallager
Gallager Biofyzika počutia
Biofyzika počutia Piramida zarządzania
Piramida zarządzania Jordanova míra
Jordanova míra Figura a pozadí psychologie
Figura a pozadí psychologie Vyhýbavá citová vazba
Vyhýbavá citová vazba Multicausa
Multicausa Naivní abiogeneze
Naivní abiogeneze Kohlberg stadia
Kohlberg stadia Druh literatury
Druh literatury Petrarca mappa concettuale
Petrarca mappa concettuale Teorie efektivnostních mezd
Teorie efektivnostních mezd Teorie sulle emozioni
Teorie sulle emozioni Teorie prahových efektů
Teorie prahových efektů Teorie barev goethe
Teorie barev goethe Zakotvená teorie postup
Zakotvená teorie postup I limiti della teoria di lewis
I limiti della teoria di lewis Oparinova teorie
Oparinova teorie Teoria henderson
Teoria henderson Funkce - teorie
Funkce - teorie Neutralizace
Neutralizace Krashen
Krashen Teoria del controllo sociale
Teoria del controllo sociale Dimethylcyklohexan
Dimethylcyklohexan Teorie strun
Teorie strun